氣道壓力釋放通氣治療急性呼吸窘迫綜合征的研究進展
楊倩 梁璐
河北大學附屬醫院急診科,保定071000
近30 年來,氣道壓力釋放通氣 (airway pressure release ventilation,APRV)一直作為ARDS和低氧血癥患者的搶救模式[1-2]。它基于 “開放肺”理念,最大化維持肺復張,同時避免肺過度擴張/塌陷[1,3-6]。研究發現[7-12],對于ARDS患者,早期應用APRV 可縮短機械通氣時間、ICU 住院時間,改善患肺整體氧合,降低IL-6 [與呼吸機相關性肺損傷 (ventilator-induced lung injury,VILI)有關]濃度,具有潛在的肺保護作用。因此,有學者提出[13],將APRV 作為ARDS 患者新的 “保護性通氣”模式。本文就APRV 在ARDS 治療中的最新研究進展作一綜述。
1 APRV模式的演變
20世紀80 年代,研究發現[14-16],反比通氣能顯著改善ARDS患者氧合。隨后,反比通氣被廣泛用于ARDS患者的搶救治療中。雖然,反比通氣與APRV 在技術上存在差異,但為APRV 的探索奠定了理論基礎。1987 年,Stock等[17]選取10 只麻醉犬給予持續氣道正壓通氣(continuous positive airway pressure,CPAP)聯合反比通氣,結果發現,與間歇正壓通氣相比,前者能顯著改善氧合,清除二氧化碳,降低氣道峰壓,同時維持血流動力學穩定,具有潛在的肺保護作用。Stock等[17]首次將該模式命名為 “APRV”。自此,APRV 作為一種能改善氧合、減少非通氣肺區及具有潛在的肺保護作用的新機械通氣模式進入大家視野。
2 什么是APRV?
APRV 是一種壓力控制、時間切換、壓力限制及時間觸發的反比通氣模式,具有短暫的間歇性釋放階段,允許在整個高壓水平下釋放部分肺泡容積和自主呼吸[17]。其工作原理[18-19]:CPAP為工作基礎,由高壓相切換至低壓相釋放壓力,同時釋放過高的肺容積,避免肺過度擴張并清除二氧化碳。較長時間的高CPAP相能促進肺泡復張,優化通氣血流比,改善氧合;短暫的低CPAP相維持內源性呼氣末正壓,保持肺泡開放狀態 (“開放肺策略”),減少肺泡反復開放/閉合引起的肺剪切傷,具有潛在的肺保護作用。
3 APRV的初始設置和滴定方案
APRV 初始參數通常需設置高壓、低壓、高壓持續時間及低壓持續時間。高壓和高壓持續時間決定氣道壓高低,影響氧合。高壓本質上是維持肺復張的CPAP,決定氣道壓、釋放通氣的壓力梯度及血氧飽和度;高壓持續時間和低壓持續時間決定釋放通氣的頻率。以上參數的設置還需結合患者肺部順應性精確調整,否則,APRV 風險可能高于收益,引起VILI[4,20]。
滴定方案包括固定設置APRV 和個性化設置APRV2種。固定設置APRV 方案中,高壓持續時間小于呼吸周期的80%,低壓不為0,低壓持續時間為常數 (與肺呼吸力學參數無關)[2,21]。個性化設置APRV 也稱時間控制適應性通氣 (time controlled adaptive ventilation,TCAV),與前者區別在于個性化設置APRV 方案中高壓持續時間約占整個呼吸周期的90%,且根據呼吸力學參數滴定低壓持續時間,并維持內源性呼氣末正壓[4,11]。近年來,研究傾向于個性化設置APRV,并采用 “TCAV 方案”滴定APRV模式[4,22]。目前主要有以下2種個性化設置APRV 方案。
3.1 “Habashi”方案 2005 年,Habashi[4]首次結合患者呼吸衰竭的病因來設置初始參數和滴定方案,稱為“Habashi”方案。初始設置:高壓設置為平臺壓 [20~35 cm H2O (1 cm H2O=0.098 kPa)],低壓為0 cm H2O,高壓持續時間為呼吸周期的80%~95% (成人約4~6 s),低壓持續時間結合呼吸力學參數設定為0.35~0.6 s[23]。滴定方案:(1)在初始設置參數下,若持續指令通氣或壓力控制通氣轉換至APRV,高壓分別設置為平臺壓或氣道峰壓;(2)根據患者具體病因調整滴定方案,如胸腹部順應性降低或肥胖,則可能需要較高的高壓;(3)低壓初始設置為0 cm H2O,滴定后,低壓一般設置為5 cm H2O; (4)調整低壓持續時間,呼氣末流速與呼吸峰流速比值維持在0.5~0.75;(5)高碳酸血癥處理流程[4,18](圖1),其中B路徑 (與A 路徑相比)能顯著改善肺創傷患者病死率及肺損傷發生率。
3.2 周永芳方案 2017年,Zhou等[8]發表了迄今為止使用APRV 最成功的臨床隨機對照試驗 (randomized controlled trial,RCT)。初始設置:首先在PB-840呼吸機的持續指令通氣模式下,將呼吸頻率降至4~6次/min,隨后降低通氣流速至30 L/min,且給予充分鎮靜,測得所需參數 (平臺壓、時間常數等)。高壓設置為平臺壓,低壓設置為5 cm H2O,低壓持續時間初始設置為時間常數的1.0~1.5倍 (健康成年人為0.2 s),且調節呼氣末流速與呼吸峰流速比值>0.5,釋放頻率為10~14次/min,給予適當鎮靜保留部分自主呼吸,約占總機械通氣30%。滴定方案:(1)結合患者低氧的程度,滴定自主呼吸時間/呼吸周期波動為10%~60%,并維持呼氣末流速與呼吸峰流速比值為0.5~0.75,在呼吸機上的流量-時間曲線呈45°角的呼氣減速波形即可;(2)低氧血癥處理流程 (圖2); (3)高碳酸血癥時,減少鎮靜藥物劑量促進自主呼吸努力,同時增加釋放量或釋放頻率。
此外,Zhou等[8]首次提出APRV 模式下的撤機流程:(1)第一階段,高壓每降低2 cm H2O,同時降低釋放頻率2次/min,每天最多操作2次,每次需嚴密監測血氣以及評估患者情況。(2)第二階段,當高壓降至20 cm H2O 且吸入氧濃度≤40%時,立即進行自主呼吸試驗。若成功后,評估脫機拔管,否則持續第一階段[24]。
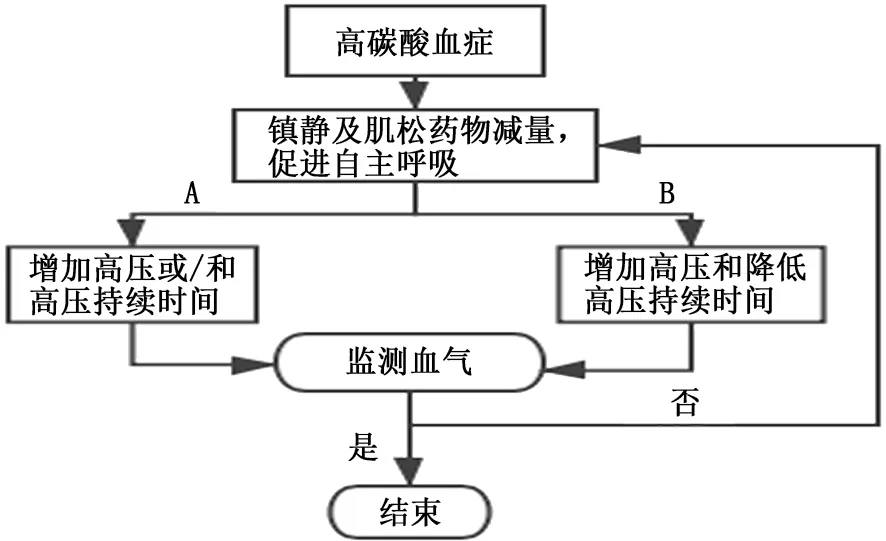
圖1 高碳酸血癥處理流程
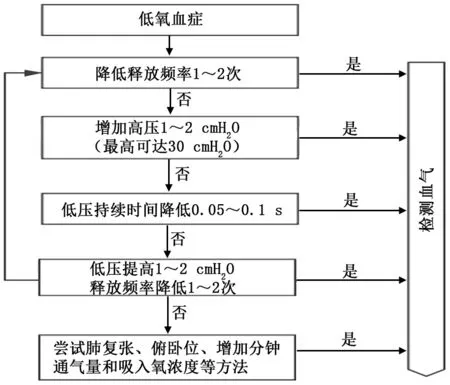
圖2 低氧血癥處理流程
4 APRV的優點
4.1 保護性肺復張 與持續指令通氣相比,APRV 能以更低的壓力維持肺泡穩定開放;另外,短暫的釋放時間和頻率僅允許部分肺泡排空肺容積,最大限度地減少由于反復肺泡塌陷/擴張引起的肺損傷,同時保留與自主呼吸相關的益處[4,25-27]。由于APRV 釋放頻率較低,維持肺單位開放性的一致程度較高,促進肺泡間的側支通氣[28-29]。另外,較長的高壓持續時間能夠維持大量肺泡復張,尤其是慢時間常數的肺泡[21,30]。肺泡不均一性增加是ARDS主要的病理生理特征,APRV 的這一優點將為ARDS患者提供更大的益處[31]。Kollisch-Singule等[32]在誘導肺損傷的大鼠模型中也證實,采用TCAV 方案 (設置較高的高壓持續時間和短暫的低壓持續時間以維持呼吸末釋放壓力高于肺泡臨界閉合壓)能夠穩定肺泡,減少肺泡微應變。
4.2 保留自主呼吸 中/重度ARDS患者肺內分流的關鍵因素是大量重力依賴區的肺泡塌陷[33]。APRV 模式下,自主呼吸的負壓通氣引起胸腔內壓力變化,改善肺通氣,促進重力依賴區的肺復張,同時避免施加額外的正壓[4,34-35]。重力依賴區 (非通氣肺單位)的肺復張可以改善呼吸系統順應性,降低肺血管阻力,優化通氣血流比,減少肺內分流,提高心指數及氧氣輸送,達到改善氧合的目的[26,34,36-37]。同樣,俯臥位通氣也具有改善肺內分流的作用,目前已制定ARDS患者俯臥位通氣的規范化流程[38]。多中心RCT 研究發現[39-41],APRV 聯合俯臥位通氣能降低中/重度ARDS患者的病死率 (由32.8%降至16%)。此外,自主呼吸促進肺和胸壁在功能殘氣量的基礎上進行擴張,預防長時間機械通氣的肌肉萎縮[42-43]。
4.3 降低驅動壓并增加平均氣道壓 與傳統的機械通氣相比,APRV能降低氣道峰壓和平臺壓(驅動壓=氣道峰壓-平臺壓),增加氣道壓,改善呼吸系統順應性,減少死腔通氣,增加肺泡通氣,降低氣胸發生率,達到改善氧合的目的[1,8-9,11,44-46]。這一特征在維持足夠肺通氣量的前提下,同時降低了致命性高氣道壓通氣誘發VILI的風險[8]。一項針對兒童ARDS的RCT 研究發現,對照組與APRV 組的氣胸發生率分別為15.4%和11.5%[47]。另外,APRV 具有較長的吸氣時間 (與反比通氣有關),產生更高的氣道壓。在一定的生理范圍內,較高的氣道壓會產生更大的平均肺容積和更高的氧分壓,進一步改善氧合[48]。
4.4 維持血液動力學穩定性 APRV 能顯著降低胸腔內壓,減輕對心臟的抑制效應,增加靜脈回心血量,提高心臟指數,維持血流動力學穩定性,恢復或接近正常的通氣血流比,改善全身組織器官灌注及氧合[34-35,49-51]。另外,Hering等的動物實驗發現,APRV (有自主呼吸組)還能影響其他臟器 (如肝臟[52]、腎臟[53]及胃腸道[54])的血流量,顯著改善該部分臟器的血流灌注。Kreyer等[55]通過油酸誘導豬損傷模型,對比APRV 自主呼吸組與APRV 無自主呼吸組治療,結果顯示,實驗組基底節、額葉、海馬、腦干、顳葉、丘腦、小腦、脊髓及中央皮質區的灌注量均較高,而無自主呼吸組基底節、額葉、海馬、顳葉血流較低,丘腦、中央皮質區、腦干、小腦、脊髓灌注與實驗組差異無統計學意義。此外,顱腦外傷的患者往往伴隨呼吸衰竭 (肺部順應性低),APRV 能在不增加顱內壓和顱內血流動力學參數前提下改善該部分人群氧合[56-58]。
4.5 減少鎮靜及神經肌肉阻滯藥物劑量 與持續指令通氣相比,APRV 模式下鎮靜及神經肌肉阻滯藥物的劑量較低[8,26,49,59]。APRV 模式保留部分自主呼吸,容量波形接近健康成人的正弦曲線,人-機同步性較高,減少鎮靜及神經肌肉阻滯藥物的劑量,最大限度地發揮自主呼吸的益處。Zhou等[8]將氧合指數<200 mm Hg的ARDS患者隨機分為低潮氣量 (ARDSnet方案)組和APRV 組 (類似TCAV方案),結果顯示:APRV 組患者的住院時間、氣管切開術需求、呼吸機時間及病死率較前者顯著降低,且降低對俯臥位、鎮靜及神經肌肉阻滯藥物的需求。Sydow 等[36]研究發現,當患者從容量控制通氣過渡到APRV 時,神經肌肉阻滯藥物的劑量顯著減少,鎮靜藥物的劑量減少了2~4倍。此外,隨著氣道峰壓的降低,患者的鎮靜藥物劑量也明顯降低[18]。
4.6 降低VILI的發生率 機械通氣是ARDS治療的重要組成部分,但也可能會加重肺損傷,引起VILI。大量研究發現[7-9,30,60-61],TCAV 方案能穩定肺泡 (肺泡導管)微解剖結構及降低肺泡動態應力,早期應用可以降低ARDS患者VILI的發生率。另一項研究也證實[62],與容量控制通氣相比,TCAV 方案降低雙調節蛋白 (與肺泡牽張相關)和血管細胞黏附分子1 (與內皮細胞損傷相關)的表達,增加Syndecan-1 (與細胞外基質與上皮細胞連接相關)m RNA 的表達。此外,有研究者通過豬腹腔膿毒癥/腸缺血再灌注損傷、多器官功能障礙及ARDS 的3 種模型發現[7,9,45,63-65],TCAV 方案在阻止急性肺損傷和防止ARDS進展方面顯著優于容量控制通氣或ARDSnet方案,且與ARDSnet方案相比,TCAV 能更好地保存表面活性蛋白A及表面活性蛋白B。
5 APRV的爭議
APRV 通過高CPAP水平維持大量塌陷肺泡復張,提高氣道壓,改善氧合;低CPAP 水平維持小氣道壓力,保持肺泡開放狀態,排出過高肺容積,減少肺容積傷。因此,APRV 能降低VILI風險。但APRV 的自主呼吸做功很高,產生較高的胸膜壓力梯度、跨肺壓及跨血管壁壓,可能會增加肺損傷和肺水腫的風險[1,48,66-70]。Lalgudi Ganesan等[66]首次將APRV 作為ARDS患兒主要通氣模式,由于APRV 組相對于低潮氣量組具有更高的病死率趨勢 (53%比37%),在收集了52例ARDS患兒后提前終止試驗,但研究結果發現2 組之間的預后基線存在顯著差異。隨后,Hirshberg等[69]在成人ARDS 患者中也進行了一項RCT研究 (與Lalgudi Ganesan等[66]的研究方法相似),結果發現:2組患者在氣胸、鎮靜、血管活性藥物、氧合指數及預后方面差異無統計學意義。雖然這2個RCT 的研究結果相反,但同Lalgudi Ganesan等[66]的研究相似,Hirshberg等[69]的研究也因部分患者潮氣量超過12 ml/kg (ARDSnet推薦潮氣量6 ml/kg)而不得已終止試驗。Nieman 等[63]認為,當采用TCAV 方案時,潮氣量的增加是肺復張的積極效果,之所以Hirshberg 等[69]和Lalgudi Ganesan 等[66]的研究提前終止,是因為二者的APRV 設置都沒有采納TCAV 方案的關鍵保護機制 (完全開放肺的能力)。因此,2位研究者的結論不應該是 “APRV 對肺沒有保護作用”,而 是 Zhou 等[8]的 方 法 優 于 Hirshberg 等[69]和Lalgudi Ganesan等[66]的肺保護方法。如需進一步證實APRV的有效性,仍需大量RCT結果,目前條件下很難實現。
6 APRV在兒科中的應用
回顧目前研究[61,71-72],APRV 對于危重兒童的有效性和實用性僅限于病例報告、病例系列、小樣本量的回顧性及前瞻性觀察性隊列研究,以及部分從成人研究中推斷出來的結論。部分早產兒病例中也存在成功使用APRV 的報道,但證據質量較低[73-74]。與成人相似,兒科患者中APRV 最常見的適應證是作為繼發于ARDS患者的難治性低氧血癥的搶救治療。Lalgudi Ganesan等[66]首次在ARDS患兒中采用APRV,由于試驗組較高的病死率趨勢 (53%比37%)提前終止試驗,研究結果發現2組之間的預后基線存在顯著差異。另外,先天性心臟病患兒是一個獨特的群體,他們可能受益于APRV 模式。Walsh 等[75]研究APRV 在兒童腔靜脈分流術和法洛氏四聯癥修復術中的應用時,發現APRV 能改善該部分患兒的肺血流量 (與氣道壓增加相關)。推測可能是由于APRV 能穩定該部分患兒的血流動力學,改善心肺交互作用及繼發于自主呼吸努力的綜合效應。總之,APRV 模式對中重度ARDS患兒預后的影響仍需大量臨床研究佐證。
7 結論
APRV 是一種兼具理論風險和效益的通氣模式。由于患者群體少且異質性強,不同研究組采納的APRV 方案不一致,臨床醫師之間也缺乏相應的共識,導致APRV 能明顯改善預后的直接臨床證據匱乏。針對目前研究現狀,多中心RCT 當然是確定臨床有效性和安全性的金標準。要做到這一點,必須要對APRV 的滴定方案達成共識。采納TCAV 方案,也許是我們共同邁進的目標。
展望未來,在體外膜肺氧合期間聯合APRV,能在低氣道峰壓下改善肺復張,鍛煉膈肌功能,縮短拔管后機械通氣的時間[76]。鑒于迄今為止,體外膜肺氧合聯合APRV策略尚未進行深入的研究,在未來幾年將會受到大家的關注。
利益沖突所有作者均聲明不存在利益沖突

