L-組氨酸修飾乳清蛋白結構及其熱誘導凝膠特性
王耀松,馬天怡,胡榮蓉,張唯唯,應瑞峰,黃梅桂,唐長波,*
(1.南京林業大學輕工與食品學院,江蘇 南京 210037;2.肉品加工與質量控制教育部重點實驗室,南京農業大學食品科學技術學院,江蘇 南京 210095;3.南京農業大學食品科學技術學院 農業農村部肉品加工重點實驗室,江蘇省肉類生產加工與質量控制協同創新中心,江蘇 南京 210095)
近些年來對小分子物質堿性氨基酸——精氨酸(Arg)、賴氨酸(Lys)和組氨酸(His)與蛋白質相互作用機制等理論方面的研究取得了一些進展[1-5]。同時也開展了這些氨基酸在食品蛋白體系中的應用研究,以改善食品蛋白基質凝膠性[3,6]、乳化性[7]和溶解性[5,8]等功能特性。堿性氨基酸是構成蛋白的基本單元,無毒、無免疫性且來源廣泛、經濟便宜[9],現已批準作為香料添加劑加入食品中[10]。
研究發現His在低離子強度環境下通過延長雞胸肌球蛋白輕鏈和桿部的長度提高蛋白的溶解性,降低成膠溫度并促使蛋白形成結構更加細致的透明凝膠[11-12];在鳙魚肌纖維蛋白體系中通過添加His改變溶液的pH值從而改變蛋白帶電量、并與芳香族氨基酸相互作用而抑制蛋白成膠[13],另外在低離子強度的蛋白溶液中,His通過打斷蛋白結構展開的蛋白間靜電作用力、擾亂蛋白表面疏水性而弱化蛋白凝膠[14]。Guo[15]和Zhang Yawei[16]等發現,His引起豬肉肌纖維蛋白的二級結構有序性降低、暴露疏水基團和巰基基團而提高蛋白溶解性,再結合NaCl處理能夠提高肌纖維蛋白熱誘導凝膠性和持水性[16]。Hayakawa等[17]研究結果顯示His通過抑制雞胸重鏈肌纖維蛋白聚合而促進凝膠完整結構的形成。Chen Xing等[5]認為His的咪唑基結構對提高肌纖維蛋白的溶解性起到重要作用。此外His能顯著增強兔肉肌球蛋白的溶出率、凝膠強度和保水性[18];還可以通過與鐵離子配位提高血紅蛋白的穩定性[19]。從營養功能上來講,His是人體營養的必需氨基酸[20]。
目前研究內容集中在肌纖維蛋白的結構及其凝膠性能,鮮見對L-His的質量濃度效應、乳清蛋白構象及所成凝膠中化學作用力的影響作系統研究。本課題組在近期的研究中比較了不同堿性氨基酸對乳清蛋白熱誘導凝膠功能性有修飾作用[9],選用乳清蛋白作為模式蛋白,著重討論系列質量濃度的L-His在不同pH值下(2.00、5.20、7.59、9.74、10.76;后4 種pH值分別對應乳清蛋白、His、Lys和Arg的等電點)對蛋白結構的影響,以及這種影響與蛋白所成凝膠功能性之間的內在關系,以期為L-His改善蛋白凝膠性提供理論參考。
1 材料與方法
1.1 材料與試劑
乳清蛋白WPI-90 美國加州Hilmar公司;L-His生工生物技術(上海)股份有限公司;其他試劑均購自國藥集團化學試劑有限公司;所有試劑均為分析純。
1.2 儀器與設備
TA-XT plus質構儀 英國Stable Micro Systems公司;BT-90納米激光粒度分布儀 丹東百特儀器有限公司;Nanoplus 2 Zeta電位儀 麥克默瑞提克(上海)儀器有限公司;NanoDrop2000C超微量分光光度計 賽默飛世爾科技(中國)有限公司;SpectraMax?i3x多功能酶標儀美谷分子儀器(上海)有限公司;FE28 pH計 梅特勒-托利多儀器(上海)有限公司;DK-S26電熱恒溫水浴鍋上海精宏實驗設備有限公司;UVmini-1240紫外-可見分光光度計 島津企業管理(中國)有限公司。
1.3 方法
1.3.1L-His/乳清蛋白混合溶液的制備
稱取一定質量乳清蛋白加入去離子水中充分攪拌直至全部溶解,使得蛋白質量濃度為120 mg/mL;加入最終質量濃度分別為0、1、3、5 mg/mLL-His后充分攪拌,將每個質量濃度分成5 部分,使用1 mol/L HCl或NaOH溶液,再將各組蛋白溶液pH值分別調節至2.00、5.20、7.59、9.74和10.76。放置4 ℃備用。
1.3.2 粒徑和Zeta電位測定
根據Cheng Yu等[21]的方法修改。用蒸餾水將新鮮制備的儲備溶液均稀釋到10 mg/mL,使用BT-90納米激光粒度分布儀測定粒徑,并用Nanoplus 2 Zeta電位儀測定其Zeta電位。
1.3.3 紫外光譜測定
根據Agyare等[22]的方法修改。使用與儲備樣品相同pH值的蒸餾水將蛋白樣品稀釋到2 mg/mL,再應用超微量分光光度計記錄已稀釋好的樣品在240~380 nm波長范圍的吸光度。
1.3.4 熒光光譜掃描
根據Agyare等[22]的方法修改。使用1.3.3節方法稀釋的樣品,應用SpectraMax?i3x多功能酶標儀掃描上述稀釋蛋白溶液的熒光強度。激發光波長和發射光波長(300~500 nm)的狹縫設置為5 nm,激發波長設置為280 nm,測定300~500 nm波長下熒光強度。
1.3.5L-His/乳清蛋白凝膠的制備
將不同質量濃度的L-His、不同pH值的蛋白儲備溶液每份準備25 mL,加入內徑35 mm、高度30 mm的小燒杯內,90 ℃水浴中加熱30 min,取出置于冰水浴冷卻至室溫,置于4 ℃以下過夜(12 h)成凝膠后待用。從燒杯內小心取出,倒置于黑色背景絨布上,為凝膠豎立面拍照及功能性、化學作用力測試用。
1.3.6 凝膠質構測定
采用質構儀2 次下壓的模式測定凝膠的質構特性。探頭測試前、測試中及測試后的速率分別設置為1.0、2.0 mm/s和5.0 mm/s;下壓距離10.0 mm,觸發力5.0 g;凝膠形狀為圓柱形(35 mm×30 mm)。凝膠質地以Bourne[23]定義計算其硬度、彈性、黏聚性、膠黏性、咀嚼性和回復性。每個處理重復測定3 次。
1.3.7 化學作用力測定
參照Chawla等[24]的方法測定對照組(0 mg/mL)、5 mg/mLL-His/乳清蛋白混合凝膠中的化學作用力。采用在4 種溶劑中的溶解度表示,分別將它們標記為S1、S2、S3、S4,試劑分別為S1:pH 8.0 20 mmol/L Tris-HCl;S2:pH 8.0 20 mmol/L Tris-HCl含有10 mg/mL十二烷基硫酸鈉(sodium dodecyl sulfate,SDS);S3:pH 8.0 20 mmol/L Tris-HCl含有10 mg/mL SDS和8 mol/L尿素;S4:pH 8.0 20 mmol/L Tris-HCl含有10 mg/mL SDS、8 mol/L尿素和2%β-巰基乙醇。每份稱取1.0 g的凝膠,分別加入8 mL上述溶液,在室溫條件下搖勻靜置過夜,采用雙縮脲法測定溶解出的蛋白質含量。溶解度定義為溶出蛋白所占凝膠塊內總蛋白的比例。
1.3.8 持水性測定
參考Wang Yaosong等[25]的方法,取適量質量(2.0 g)乳清蛋白凝膠置于含濾紙的離心管中,3 000×g離心20 min,再稱離心后的凝膠質量。持水性(waterholding capacity,WHC)按下式計算:

式中:m1為凝膠、離心管和濾紙的質量;m為離心管與濾紙的質量;m2為離心后去除凝膠的質量。
1.4 數據處理
數據處理使用Statistix軟件(Analytical Software,Tallahassee, FL, USA)進行統計分析;用LSD檢驗數據間的差異顯著性,P<0.05,差異顯著。
2 結果與分析
2.1 L-His對乳清蛋白粒徑、比表面積和Zeta電位的影響

圖 1 不同pH值時L-His對乳清蛋白粒徑(A)、比表面積(B)及其Zeta電位(C)的影響Fig. 1 Influence of L-His on whey protein particle size (A), specific surface area (B) and zeta-potential (C) at various pH values
如圖1所示,從分子聚集、靜電行為的角度來看,L-His與乳清蛋白間的相互作用改變了蛋白聚集行為及其帶電性,進而造成對蛋白凝膠性能的影響。在乳清蛋白等電點時(即pH 5.2),蛋白粒徑在1 680~1 780 nm波長范圍內,顯著大于在其他pH值時所形成的蛋白聚集體粒徑(約為370~470 nm),而越遠離等電點時蛋白聚集體粒徑越小[26],并隨著L-His質量濃度的增加而進一步減小聚集體粒徑。蛋白聚集體的比表面積與蛋白聚集體粒徑有相反的變化規律;在pH 5.2時,其比表面積值達到最小值;越遠離等電點,特別是在堿性pH值條件下蛋白聚集體的比表面積增大50~70 倍。此外,蛋白分子在pH 2.0時帶有少量的正電;在乳清蛋白等電點時,其中非乳球蛋白可能因蛋白羧基、氨基去質子化而使蛋白帶少量的負電荷;pH值的提高促使蛋白分子去質子增多而帶更多的負電荷,而L-His進一步提高蛋白分子的帶負電荷。L-His不及pH值對蛋白聚集體的粒徑、比表面積及帶電性的影響顯著,然而在同等pH值時它能夠進一步改變乳清蛋白聚集體的粒徑、比表面積和帶電量,從而為乳清蛋白所形成凝膠功能性的改善提供了重要的分子基礎。
2.2 L-His對乳清蛋白結構的影響

圖 2 不同pH值時L-His與乳清蛋白相互作用的紫外光譜Fig. 2 UV absorption spectra of whey protein interacted with L-His at various pH values
為進一步說明L-His對乳清蛋白分子結構的影響,采用紫外光譜和熒光光譜的方法對乳清蛋白成膠溶液進行表征。蛋白分子中能夠引起紫外吸收和熒光吸收的主要是色氨酸(Trp)和酪氨酸(Tyr)及苯丙氨酸(Phe)[27-28]。從圖2可以看出,在低于乳清蛋白等電點的pH值時,隨著L-His質量濃度的提高,樣品的紫外吸收強度明顯上升(圖2A);在蛋白等電點時,L-His質量濃度的提高反而引起樣品的紫外吸收強度下降,但比對照組要高(圖2B);隨著pH值越過蛋白等電點并進一步提高時,樣品的紫外吸收強度開始降低,L-His質量濃度的提升在此基礎上進一步降低蛋白的紫外吸收強度(圖2C~E)。
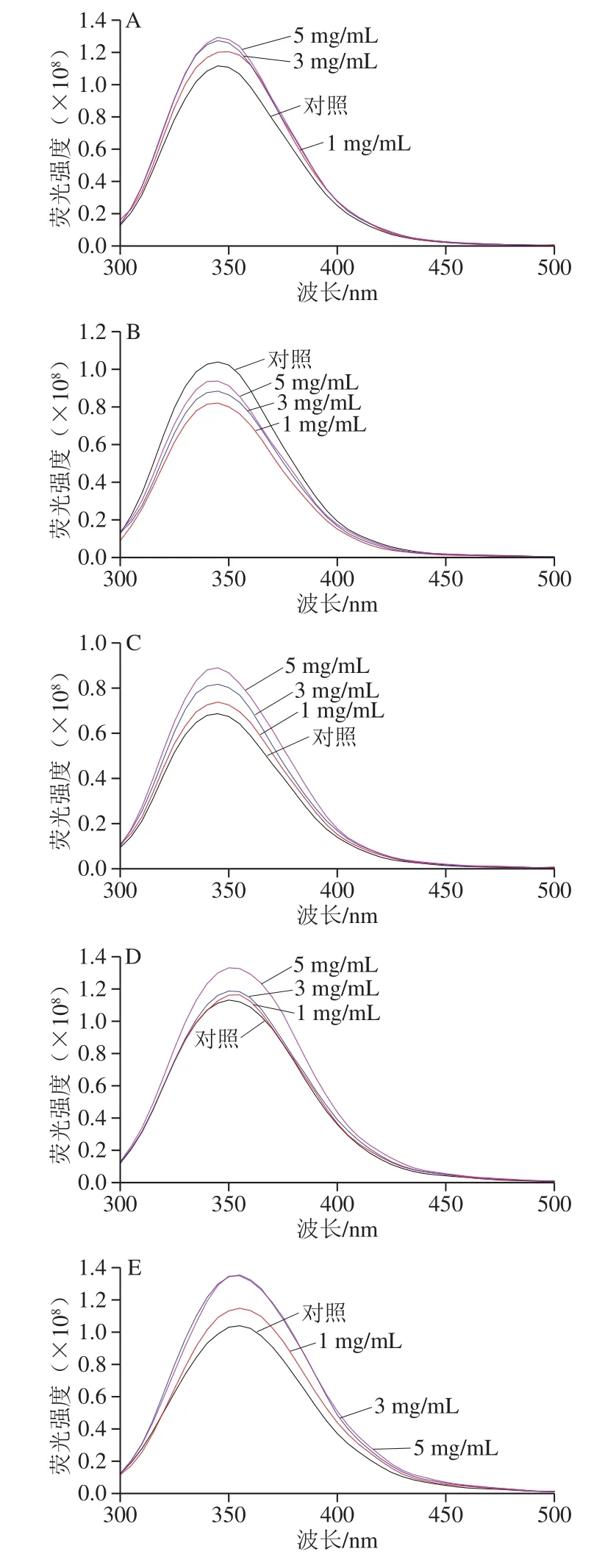
圖 3 不同pH值時L-His與乳清蛋白相互作用的熒光光譜Fig. 3 Fluorescence spectra of whey protein interacted with L-His at various pH values
在熒光光譜中(圖3),除在乳清蛋白等電點之外的pH值,L-His的加入均能有效提高樣品的熒光強度,在pH值遠離等乳清蛋白電點時樣品的熒光強度更大(圖3A、E)。對熒光強度提升貢獻的氨基酸主要是Trp、Tyr和貢獻極小的Phe[28],并且3 種氨基酸的疏水性順序依次為Phe、Trp和Tyr。結合以上2 種蛋白光譜在不同pH值和不同質量濃度L-His下的行為,可推測越遠離等電點的pH值,L-His賦予蛋白帶有更多的絕對電量,促使蛋白分子結構“折疊”和聚集體形成;即在酸性環境下(pH 2.00)促使乳清蛋白分子間聚集體變小從而致使Tyr和Trp暴露,而堿性條件(特別是pH 9.74、10.76)導致單個蛋白分子更多展開而使Tyr更多暴露,并讓蛋白變得更易親水而顯著提高蛋白熒光強度。此外在遠離等電點的pH值中,特別是在堿性pH值條件下,蛋白分子從Tyr殘基到Trp殘基之間還可能存在能量轉移而導致Tyr熒光猝滅及Trp熒光增強[29-30]。綜合蛋白分子間聚集、單個蛋白分子結構展開程度和發生在氨基酸之間的熒光轉移等因素的效應,L-His在一定程度上進一步促進這些因素的影響程度,從而實現對乳清蛋白的結構改變而改善其所成凝膠的功能性。
2.3 L-His對乳清蛋白熱誘導凝膠形貌及質構的影響

圖 4 不同pH值及不同質量濃度L-His時乳清蛋白熱誘導所成凝膠的感官形貌圖Fig. 4 Appearance of heat-induced whey protein gels with added L-His at various pH values
作為蛋白凝膠,其形貌和顏色對其在真實食品體系中的應用極為重要。從圖4可看出,在其等電點處,乳清蛋白可形成白色、粗糙的凝膠;而在遠離等電點pH 2.00時,凝膠的“完整性”開始降低,且黃度顯著增加;隨著pH值越過乳清蛋白等電點時,凝膠在結構上更加完整、細膩且顏色呈現更高的黃度。對于在同一pH值時,L-His的加入能夠有效提高凝膠的完整性,但對顏色影響不及pH值的影響大。在以前的一些研究中,也發現了堿性氨基酸加入到蛋白中,能夠促進疏水基團及反應性巰基基團的外露而致使凝膠性能的提升[31-32]。至于顏色的變化,在一些報道中認為是美拉德反應造成的[33]。
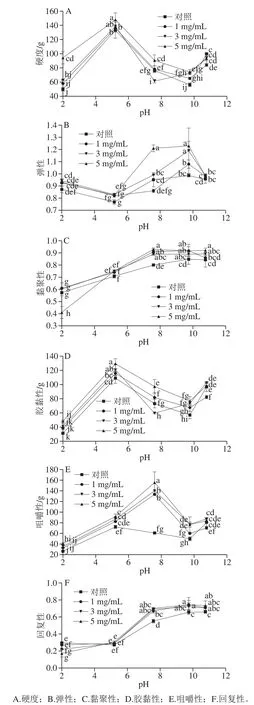
圖 5 不同pH值時L-His對乳清蛋白熱誘導凝膠質地的影響Fig. 5 Influence of L-His on textural properties of heat-induced whey protein gels at vairous pH values
如圖5所示,為了滿足對食品多功能性凝膠質構多樣性的要求以符合真實食品體系的不同要求,本研究對乳清蛋白熱誘導凝膠的全質構進行了系統測定。在乳清蛋白等電點pH 5.20處所形成的凝膠要比其他pH值條件下所形成的蛋白凝膠具有極顯著性高的硬度,其數值在130 g左右;而在pH 2.00或pH 7.59及pH 9.74條件下所形成蛋白凝膠的硬度偏低,但隨著pH值升至10.76,其強度又顯著上升至80~100 g。L-His的加入,特別是當L-His的質量濃度為5 mg/mL之時(圖5A),能夠顯著提升凝膠的硬度。凝膠的膠黏性(圖5D)也有類似的現象。凝膠的彈性除了在等電點處有所降低,在pH 7.59和pH 9.74時達到最高值后隨即略有下降(圖5B)。而對于凝膠的黏聚性和回復性,其值均隨著pH值的提高而顯著提高(P<0.05),在pH 7.59之后趨向平穩。L-His質量濃度效應對凝膠的黏聚性和回復性的提高不及pH效應顯著,但對于同一pH值下,特別是pH 2.00和pH 7.59下卻能夠顯著提高黏聚性和回復性(P<0.05)。隨著pH值的升高至7.59,凝膠的咀嚼性值升到最大值,在pH 9.74時咀嚼性顯著下降(P<0.05),但在pH 10.76時其值又略有上升;而L-His的加入則能夠提高凝膠咀嚼性,特別是能夠極顯著地提高在pH 7.59時所成凝膠的咀嚼性(P<0.05)。總體看,L-His能夠顯著提升和改造乳清蛋白熱誘導凝膠的一些質構特性;再結合pH值成膠條件,則能夠形成多質構功能特性的凝膠。
2.4 L-His對乳清蛋白熱誘導凝膠分子間作用力的影響
熱誘導凝膠中分子間的作用力主要是二硫鍵和疏水相互作用力、氫鍵和靜電相互作用力,這些力維系膠體的凝聚態[34]。為了探究在加入L-His后熱誘導蛋白凝膠中作用力的變化,測定了凝膠中的蛋白在4 種不同溶液中的相對溶解度,結果如表1所示。在對照組中(無L-His),pH 2.00下所形成凝膠中的疏水作用力、氫鍵是主要作用力;在乳清蛋白等電點(pH 5.20)下所成凝膠,其中主要作用力是氫鍵及少量的二硫鍵;在pH 7.59和pH 9.74下所成凝膠中的作用力則主要是二硫鍵,相比之下疏水相互作用力和氫鍵則很微弱;然而在pH 10.76,凝膠中主要作用力又轉為氫鍵,而其他2 種作用力對膠體內部作用力貢獻不大。加入5 mg/mLL-His后,則能顯著降低(P<0.05)在pH 2.00下所成凝膠中的二硫鍵作用力,而在此時對凝膠中的疏水相互作用力和氫鍵影響不顯著(P>0.05);卻能顯著提高(P<0.05)在pH 5.20和pH 7.59時所成凝膠中的二硫鍵作用力,但對疏水作用力和氫鍵影響不大;也顯著降低了在pH 9.74下所成凝膠中的二硫鍵作用力;當pH值提升到10.76后所成凝膠,L-His的加入卻顯著提高疏水作用力和氫鍵作用力,但對二硫鍵影響不顯著。在一些研究中,發現二硫鍵與凝膠的彈性有極強的正相關關系[35];在本研究中也發現此現象,圖5B顯示凝膠彈性變化規律與表1中的二硫鍵含量變化之間有一致的關系。總之,L-His的加入改變了凝膠中的各種作用力,這為凝膠質地多樣功能性提供了一種策略。
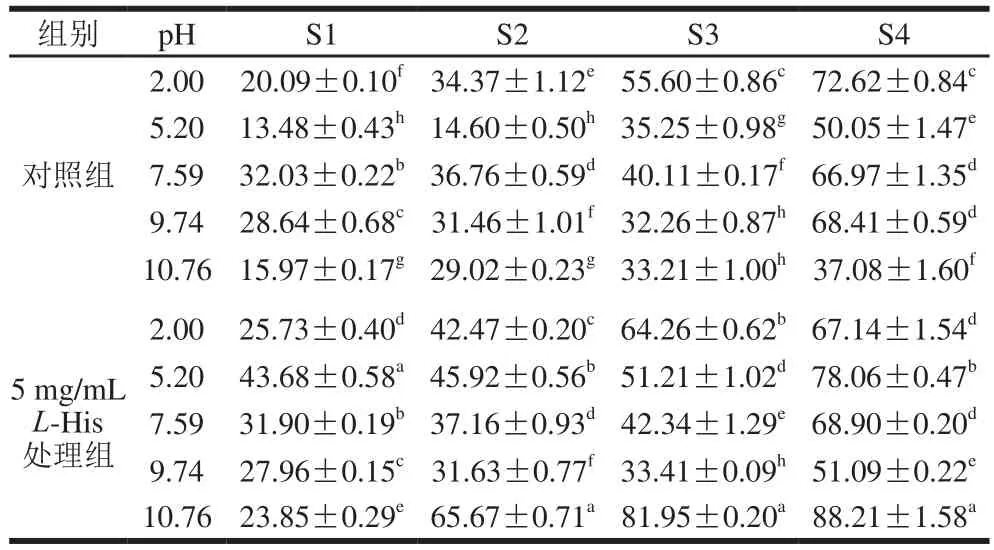
表 1 L-His修飾乳清蛋白熱誘導凝膠在不同溶液中的蛋白溶解度Table 1Protein solubility of heat-induced whey protein gels modified by L-His in various solvents
2.5 L-His對乳清蛋白熱誘導凝膠持水性的影響

圖 6 不同pH值時L-His對乳清蛋白熱誘導凝膠持水性的影響Fig. 6 Influence of L-His on WHC of heat-induced whey protein gels at various pH values
持水性是凝膠的一個重要功能性質,同時也是凝膠微觀結構的反映[36]。由圖6可以看出,在乳清蛋白等電點處所形成的蛋白凝膠,其持水性最低。在pH 2.00時凝膠持水性顯著性高,隨著pH值越過等電點提升到7.59后,無論是對照組還是加入L-His的處理組,凝膠持水性均隨著pH值升高而顯著提高(P<0.05)。此外,對于同一pH值下,L-His的加入則能進一步顯著提高凝膠持水性(P<0.05),特別是質量濃度5 mg/mLL-His的加入。在乳清蛋白等電點處所形成的凝膠,蛋白分子由于幾乎不帶電,其形成比在其他pH值下大4~5 倍的聚集體平均粒徑并有極小的比表面積(圖1B),這些粒子與水分子相互作用較弱[37];在微觀結構上也發現這些粒子形成結構松散的球形聚結體[9];這些結果預示著良好的蛋白凝膠形成要選擇遠離其等電點。除在乳清蛋白等電點pH 5.20外,L-His通過抑制蛋白聚集、提高聚集體比表面積并促進蛋白分子帶電量,形成有序微觀結構而顯著提高凝膠持水性。
3 結 論
在乳清蛋白中加入L-His并結合pH值調節,可形成具有不同質構特性、持水性和不同顏色的熱誘導凝膠。pH值改變乳清蛋白構象和帶電量,在微觀尺度上形成不同粒徑和比表面積的聚集體;L-His在此基礎上進一步促進這些物理化學效應,改變凝膠中的化學作用力,形成有序結構進而顯著提高凝膠的質構性能和持水性。此外在乳清蛋白等電點時,乳清蛋白所形成凝膠呈現白色并且結構粗糙,而越遠離其等電點時凝膠黃度越大且結構細膩(特別是在堿性條件下),但L-His對顏色和細膩度影響不顯著。廉價且安全的天然產物L-His,可作為一種提高蛋白基質凝膠功能的增強劑。

