候選門級輻射類群(candidate phyla radiation)細菌的生理生態與進化
蔣建東,紀彥晗,王保戰
(南京農業大學生命科學學院微生物學系 農業農村部農業環境微生物重點實驗室,江蘇 南京 210095)
候選門級輻射類群(candidate phyla radiation,CPR)細菌是指一類由候選門細菌組成的細菌類群,該概念于2015年由Brown等人提出[1]。CPR細菌不僅細胞體積比普通細菌小(大多數CPR能夠通過0.2 μm的微孔濾膜),與之對應的其基因組也普遍較小(平均基因組≤1.25 Mbp,且缺少很多核心代謝途徑的編碼基因)。因此,推測絕大多數CPR以共生或者寄生的方式存在于各類生態環境中[2]。CPR細菌的16S rRNA基因結構特殊,常常包含大量插入序列,目前常規細菌通用PCR引物無法有效擴增大多數的CPR細菌,因此CPR細菌長期以來一直被忽視[3]。CPR細菌系統發育地位特殊,在生命進化樹上能夠形成龐大且“獨立”的分支[4-5],與細菌域的其他類群顯著性地分開(圖1)。2016年Hug等從JGI數據庫中搜集了30 437個微生物基因組,并從中挑選出屬水平的3 083個高質量草圖基因組/基因組完成圖作為代表基因組,然后分別使用16S rRNA基因序列、16個保守的核糖體蛋白串聯序列構建系統發育進化樹,同樣證明CPR細菌的獨特進化地位[4]。此外,2019年Zhu等搜集了10 575個基因組,分別用381個標記基因、30個保守核糖體蛋白序列構建系統發育樹,同樣也得到了類似的結果[5]。
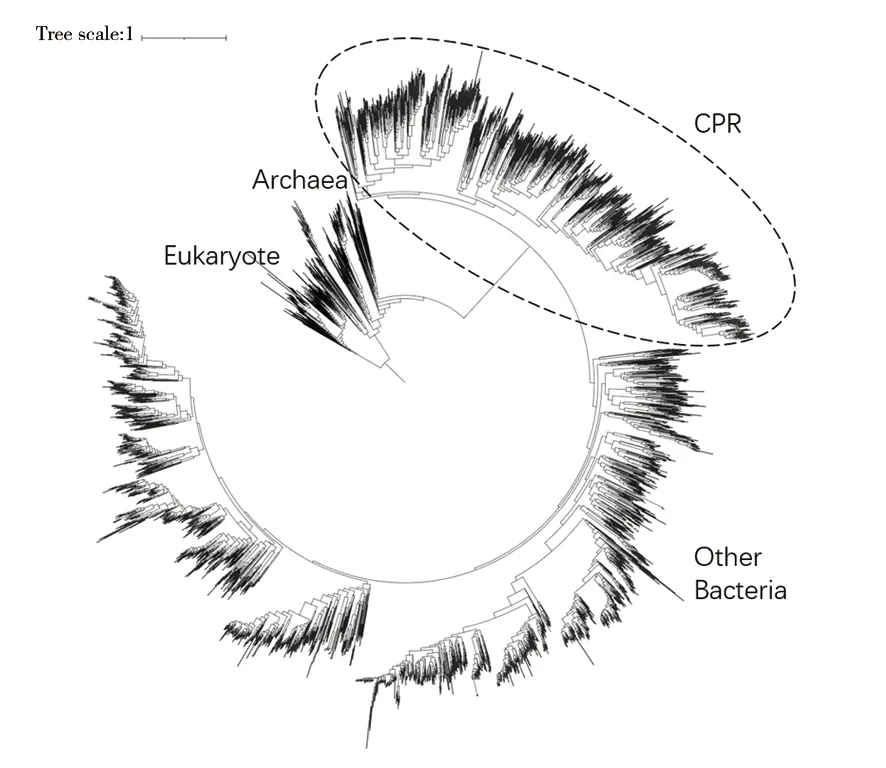
圖1 CPR細菌在生命進化樹上的進化地位
CPR細菌在地球上分布非常廣泛,存在于地下水[1,6-8]、鹽湖[9-10]、口腔[11-14]、海洋[15-17]等各種生境中,在地球生物化學循環中也扮演著重要角色。隨著基因組學與生物信息學的快速興起與發展,截止2018年科學家們發現CPR細菌包含了70多個門級水平的分支[2],2019年科學家們預測CPR細菌可能占據細菌多樣性的四分之一[18]。盡管如此,人們對CPR這樣一個特殊的細菌類群的了解仍處于初步階段。人們一直推測CPR細菌以共生或寄生的方式存在于環境中,極難獲得純培養菌株。因此,人們對CPR生理特性、代謝功能與機制等知之甚少。到目前為止,僅有一類CPR細菌(稱為TM7)在實驗室條件下得到了純的二元培養物,TM7這類微生物能且僅能依附于宿主進行生長[11,13-14,19]。
基于CPR細菌的重要性以及獨特性,本文重點針對CPR細菌的發現歷程,細胞形態、基因組學特征和遺傳進化,生理代謝潛能,生物地球化學元素循環和實驗室純培養等方面進行綜述,為未來CPR細菌的進一步研究提供參考。
1 CPR細菌的研究歷程
1996年Rheims等[20]、1998年Philip等[21]在通過16S rRNA基因對環境樣品進行細菌檢測時,發現 TM7和OP11(以采樣地點的縮寫命名)分支能在進化樹上形成獨立的分支(無法定位到已知菌屬中),這是第一次發現CPR細菌的存在(圖2),但當時并未引起科研界的足夠重視。2012年Wrighton等[6]首次使用宏基因組技術研究發現地下水中存在特殊的未培養微生物(BD1-5、OP11、OD1),然而此類微生物的分類地位在當時并未明確。2015年Brown等[1]通過宏基因組測序技術分析了美國科羅拉多河地下水樣品,共獲得了797個CPR細菌的基因組(metagenome-assembled genomes, MAGs),這些基因組分屬于35個細菌門。進一步從這些MAGs中提取16S rRNA基因序列并剔除其中的插入序列后構建系統發育樹,發現這些新的CPR細菌門與之前發現的一些候選門(OD1、OP11)聚類在一起,且在系統發育樹上形成獨立分支。由于這些特殊的細菌在當時都無法在實驗室條件下獲得純培養物,Brown等將這類由候選門細菌組成的單系分支命名為候選門級輻射類群(candidate phyla radiation,CPR)。因缺乏對CPR生理代謝等多方面的了解,最初發現的CPR細菌均以微生物學終身成就獎獲得者的姓名來命名CPR門(比如以美國著名的微生物學家Carl Woese 命名了Woesebacteria門)。自2015年后,越來越多的CPR細菌類群被發現,截至2018年已發現至少70多個門級水平的CPR分支[2]。然而,目前在實驗室條件下能獲得純培養的CPR細菌僅有TM7一個門級分支(已從人體口腔與廢水中分離出5株TM7[11,13-14,19])。2013年Rinke等[22]對來自不同環境樣品中的未(難)培養微生物進行單細胞測序時發現,OD1、OP11、GN-02三個門的CPR細菌在系統發育樹上形成單系分支,為直觀認識此3個門之間的關系,Rinke等便提議將由這3個門組成的“超系”命名為佩特斯細菌(Patescibacteria)。2018年Parks等在構建微生物標準基因組數據庫時發現Patescibacteria與CPR代表著同一類細菌,于是便提議將CPR細菌重新命名為Patescibacteria,當時包含了至少65個門的CPR細菌分類[23]。截至2021年8月,CPR細菌一共包含了超過75個門級水平的分支(表1)。

圖2 CPR細菌的發現與研究歷程

表1 現已知CPR細菌在門水平的成員信息
近年來,針對CPR細菌在自然環境中的分布被廣泛報道。相比較于其他生境,目前對CPR細菌的研究主要以水體環境為主,CPR細菌分布在淡水湖[30]、海水[15]、廢水處理廠[31]、地下水[1,6-7]等水生態系統中似乎更廣泛,且豐度較高。此外,CPR細菌在沉積物[32]、植物根系[33]、土壤[34]中也有分布的報道。有趣的是,在動物[35]與人體[11-13,36]中也檢測到了CPR細菌的存在,并被認為可能與人類健康有關。由此可見,CPR細菌在不同的生態系統中廣泛分布,其扮演著重要的生理與生態角色。
2 CPR特點介紹
2.1 CPR細胞形態、基因組學特征和系統進化地位
細胞體積小、基因組精簡是CPR細菌相比較于普通細菌的一個最顯著特征。2015年Brown分別使用1.2、0.2、0.1 μm系列濾膜串聯過濾地下水時,通過結合利用16S rRNA基因與宏基因組測序技術發現在0.2 μm與0.1 μm濾膜上存在大量CPR細菌;使用冷凍透射電鏡觀測到部分CPR細菌能穿過0.2 μm的濾膜,而在0.1 μm濾膜上被富集[1]。2015年He等[11]從人體口腔中分離培養出一株寄生于放線菌的CPR細菌TM7,在電鏡下觀察到TM7細胞大小在0.2~0.3 μm之間。2021年Batinovic等[19]從廢水中分離培養出一株能烈性裂解起泡細菌(Gordoniaamarae)的TM7,電鏡觀測到的細胞大小在0.3~0.4 μm之間。通過電鏡觀察,CPR細菌形態主要呈現桿狀或者球狀[7,19]。
目前獲得的CPR細菌的基因組大小約為1 Mbp,與普通細菌、古菌、專性昆蟲共生體相比,CPR細菌的基因組更接近于專性昆蟲共生體的基因組,顯著小于普通細菌和古菌[2]。CPR細菌基因組中存在約50%左右功能未知的基因,同時保守基因也少于我們熟知的普通細菌。Castelle等對1 000多個CPR細菌基因組進行分析比較時發現,大部分CPR細菌的基因組中都存在與同源重組、堿基切除修復和錯配修復等相關的基因。因此,Castelle等認為CPR細菌的精簡基因組是遺傳自祖先的特征,并非是基因組進化過程中發生了縮減[2]。Moreira等比對3個CPR細菌候選門Absconditabacteria(SR1)的基因組后,發現此類CPR細菌只有390個保守基因。同時,Moreira等將SR1門與其他CPR細菌候選門Gracilibacteria和 Peregrinibacteria(PER)對比發現,這3個CPR門可能最近丟失了共同祖先所具有的30%~50%的基因,進而推測這些CPR細菌的基因組內容有活躍的動態進化[10]。CPR精簡型基因組特征是源于祖先遺傳還是縮減進化存在一定的爭論,仍然有待于進一步研究。
Brown等對地下水樣品進行宏基因組測序并拼接后,將≥800 bp的16S rRNA基因進行聚類分析,發現31%的CPR細菌的16S rRNA基因中都含有≥10 bp的插入片段,插入位點聚集在16S rRNA基因的可變區和保守區的幾個不同的位置。大多數≥500 bp的插入序列編碼起催化作用的RNA內含子或者開放閱讀框(ORF)[1]。Castelle等[2]發現插入片段現象在一些CPR細菌的23S rRNA基因與tRNA基因中也存在。2016年Eloe-Fadrosh等通過宏基因組學技術,發現使用16S rRNA基因通用引物擴增子檢測微生物多樣性時會遺漏掉約70%的CPR細菌[3]。由于通用引物的低覆蓋率以及CPR細菌16S rRNA基因的特殊性(含插入序列),導致CPR細菌在宏基因組學技術出現前一直被人們所忽略。此外,CPR細菌基因組過度精簡,缺少重要的能量代謝基因,推測其普遍通過寄生或共生生長。因此,使用傳統的細菌分離培養方法很難獲得CPR細菌的純培養物。2018年Castelle等[2]搜集了1 000多個CPR細菌與DPANN古菌的基因組,用以調查CPR細菌的生物學特性,發現CPR細菌基因組中通常含有很多轉氨酶基因,用于轉化從環境中獲取的氨基酸,并用于自身合成蛋白質,同時將其作為潛在的碳源和能源。CPR細菌基因組中也具有核酸酶基因,能將獲得的核苷酸重新轉化為DNA 或RNA。CPR細菌基因組中還有許多編碼基因參與了IV型菌毛的產生,IV型菌毛可能在DNA吸收[37]、化合物分泌以及與周圍細胞的互作中發揮作用[7]。此外,CPR細菌基因組中包含了大量編碼糖基轉移酶的基因[38],用來生產重組參與細胞表面與胞外環境附著和調節的糖和糖蛋白。更重要的是,與普通細菌通過CRISPR-Cas 來適應性免疫系統防御病毒入侵不同,大多數CPR細菌都通過限制性修飾與頓挫感染(abortive infection)來防御病毒[39]。
2.2 生理代謝特征與潛能
精簡的基因組是CPR細菌擁有有限但極為罕見的代謝潛能的重要原因之一。目前的研究表明,大部分的CPR細菌缺乏完整的氨基酸、核苷酸以及脂質合成途徑[2],大多數CPR細菌不具備完整的呼吸鏈,缺失包括NADH脫氫酶和氧化磷酸化復合物Ⅱ-Ⅳ在內的相關基因,完全缺失與三羧酸(TCA)循環有關的基因[2]。然而,在對CPR細菌代謝潛能分析時也有發現在其基因組中存在罕見的代謝相關基因,此代謝通路的上下游基因卻不完整,很可能與CPR細菌基因組中存在諸多功能未知基因有關[2]。CPR細菌基因組中常常含有編碼大量糖苷水解酶(GHs)基因,能將復雜的含碳化合物降解形成小分子化合物進入糖酵解途徑[26]。大多數CPR細菌不具備完整的糖酵解(EMP)途徑,缺少催化EMP途徑關鍵酶基因(如磷酸果糖激酶PFK基因等)。CPR細菌基因組中通常含有磷酸戊糖途徑(Pentose Phosphate Pathway,PPP)的相關基因[2],因此,推測CPR細菌能通過PPP途徑將6-磷酸果糖轉化為3-磷酸甘油醛。通常,丙酮酸或者乙酰CoA是CPR細菌中心碳代謝的終產物,CPR細菌一般會先將丙酮酸轉化為乙酰CoA,然后進一步將其利用生產短鏈脂肪酸來平衡碳和電子流[2]。如許多CPR細菌Parcubacteria(OD1)、Dojkabacteria、Microgenomates(OP11)被預測可以利用古菌中常見的ADP-acetyl-CoA合成酶(ADP-Acs)來生成乙酸鹽[40]。一些Peregrinibacteria(PER)也可以通過細菌中常見的乙酸激酶(Ack)和磷酸轉乙酰酶(Pta)來產生乙酸。除了乙酸鹽外,許多CPR細菌還能通過發酵產生乳酸、甲酸或乙醇等產物。在含乙酸鹽的地下水中經常發現某些CPR細菌被富集,其中有些CPR細菌基因組編碼AMP-乙酰CoA合成酶,表明某些CPR細菌可能具有乙酸鹽利用能力[1]。
2018年Castelle等[2]搜集了約1 000個CPR細菌與DPANN古菌的基因組,發現雖然CPR細菌似乎都存在以發酵為基礎的生活方式,但不同門水平CPR細菌的生物合成能力有很大差異。某些來自Peregrinibacteria(PER)門的基因組具有相對較多的核心生物代謝能力,似乎都具有合成核苷酸、某些氨基酸和輔因子的能力,但不具備合成脂肪酸的能力。與Peregrinibacteria(PER)門相比,OD1超系成員普遍都缺乏完整的核心生物代謝能力[2]。有趣的是,“CandidatusParcunitrobacternitroensis”[41]不僅具有廣泛的代謝能力,擁有基本完整的電子傳遞鏈,擁有發酵和呼吸能力以及氮和脂肪酸的代謝能力,最重要的是還含有以氮化合物進行呼吸所涉及的所有酶(亞硝酸鹽還原酶、羥胺氧化還原酶和一氧化氮還原酶)的編碼序列。這些序列與其他生物體中發現的序列差異顯著,表明“CandidatusParcunitrobacternitroensis”以氮化合物進行呼吸的基因不是通過基因水平轉移的方式從非CPR細菌中獲得的。與代謝能力相對復雜的CPR細菌相比,Katanobacteria、KAZAN和Dojkabacteria這3個門的CPR細菌生物合成與代謝能力最弱,它們缺乏合成核苷酸、氨基酸、脂質、肽聚糖以及各種輔因子的編碼基因[2]。因此,我們在關注CPR細菌代謝潛能與生態學功能時,不能因為其共有的一些生物學特征就將整個CPR細菌一概而論,而是應該針對不同門的CPR細菌分門別類地進行研究。
2.3 生物地球化學元素循環
盡管CPR細菌精簡的基因組限制了其代謝能力,但CPR細菌在地球生物化學循環中仍然可能發揮著重要而關鍵的作用。CPR細菌參與碳素循環,具有潛在的固定二氧化碳與降解復雜含碳化合物的能力。2013年Campbell等[42]結合流式細胞儀分選與單細胞基因組擴增技術,從人類口腔樣品中分離并獲得一支CPR-SR1的基因組,發現其基因組中含有編碼1,5-二磷酸核酮糖羧化酶(RubisCO)的基因,具有固定二氧化碳的潛能,與先前研究中發現的Peregrinibacteria(PER)門一樣,存在古菌型RubisCO[6]。多項研究表明CPR細菌的RubisCO與古菌十分類似,屬于古菌II/III類型和bacterial-like III類型[6,38,42-43]。2016年Wrighton等[43]將Peregrinibacteria(PER)門中的RubisCO基因進行了體外表達,驗證了其具有古菌II/III類型的固定二氧化碳的活性。2017年Danczak等[25]將地下水樣品宏基因組測序獲得的71個CPR細菌基因組與2 000個其他CPR細菌基因組一并分析,確定并統計了135個不同糖苷水解酶(glycoside hydrolase,GH)家族的存在和數量,發現在所有CPR細菌門中,雖然降解底物(如直鏈淀粉、纖維素)的能力相似,但行使這些能力的糖苷水解酶GH基因不同。盡管幾乎所有的CPR細菌基因組都能編碼半纖維素側鏈降解酶,但具體的糖苷水解酶GH基因在不同的門之間存在差異。2019年Vigneron等[44]使用過濾與宏基因組測序相結合的方法對熱巖湖泊中的CPR細菌進行分析,發現每個CPR細菌基因組中平均能鑒定出(29±12)個碳水化合物活性酶(CAZy)基因,表明CPR細菌具有降解復雜含碳化合物的潛力。
不僅如此,在許多CPR細菌基因組中還發現參與反硝化的基因,可見CPR細菌可能還參與了氮素循環。氮素循環是生物圈內基本的物質循環之一,而反硝化作用是氮素循環中重要一環,它與厭氧氨氧化一起將被固定的氮元素以N2形式返還至大氣中。Danczak等[25]對地下水樣品進行宏基因組測序獲得71個CPR細菌基因組,有4個獨立metagenome-assembled genomes(MAGs),在其中發現了亞硝酸鹽還原酶基因(nirK,反硝化過程中的關鍵酶基因)分布于2個不同的CPR細菌門(Kaiserbacteria和Harrisonbacteria),這種含銅的亞硝酸鹽還原酶能夠將亞硝酸鹽還原為一氧化氮。同時,將獲得的CPR細菌的nirK基因序列與其他nirK基因序列比對并構建系統發育樹,發現CPR細菌的nirK基因在進化樹上能形成單獨的進化支。另有研究發現,CPR細菌中的一個特殊的個體具有一個基本完整的電子傳遞鏈,其基因組編碼了氮呼吸過程中涉及的所有酶基因(硝酸鹽還原酶、羥胺氧化還原酶和一氧化氮還原酶),同樣它們的序列與其他生物體內同工酶的序列差異顯著[41]。2017年León-Zayas等[45]研究發現CPR細菌中的Parcubacteria也具有硝酸鹽還原的能力。綜上,多項研究表明CPR細菌中的某些類群可能參與地球生物化學循環中的氮素循環。
硫是生命必需元素,CPR細菌可能也參與硫的氧化還原。2012年Wrighton等[6]通過宏基因組學的方法獲得了49個MAGs,發現在CPR細菌OD1與OP11的基因組中含有3種鐵氫酶(Fe-hydrogenase)和23種鎳鐵氫酶(NiFe-hydrogenase)編碼基因。進一步通過系統發育分析發現其中17種鎳鐵氫化酶與古菌熱球菌目(Thermococcales)的3b型胞質氫化酶序列高度相似,推測其可能參與多硫化物的還原。2021年He等[8]在比較研究一個農業污染嚴重的地下水和七個干凈的地下水中微生物群落時,共獲得746個CPR細菌與DPANN古菌基因組,發現CPR細菌占地下水微生物群落豐度的3%~40%,并且通過檢測評估了其參與地球生物化學代謝過程中的關鍵酶基因,發現在3個CPR細菌基因組中含有硫雙加氧酶基因(sdo),以及許多CPR細菌基因組中含有許多硫酸鹽還原相關的基因(sat、cysC和cysN),推測CPR細菌在硫循環過程中可能發揮作用。
2.4 CPR的分離培養和生理代謝特征
隨著高通量測序技術在微生物學研究領域的廣泛應用,越來越多的CPR細菌在各種生態環境中被檢測到,但人們目前對于CPR細菌的認識仍大多來自于宏基因組測序拼接得到的MAGs,缺少對純培養物的研究。在CPR細菌70多個門級分類中,目前僅有TM7分離得到可穩定傳代的二元培養物。此外,目前還缺乏可靠的標準化的獲得CPR細菌與其宿主純的二元培養物的方法。
2015年He等[11]通過針對CPR細菌具有鏈霉素抗性特性,不斷提高鏈霉素濃度獲得了一個穩定的TM7與其宿主共培養的富集液,首次在實驗室條件下培養出CPR細菌與宿主共存的二元培養物。He等最初也嘗試采用傳統的平板涂布方法分離CPR細菌TM7x,但一直未能成功,轉而經由多個共現性分析發現口腔中的TM7x與放線菌宿主XH001具有一定的相關性,進而不斷嘗試更換分離培養方法,發現盡管XH001能在平板上形成單菌落,但卻無法獲得TM7x的單菌落。此外,無論是添加共培養的廢液,還是加熱殺死XH001都無法讓TM7x單獨生長,可見CPR細菌TM7x嚴重依賴宿主XH001菌株。進一步研究發現,在營養豐富條件下TM7x與XH001能共存;但當處于饑餓條件下時,單獨培養的XH001能保留活性,而與TM7x一同培養時XH001大部分失活,而TM7x卻保留活力。通過透射電鏡(TEM)觀測,發現XH001表面附著有TM7x(圖3a),并且XH001細胞膜出現破損,因此推斷TM7x主要寄生于XH001表面,而非共生關系。
2020年Murugkar等[13]總結出前人研究的四點經驗:①TM7是一種專性寄生微生物,需要與宿主共存才能生長;②TM7細胞體積小,能夠通過0.22 μm濾膜而與其他細菌分開;③TM7與宿主的共培養物在肉湯培養基中能夠穩定傳代,但在平板上無法形成TM7的單菌落;④推測TM7的宿主來自于放線菌門、厚壁菌門或梭桿菌門。Murugkar等[13]通過過濾收集TM7后,從推測的宿主潛在門中選取潛在宿主,將二者在肉湯培養基中進行共培養,最終成功分離出4株TM7(包含TM7x)。
Gordoniaamarae是最常見的起泡細菌之一,尚未分離出裂解G.amarae的噬菌體,其基因組內存在多種抗病毒機制來抵抗噬菌體感染。2021年Batinovic等[19]在篩選廢水處理廠中一株起泡細菌(G.amarae)的噬菌體時,將原位廢水通過0.45 μm濾膜過濾后,直接把濾液滴在含起泡細菌單菌落的平板上,意外篩選到一株能烈性裂解起泡細菌的CPR細菌TM7-JR1。TM7-JR1卻能夠將G.amarae裂解,為將來通過生物方法防治廢水處理中的起泡細菌(產生泡沫)提供了一種新的策略。
2021年Moreira等[10]將西歐一個永久咸水湖底采集的微生物墊置于過濾后的原位水體中進行培養,幾個星期后觀測到大量的光合細菌,同時在光合細菌的表面發現有一個或多個深色的無鞭毛小細胞附著(圖3b、c)。研究人員通過顯微操作(用毛細管捕捉)搜集附著了小細胞的光合細菌,進行全基因組擴增測序(whole genome amplification,WGA),獲得兩個基因組,分別屬于伽馬變形菌門光合細菌與CPR細菌候選門Absconditabacteria(SR1),其中SR1的基因組比較完整,而光合細菌的基因組完整度只有15%左右,推測可能是SR1吸收消耗了光合細菌的DNA。雖然文中并未獲得CPR細菌與光合細菌宿主的二元純培養物,但基本確定了CPR細菌與宿主之間一對一的寄生或者捕食關系。
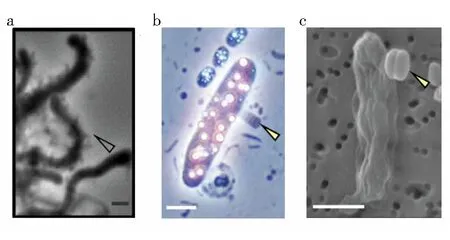
圖3 CPR細菌與宿主細胞共存的顯微照片(圖片已獲再版許可)
綜合考慮CPR細菌精簡的細菌基因缺少關鍵核心生物合成與代謝關鍵基因的特征,以及目前CPR細菌分離培養的經驗,可以初步判斷絕大多數CPR細菌無法單獨生長,需要以其他生物作為宿主營寄生或者共生生長。
3 展 望
近年來急速興起的組學技術為自然環境以及人工環境中未培養微生物的生態學分布、潛在生理代謝特征、遺傳進化等研究提供了強有力的工具,使得CPR細菌等未培養微生物進入我們的研究視野,成為微生物學界關注的焦點。考慮到CPR細菌獨特的生命進化地位、生理代謝特征、重要生態學功能、高度的物種多樣性和廣泛分布的特點,及其與人類健康存在潛在的重要關系,認為未來要在以下幾個方向加強對CPR細菌的研究。①CPR細菌物種多樣性與生態學分布規律:基于宏基因組和宏轉錄組等多組學技術手段,在群落和單細胞水平研究CPR細菌在各種自然和人工生態系統以及人體腸道等生境中物種多樣性和生態學分布特征,尤其關注CPR細菌與不同潛在宿主間的共現性關系和對生境微生物整體群落的塑造效應。②CPR細菌純培養和生理代謝特征:在獲得CPR細菌基因組學信息的基礎上,有目的地優化CPR細菌與宿主共培養條件,并開發相應的高通量培養等技術,實現CPR細菌與宿主的二元純培養,從而深入探索CPR細菌這一類獨特生命體的生理代謝特征。③CPR細菌在地球生物化學循環中的貢獻:目前研究發現CPR細菌參與了地球碳、氮、硫、磷等多種元素的生物地球化學循環,未來需要加強多學科交叉,結合生物學、化學、生態學以及地質學等,系統探究CPR細菌在生物地球化學循環中的作用及機制,定量化CPR細菌對地球化學元素循環的貢獻。④CPR細菌與人類健康的關系:目前發現CPR細菌對人體健康存在重要影響,然而其作用機理仍然很不清楚。未來需要針對人體口腔和腸道等重要生境CPR細菌的生境溯源、物種多樣性和生理代謝機制進行系統研究,解析CPR細菌對人體健康的影響及其作用機制。⑤CPR細菌在生命進化研究中的意義:CPR細菌處于生命進化樹的最根部,可能是現存的最古老和最簡單的細胞生命體之一,研究其諸多生命形式和進化特征,將對生命起源和細胞結構復雜性演化等重大科學問題產生重要影響。