外用紅色諾卡氏菌細胞壁骨架效力測試實驗方法的研究
竇 恒, 樊 華, 王秀英, 佟東輝,曲 晶,王 丹,孫 鶴,張怡軒
(1.沈陽藥科大學 生命科學與生物制藥學院,遼寧 沈陽 110016;2.遼寧格瑞仕特生物制藥有限公司,遼寧 本溪 117004;3.遼寧省檢驗檢測認證中心 遼寧省藥品檢驗檢測院,遼寧 沈陽 110030)
外用紅色諾卡氏菌(Nocardiarubra)細胞壁骨架是一種非特異性免疫調節劑,具有增強體內巨噬細胞和自然殺傷細胞的免疫活性[1],有效促進免疫細胞吞噬和殺滅病原體,提高人體抗感染的能力[2],可以迅速消除局部炎癥,加快糜爛面的愈合[3]。巨噬細胞是機體免疫系統中具有抗原遞呈功能的細胞之一,具有直接吞噬和殺傷病原體和腫瘤細胞的功能[4],還具有參與抗原加工、遞呈免疫調節的重要作用,檢測巨噬細胞吞噬功能對于判斷巨噬細胞的功能,了解機體的特異性和非特性免疫狀態具有重要作用[5]。原有外用紅色諾卡氏菌細胞壁骨架檢測巨噬細胞吞噬情況的方法為先將B/C小鼠兩次免疫后,腹腔注入雞紅細胞與巨噬細胞共同作用數小時,抽取腹腔液共同孵育染色,顯微鏡下觀察,計算巨噬細胞的吞噬率和吞噬指數,以此判斷巨噬細胞的吞噬功能。該檢驗方法統計學上差異明顯,可作為日常檢驗的依據。但由于需要操作者顯微鏡下計數,人工涂片及觀察,人工選擇觀察視野,因此受主觀因素影響較大;另外觀察的細胞數量有限,方法的靈敏度和準確度都有所降低。近年來,文獻報道有學者應用流式細胞術檢測巨噬細胞吞噬功能,如熒光微球法、FITC標記大腸埃希菌法等[6]。流式細胞儀技術用于巨噬細胞的吞噬率檢測可以輕易地將觀察細胞數從幾百提高至幾千[7],而且具有分析速度快、重復性好和特異性強等優點[8]。熒光微球被細胞吞噬后,其熒光信號可迅速被流式細胞儀檢測,具有熒光信號的巨噬細胞即視為出現吞噬現象,可快速、準確地測定巨噬細胞的吞噬率[9]。本研究探索了外用紅色諾卡氏菌細胞壁骨架兩種新的效力測定方法,即流式細胞術-熒光微球法和流式細胞術-免疫雙標法(熒光微球+熒光抗體),并與國家食品藥品監督管理局批準的方法進行比較,為該藥品測定方法的改進提供參考。
1 材料與方法
1.1 材料
1.1.1 藥品來源 外用紅色諾卡氏菌細胞壁骨架(Nr-CWS),批號201605001、201701001、201806001;成分為阿拉伯半乳聚糖、胞壁酸和粘肽等,輔料為右旋糖酐40;性狀為白色疏松狀體或粉末;生產公司為遼寧格瑞仕特生物制藥有限公司。
1.1.2 實驗小鼠 SPF級BALB/C鼠,雌性,21~24 g,北京維通利華實驗動物技術有限公司提供。
1.1.3 實驗材料 羧酸基修飾熒光微球(黃綠色,直徑2.0 μm,美國Invitrogen公司);BSA(牛血清白蛋白,規格1 g,北京奧博星生物技術有限責任公司);F480熒光抗體(成熟小鼠巨噬細胞標志物,規格0.1 mg,美國BD Pharmingen公司);同型抗體(成熟小鼠巨噬細胞標志物,規格0.1 mg,美國BD Pharmingen公司);Giemsa(吉姆薩色素,規格 1 g,國藥集團化學試劑有限公司);一次性無菌注射器(1、2、5、10 mL)、洗瓶、染缸、搪瓷盒(金屬盒/載玻片濕盒)、紗布、載玻片、移液槍(200 μL)、槍頭(200 μL)、眼科手術剪、眼科手術鑷子、100 mL錐形瓶,一次性靜脈輸液針、棉球、10 mL玻璃離心管、勾菌環。75%乙醇、甲醇、無水乙醇、姬姆氏色素(希格瑪)、甘油、香柏油。5%雞紅細胞(遼寧格瑞仕特生物制藥有限公司提供)。
1.1.4 主要儀器與設備 流式細胞儀(C6 plus,美國BD公司);生化培養箱(IPP260,美國Memmert公司);超聲器(HU-10260B,天津恒奧科技發展有限公司);恒溫水浴(SW22,德國Julabo實驗設備公司);恒溫水浴鍋(DK-98-II,天津泰斯特);低速臺式離心機(TDL-80-2B,上海安亭);雙目顯微鏡(DM3000,德國萊卡)。
1.2 方法
1.2.1 顯微鏡觀察法 ①樣品制備:將紅色諾卡氏菌細胞壁骨架溶于生理鹽水中,分別制成濃度為100和50 μg/mL的紅色諾卡氏菌細胞壁骨架樣品溶液。②5%雞紅細胞的制備:用10 mL注射器吸取3 mL阿氏液,從雞翅靜脈采血,于阿氏液中4 ℃貯存。將貯存于阿氏液中的雞血混勻,并取出一定量含雞紅細胞的阿氏液1 500 r/min離心5 min,棄上清,再加0.9%氯化鈉注射液至原量,混勻雞紅細胞,1 500 r/min離心5 min,用0.9%氯化鈉注射液共洗3次,第3次同速離心10 min,棄上清,并用0.9%氯化鈉注射液配成5%雞紅細胞懸液,4 ℃貯存,使用前鏡檢,發生溶血棄去。③操作:將檢疫合格的BALB/C鼠,隨機分為供試品高劑量組(100 μg/mL)、供試品低劑量組(50 μg/mL)和正常對照組,供試品組分別于第1天和第6天腹腔注射紅色諾卡氏菌細胞壁骨架樣品溶液0.2 mL/(只·次);末次注射后第4天,腹腔注射新配制的5%雞紅細胞,2 h后,頸椎脫臼處死小鼠。沿正中線剪開腹壁皮膚,經腹膜注入0.9%氯化鈉溶液,輕揉后,吸取腹腔液1.0 mL,分別滴于兩張載玻片上并涂勻,放入濕盒,溫箱孵育30 min后,固定5 min,浸于Giemsa染液中染色10 min,然后水洗。④檢測:待載玻片干后,將其置于顯微鏡下觀察、鏡檢并計數。⑤判定標準:雞紅細胞呈橢圓、具細胞核,染色后胞漿呈粉紅色,核呈紫藍色;中性粒細胞核呈藍色,胞漿呈淺紫色,顆粒呈藍紫色;嗜酸性粒細胞的顆粒呈紅色;嗜堿性粒細胞核呈暗藍色,顆粒呈暗紫紅色。實驗以吞噬率和吞噬指數表示小鼠巨噬細胞的吞噬能力。顯微鏡法吞噬率和吞噬指數按公式(1)和(2)計算。應用統計學分析數據進行分析,其中吞噬率采用卡方檢驗,采用獨立樣本t檢驗進行吞噬指數兩兩比較,如供試品組的吞噬率或吞噬指數與正常對照組的吞噬率或吞噬指數比較,有顯著性差異,方可判定該供試品效力實驗陽性。


1.2.2 流式細胞術-熒光微球法 ①熒光微球的制備:應用1%的BSA溶液(稀釋200倍)制備含微球溶液。37 ℃避光孵育30 min,超聲5 min。臨用現配。②實驗步驟:檢疫合格的BALB/C鼠,雌性,21~24 g,隨機分為供試品組和正常對照組。各實驗組分別于第1天、第6天腹腔注射相應藥液0.2 mL/(只·次)免疫小鼠;末次免疫后第4天(加雞紅細胞實驗小鼠需在麻醉前2 h腹腔注射新配制的5%雞紅細胞各0.5 mL),取各組小鼠麻醉至小鼠不再掙扎,浸泡消毒3 min。腹腔注射生理鹽水3 mL/只,輕輕按揉腹部,將腹壁剪開一個小口,吸取腹腔洗液2 mL用75 μm過濾器過濾至試管內,調整巨噬細胞數為(4~6)×105/mL。移液槍吸取1 mL腹腔洗液于6孔培養板中,加入已經預調理過的熒光微球,37 ℃二氧化碳細胞培養箱避光孵育90~120 min,孵育結束后棄上清(含未貼壁細胞和多余熒光微球),每次使用1.0 mL生理鹽水輕輕洗滌2次,去上清后再加入4 ℃生理鹽水0.3 mL,用細胞刮刮下貼壁細胞,輕輕吹打均勻后經75 μm過濾器過濾后上機分析。③流式細胞術檢測分析[10]:a.設門:首先設立APC-SSC二維散點圖,通過調節APC和SSC電壓值,以巨噬細胞設門界定分析的巨噬細胞群,最大限度地排除其他有核細胞、細胞碎片等的干擾;b.獲取:在熒光微球發射光的熒光通路檢測巨噬細胞的熒光強度,每份樣本獲取5 000個巨噬細胞,數據可顯示于二維散點圖和直方圖中。在二維散點圖中可通過設門圈定未吞噬熒光微球的巨噬細胞群和吞噬熒光微球的巨噬細胞群;在直方圖中可通過標尺標定未吞噬熒光微球的巨噬細胞群和吞噬熒光微球的巨噬細胞群,全部數據經相關軟件分析未吞噬熒光微球的巨噬細胞和吞噬不同數量熒光微球的巨噬細胞的比例[11]。④考察雞紅細胞對流式細胞術-熒光微球雙標法的影響實驗[12]:同流式細胞術-熒光微球法的相關操作,同時做1組不加5%雞紅細胞的供試品組高劑量組、供試品組低劑量組和正常對照組。⑤判定標準:應用統計學分析數據進行分析,其中吞噬率采用卡方檢驗,采用獨立樣本t檢驗進行吞噬指數兩兩比較,如供試品組的吞噬率或吞噬指數與正常對照組的吞噬率或吞噬指數比較,有顯著性差異,方可判定該供試品效力實驗陽性。
1.2.3 流式細胞術-免疫雙標法(熒光微球+熒光抗體) ①制備樣品:將紅色諾卡氏菌細胞壁骨架溶于生理鹽水中,分別制成質量濃度為100和50 μg/mL的紅色諾卡氏菌細胞壁骨架樣品溶液。將檢疫合格的BALB/C鼠,隨機分為供試品高劑量組(100 μg/mL)、供試品低劑量組(50 μg/mL)和正常對照組。供試品組分別于第1天和第6天腹腔注射紅色諾卡氏菌細胞壁骨架樣品溶液0.2 mL/(只·次);末次注射后第4天,取供試品高劑量組、供試品低劑量組和正常對照組小鼠,依次放入裝有乙醚棉球的離心管,麻醉至小鼠不再掙扎。將小鼠放入裝有75%乙醇的燒杯中,浸泡消毒3 min后,將小鼠放入紫外滅菌后的超凈臺上,手術暴露腹腔膜,通過腹腔壁注入3 mL生理鹽水。反復按摩小鼠腹部后,分別吸取腹腔液2.0 mL,備用。②制備熒光微球:將羧酸基修飾熒光微球用BSA溶液稀釋,制備羧酸基修飾熒光微球BSA溶液,避光孵育30 min后,超聲5 min。③操作:將超聲后的羧酸基修飾熒光微球BSA溶液,均勻分配到6孔板上,同時準確加入獲得的腹腔液,沖勻微球,上下左右平行移動6孔板,使液體充分混合,然后置于生化培養箱中避光孵育2.5 h;將培養后的6孔板取出,棄上清,加入生理鹽水洗滌,用細胞刮刮取細胞,吸入EP管中,并加入F480抗體[13]混勻,經過濾器過濾,取濾液。④流式細胞術檢測分析[14]:分別根據F480熒光抗體和同型抗體細胞對R1門進行調整,確定R1門后其他操作同2.2.3流式細胞術檢測分析。⑤判定標準:應用統計學分析數據進行分析,其中吞噬率采用卡方檢驗、吞噬指數兩兩比較采用獨立樣本t檢驗,如供試品組的吞噬率或吞噬指數與正常對照組的吞噬率或吞噬指數比較,有顯著性差異,方可判定該供試品效力實驗陽性。
2 結果與分析
2.1 原方法-顯微鏡觀察方法
檢疫合格的BALB/C鼠,進行3次重復實驗,取三批外用紅色諾卡氏菌細胞壁骨架產品,批號為201605001、201701001、201806001,每次隨機分成供試品高劑量組、供試品低劑量和正常對照組3組。實驗結果見表1~3。

表1 201605001批次外用紅色諾卡氏菌細胞壁骨架顯微鏡法測定結果

表2 201701001批次外用紅色諾卡氏菌細胞壁骨架顯微鏡法測定結果

表3 201806001批次外用紅色諾卡氏菌細胞壁骨架顯微鏡法測定結果
由表1~3可知,采用成熟的顯微鏡法,三批次外用紅色諾卡氏菌細胞壁骨架,高、低劑量供試品組與正常對照組比較吞噬率明顯升高(P<0.01)、吞噬指數明顯增大[15](P<0.01),判定結果為陽性。
2.2 流式細胞術-熒光微球法[16]
檢疫合格的BALB/C鼠,進行3次重復實驗,取三批外用紅色諾卡氏菌細胞壁骨架產品,批號為201605001、201701001、201806001,每次隨機分成供試品高劑量、供試品低劑量和正常對照組3組。實驗結果見表4~6。
由表4~6可知,實驗數據統計學分析顯示,第1次實驗100和200 μg/mL供試品組與正常對照組比較呈吞噬率明顯升高(P<0.05),吞噬指數明顯增大(P<0.01)(表4);而第2次實驗100和200 μg/mL供試品組與正常對照組比較呈吞噬率明顯降低(P<0.05、P<0.01),吞噬指數明顯減小(P<0.01)(表5);第3次實驗100和200 μg/mL供試品組與正常對照組比較呈吞噬指數明顯升高(P<0.01、P<0.05)(表6),檢驗結果不穩定。
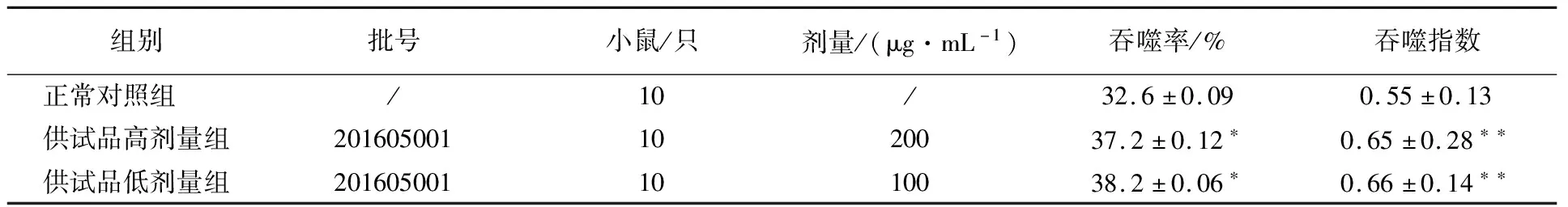
表4 流式細胞術-熒光微球法第1次實驗結果

表5 流式細胞術-熒光微球法第2次實驗結果

表6 流式細胞術-熒光微球法第3次實驗結果
2.3 雞紅細胞對流式細胞術-熒光微球法的影響
加入雞紅細胞的影響實驗,檢疫合格的BALB/C鼠,進行重復實驗,隨機分成供試品高劑量組、供試品低劑量組和正常對照組3組。實驗結果見表7。由表7可見,各組在加或未加雞紅細胞處理后,吞噬率和吞噬指數數值差異較大,如正常對照組未加雞紅細胞處理的吞噬率為32.60%±0.09%,約為加雞紅細胞處理(12.10%±0.04%)的2倍以上。實驗結果提示,5%雞紅細胞對巨噬細胞吞噬熒光微球有干擾,使得最終獲得的數據偏小。因此,流式細胞術熒光微球雙標法不添加雞紅細胞。

表7 雞紅細胞對流式細胞術-熒光微球法的影響
2.4 流式細胞術-免疫雙標法(熒光微球+熒光抗體)
檢疫合格的BALB/C鼠,進行3次重復實驗,取三批外用紅色諾卡氏菌細胞壁骨架產品,批號為201605001、201701001、201806001,每次隨機分成供試品高劑量組、供試品低劑量組和正常對照組3組。實驗結果分別見圖1與表8、圖2與表9、圖3與表10。
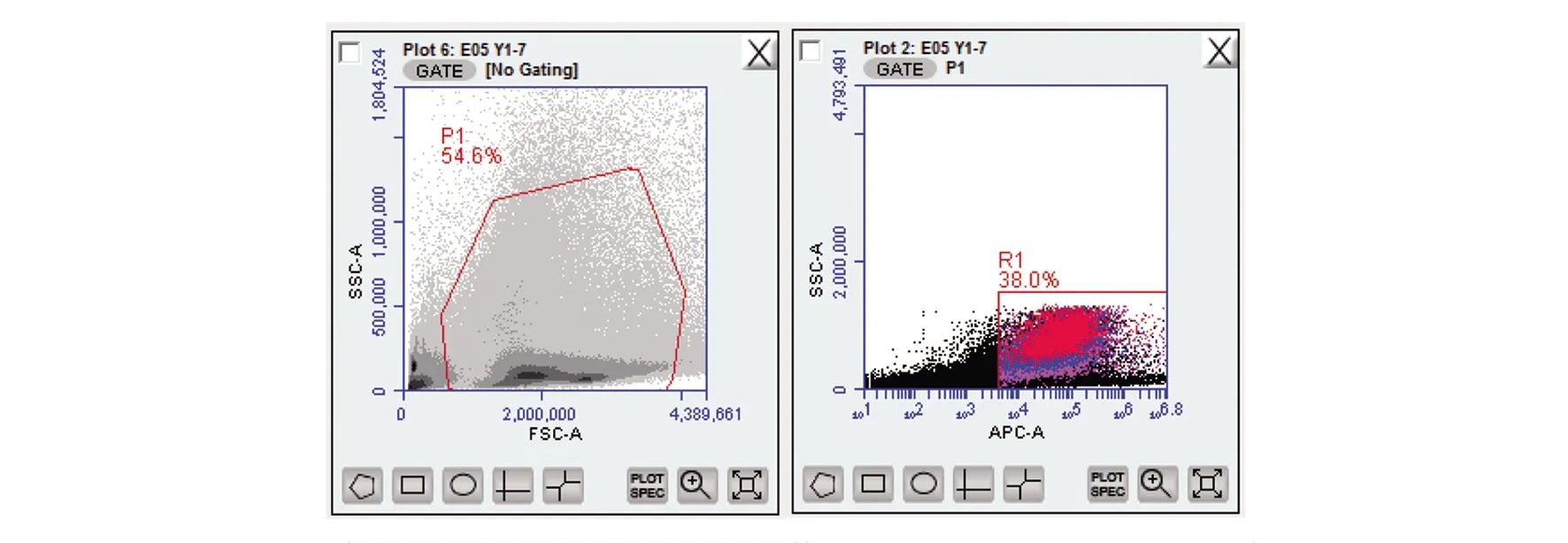
圖1 流式細胞術-免疫雙標法(熒光微球+熒光抗體)檢測數據(201605001)

表8 流式細胞術-免疫雙標法(熒光微球+熒光抗體)檢測數據(201605001)
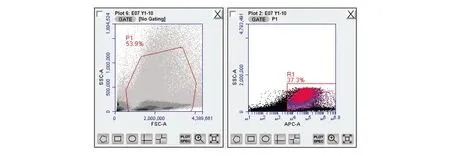
圖2 流式細胞術-免疫雙標法(熒光微球+熒光抗體)檢測數據(201701001)

表9 流式細胞術-免疫雙標法(熒光微球+熒光抗體)檢測數據(201701001)

表10 流式細胞術-免疫雙標法(熒光微球+熒光抗體)檢測數據(201806001)

圖3 流式細胞術-免疫雙標法(熒光微球+熒光抗體)檢測數據(201806001)
在流式細胞術-熒光微球法基礎上,加入F480熒光抗體,流式細胞術-免疫雙標法(熒光微球+熒光抗體)檢驗結果由表8~10可見,供試品組的吞噬率或吞噬指數與正常對照組的吞噬率或吞噬指數比較,三批外用紅色諾卡氏菌細胞壁骨架,高/低劑量供試品組與正常對照組比較吞噬率均明顯升高(P<0.01),吞噬指數明顯增大(P<0.01、P<0.05),有顯著性差異,判定該供試品效力實驗陽性。
3 討 論
流式細胞儀利用熒光抗體與單克隆抗體技術結合的標記技術,保證檢測的靈敏度和特異性,利用計算機系統對流動的單細胞懸液中單個細胞的多個參數信號進行數據處理分析,保證了檢測速度和統計分析精確度[18]。
以上述兩種流式細胞術的實驗方法來分析,流式細胞術-免疫雙標法(熒光微球+熒光抗體)比流式細胞術-熒光微球法檢測更為穩定,檢測結果重復性較好。熒光微球能夠對具有吞噬功能的巨噬細胞進行識別[19],但檢測結果的穩定性較差。加入的F480熒光抗體(成熟小鼠巨噬細胞標志物,EMR1),也稱小鼠含生長因子樣模體黏液樣激素樣受體,是一種細胞表面糖蛋白,是成熟小鼠巨噬細胞表面特異性標志物抗體,可用于標記小鼠巨噬細胞,增加了流式細胞儀收集巨噬細胞的準確性,兩者結合應用更能準確反映供試品對小鼠巨噬細胞吞噬功能的作用。流式細胞術-免疫雙標法(熒光微球+熒光抗體)獲取的巨噬細胞數量5 000個遠多于顯微鏡計數的200個巨噬細胞,數據獲得快,且客觀。
檢測巨噬細胞吞噬實驗結果以統計學分析數據來判斷,其中吞噬率采用卡方檢驗,吞噬指數兩兩比較采用獨立樣本t檢驗,如供試品組的吞噬率或吞噬指數與正常對照組的吞噬率或吞噬指數比較,有顯著性差異,方可判定該供試品效力實驗陽性。
顯微鏡法通過目視多個顯微視野,觀察計數200個巨噬細胞是否吞噬及吞噬的數量,以吞噬率及吞噬指數的標準值來判定是否有效。而流式細胞術-免疫雙標法(熒光微球+熒光抗體)一次性計數5 000個巨噬細胞,根據熒光抗體標記技術,統計巨噬細胞吞噬情況。檢測數據以統計學分析,判定藥品對比對照組的吞噬效力的結果是否有效。兩種方法計數方式不同,統計原理不同,判定結果的方式也不同,因此不需要用顯微鏡法和吞噬率及吞噬指數的標準值來要求流式細胞術-免疫雙標法(熒光微球+熒光抗體)。
鑒于巨噬細胞體外檢測的特殊性,利用流式細胞儀開展檢驗產品的巨噬細胞吞噬情況,是具有可行性的,但目前檢驗數據及檢驗方法還需進一步確認,需更多的上機磨合,保證檢測的準確性及科學性,本研究提出的方法可為該項檢驗提供參考。