產(chǎn)α-環(huán)糊精葡萄糖基轉(zhuǎn)移酶的菌株篩選、鑒定與酶學(xué)性質(zhì)的初步研究
陶大煒,寧喜斌,2,3,4*
1(上海海洋大學(xué) 食品學(xué)院,上海,201306)2(上海水產(chǎn)品加工及貯藏工程技術(shù)研究中心,上海,201306)3(農(nóng)業(yè)部水產(chǎn)品貯藏保鮮質(zhì)量安全風(fēng)險(xiǎn)評(píng)估試驗(yàn)室(上海),上海,201306)4(國(guó)家淡水水產(chǎn)品加工技術(shù)研發(fā)分中心(上海),上海,201306)
環(huán)糊精 (cyclodextrin,CD)通常由6個(gè)以上D-吡喃葡萄糖基通過(guò)α-1,4-糖苷鍵相連而成的,由于葡萄糖基個(gè)數(shù)的不同,又被分為α-CD、β-CD和γ-CD這3種,它們是應(yīng)用最廣泛的環(huán)糊精,也稱基礎(chǔ)環(huán)糊精,其中α-CD有6個(gè)葡萄糖基,β-CD有7個(gè),而γ-CD有8個(gè)[1]。環(huán)糊精分子結(jié)構(gòu)的外面部分具有親水的特點(diǎn),因?yàn)楹杏H水基團(tuán),分子結(jié)構(gòu)的內(nèi)部相對(duì)就是疏水的,正因?yàn)槠浞肿咏Y(jié)構(gòu)特殊,從而可以包絡(luò)不同化合物,以改變它們物理和化學(xué)等性質(zhì),因此環(huán)糊精可以被廣泛并且有效的利用,并運(yùn)用于如食品工業(yè)、化妝品、藥品、環(huán)保、化學(xué)分析與檢測(cè)等諸多領(lǐng)域里[2-5]。
環(huán)糊精葡萄糖基轉(zhuǎn)移酶(cyclodextrin glycosyltransferase,CGTase)可作用于淀粉等,使底物的葡萄糖基團(tuán)發(fā)生轉(zhuǎn)移,從而獲得環(huán)糊精。CGTase可以催化4種不同的反應(yīng):歧化反應(yīng)、環(huán)化反應(yīng)、偶合反應(yīng)和水解反應(yīng)(其中前3種為3種轉(zhuǎn)糖基反應(yīng))[6]。在工業(yè)應(yīng)用中,主要是利用CGTase的環(huán)化反應(yīng)作用,與淀粉等發(fā)生反應(yīng)后生產(chǎn)環(huán)糊精。
目前大致可歸納為篩選產(chǎn)酶野生菌株進(jìn)行發(fā)酵生產(chǎn)、結(jié)合基因庫(kù)對(duì)產(chǎn)酶菌株的基因進(jìn)行克隆表達(dá)、使用蛋白質(zhì)工程技術(shù)對(duì)已知的基因片段進(jìn)行改良這3種方法獲取CGTase,其中產(chǎn)酶野生菌株的篩選是直接有效的,同時(shí)也是其他方法的基礎(chǔ)[7]。在自然界中有很多菌株可生產(chǎn)CGTase,它們的分布很廣泛,既存在于火山、沙石、溫泉、油井等[8-11]環(huán)境,還存在于富含淀粉土壤的玉米、薯類、土豆、南瓜、甘蔗等[12]的種植地,同時(shí)這些野生菌株的種類眾多。
國(guó)內(nèi)外學(xué)者主要致力于篩選高產(chǎn)且性質(zhì)穩(wěn)定的野生菌株、提高酶的熱穩(wěn)定性及pH穩(wěn)定性、優(yōu)化菌株的產(chǎn)酶條件提高酶活性、物理化學(xué)誘變與在工程菌株中的異源表達(dá)提高酶活性等。MARTINS等[8]篩選出的包含黏瓊脂芽孢桿菌(Bacillusagaradhaerens)所產(chǎn)CGTase酶活性較低,僅有0.31 U/mL,需要通過(guò)產(chǎn)酶條件優(yōu)化等方式提高其酶活性。COELHOSL等[12]篩選出的芽孢桿菌(Bacillussp.)產(chǎn)β-CGTase的熱穩(wěn)定性較差,限制了其在工業(yè)上的應(yīng)用能力。張佳瑜等[13]將來(lái)自于浸麻類芽孢桿菌(Paenibacillusmacerans)的產(chǎn)α-CGTase酶的基因進(jìn)行克隆,并優(yōu)化產(chǎn)酶條件,酶活性從1.9 U/mL提高到4.5 U/mL,說(shuō)明基因的克隆表達(dá)和產(chǎn)酶條件優(yōu)化有助于提高酶活性。雷新輝[5]篩選出的產(chǎn)酸克雷伯氏菌(Klebsiellaoxytoca)產(chǎn)α-CGTase酶活性為0.64 U/mL,經(jīng)復(fù)合誘變處理后,活性提高到5.68 U/mL,說(shuō)明誘變育種對(duì)于菌株的產(chǎn)酶活性有很大影響。
為了使環(huán)糊精的工業(yè)化生產(chǎn)能夠?qū)崿F(xiàn),同時(shí)降低成本,找到產(chǎn)酶活性高、穩(wěn)定性良好的野生菌株是關(guān)鍵。本試驗(yàn)從上海浦東新區(qū)新場(chǎng)鎮(zhèn)某農(nóng)場(chǎng)馬鈴薯、紅薯、玉米種植田分離、篩選產(chǎn)α-CGTase的菌株,對(duì)其中1株酶活性較高的菌株進(jìn)行形態(tài)學(xué)特征、生理生化試驗(yàn)鑒定和16S rRNA序列比對(duì)分析,對(duì)其酶學(xué)性質(zhì)進(jìn)行了初步研究,以期為進(jìn)一步工業(yè)化開(kāi)發(fā)利用性狀穩(wěn)定且高產(chǎn)α-CGTase的菌株提供借鑒,旨在為工業(yè)生產(chǎn)α-CGTase及其應(yīng)用提供參考依據(jù)。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種來(lái)源
2019年8月于上海浦東新區(qū)新場(chǎng)鎮(zhèn)某農(nóng)場(chǎng)馬鈴薯、紅薯、玉米種植田(121.658 766 °E,31.052 923 °N)采集樣品,用無(wú)菌采樣器采集3~10 cm深的土壤樣品,樣品采集后放入無(wú)菌取樣袋,并在2 h內(nèi)送回試驗(yàn)室進(jìn)行處理分析。
1.1.2 試劑
PCR擴(kuò)增試劑盒、酵母浸粉、DNA提取試劑盒、可溶性淀粉、蛋白胨等, 上海生工生物工程股份有限公司;α-CD, Sigma(上海)公司;NaCl、K2HPO4·3H2O、MgSO4·7H2O,國(guó)藥集團(tuán)化學(xué)試劑有限公司;Na2CO3,上海柯靈斯試劑有限公司;酚酞、甲基橙,上海麥克林生化科技有限公司。
1.1.3 培養(yǎng)基
初篩培養(yǎng)基(g/L):可溶性淀粉10,蛋白胨5,酵母浸粉5,瓊脂15,NaCl 5,Na2CO31,K2HPO4·3H2O 1,MgSO4·7H2O 0.2,酚酞 0.3,甲基橙 1,自然pH,121 ℃,0.1 MPa滅菌20 min。
復(fù)篩培養(yǎng)基(g/L):可溶性淀粉10,蛋白胨5,酵母浸粉5,NaCl 1,Na2CO30.5,K2HPO4·3H2O 1,MgSO4·7H2O 0.2,pH 7.0,121 ℃,0.1 MPa滅菌20 min。
發(fā)酵培養(yǎng)基及種子培養(yǎng)基,同復(fù)篩培養(yǎng)基。
1.2 儀器與設(shè)備
UV-1800PC紫外可見(jiàn)分光光度計(jì),上海美譜達(dá)儀器有限公司;立式高壓蒸汽滅菌鍋,上海申安醫(yī)療器械廠;超凈工作臺(tái),蘇凈集團(tuán)安泰公司;THZ-300C恒溫培養(yǎng)搖床、GHP-9 270隔水式恒溫培養(yǎng)箱,上海一恒科學(xué)儀器有限公司;HWT-6B恒溫水浴箱,天津市恒奧科技發(fā)展有限公司;CX41RF顯微鏡,東京奧林匹斯公司;高速臺(tái)式離心機(jī),上海安亭科學(xué)儀器廠;PTC-200 PCR儀、GelDoc XR凝膠成像系統(tǒng),美國(guó)Bio-Rad公司。
1.3 試驗(yàn)方法
1.3.1 產(chǎn)α-CGTase菌株的初篩
分別取土豆、紅薯、玉米種植田土樣10 g加入到90 mL含玻璃珠的無(wú)菌水中,充分振蕩40 min。取1 mL 上述混合液加入99 mL營(yíng)養(yǎng)肉湯,37 ℃,170 r/min條件富集培養(yǎng)24 h。使用生理鹽水進(jìn)行梯度稀釋,并將稀釋液(100 μL)均勻涂布于初篩培養(yǎng)基,37 ℃培養(yǎng)48 h。以出現(xiàn)黃色透明圈作為篩選標(biāo)準(zhǔn),將篩選出的菌株分離純化,4 ℃條件下進(jìn)行保藏。
1.3.2 產(chǎn)α-CGTase菌株的復(fù)篩
粗酶液的制備:發(fā)酵培養(yǎng)基裝液量100 mL/250 mL,菌種接種量為4%的種子培養(yǎng)基,37 ℃、170 r/min搖床培養(yǎng)48 h,于10 000 r/min離心10 min后所得上清液即為粗酶液。
α-CGTase活力的測(cè)定:采用甲基橙褪色法測(cè)定酶的環(huán)化活力。在酸性(pH 1.1~1.4)條件下,α-CD與甲基橙發(fā)生反應(yīng),形成絡(luò)合物,使溶液的吸光度下降。在一定范圍內(nèi),吸光度的下降與α-CD的濃度存在著線性關(guān)系[4,14]。用50 mmol/L Na2HPO4-NaH2PO4緩沖液(pH 6.0)配制40 g/L的可溶性淀粉溶液做底物,取0.9 mL于試管中,加入適當(dāng)稀釋的粗酶液0.1 mL,均勻混合。50 ℃水浴反應(yīng)10 min,加入1 mol/L鹽酸溶液1 mL中止反應(yīng)。再加入0.1 mmol/L 甲基橙溶液1 mL,于20 ℃靜置15 min, 507 nm測(cè)定吸光度[15]。對(duì)應(yīng)α-CD標(biāo)準(zhǔn)曲線計(jì)算濃度,1個(gè)酶活單位(U)定義為上述條件下1 min生成1 μmol α-CD所需的酶量。
1.4 菌種鑒定
1.4.1 形態(tài)學(xué)鑒定
觀察純化后菌株的菌落形態(tài)。挑取單菌落進(jìn)行革蘭氏染色鏡檢,觀察菌體形態(tài)。
1.4.2 生理生化鑒定
根據(jù)相關(guān)文獻(xiàn)[16-17],對(duì)菌株進(jìn)行生理生化鑒定試驗(yàn),主要包括水解淀粉試驗(yàn)、吲哚試驗(yàn)、硝酸鹽還原、接觸酶、分解酪氨酸、甘露醇、葡萄糖產(chǎn)酸產(chǎn)氣、阿拉伯糖、棉籽糖利用等。
1.4.3 16S rRNA基因序列分析和構(gòu)建系統(tǒng)發(fā)育樹(shù)
根據(jù)細(xì)菌總DNA提取試劑盒說(shuō)明提取菌株DNA。PCR擴(kuò)增采用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1 492R(5′-TACGGCTACCTTGTTACGACTT-3′)。PCR擴(kuò)增產(chǎn)物送至上海生工生物公司測(cè)序,登入NCBI(National Center for Biotechnology Information),BLAST比對(duì)測(cè)序結(jié)果,獲取同源性高的菌株的16S rRNA基因序列,使用MEGA-X軟件中的鄰接法(neighbor-joining,NJ)構(gòu)建系統(tǒng)發(fā)育樹(shù),并對(duì)其分析鑒定[18]。通過(guò)Bankit將菌株鑒定的16S rRNA基因的部分序列向GenBank申請(qǐng)登錄號(hào)(GenBank Accession)。
1.5 酶學(xué)性質(zhì)初步研究
1.5.1 酶的最適作用溫度
用Na2HPO4-NaH2PO4緩沖液(pH 6.0)稀釋粗酶液和甲基橙溶液,設(shè)定20、30、40、45、50、55、60、70、80 ℃,9個(gè)反應(yīng)溫度。按照上述不同反應(yīng)溫度的條件,對(duì)各反應(yīng)溫度條件下的樣品分別測(cè)定其α-CGTase活性,將酶活性最高者定義為100%,并計(jì)算相對(duì)酶活性。
1.5.2 酶的熱穩(wěn)定性
取適量無(wú)菌粗酶液分裝于離心管,分別在40、45、50、55、60 ℃,5個(gè)保溫溫度條件下分別保溫不同時(shí)間。按照上述不同保溫溫度和時(shí)間的條件,對(duì)各保溫條件下的樣品分別在不同保溫時(shí)間下分別測(cè)定其α-CGTase活性,將未進(jìn)行保溫處理的酶活性定義為100%,并計(jì)算相對(duì)酶活性。
1.5.3 酶的最適作用pH
分別配制濃度為50 mmol/L的檸檬酸鹽緩沖液(pH 3.0~5.0)、Na2HPO4-NaH2PO4緩沖液(pH 6.0~8.0)、甘氨酸-NaOH緩沖液(pH 8.0~10.0),Na2HPO4-NaOH緩沖液(pH 11.0~12.0)[15]。設(shè)定pH 3.0~12.0,10個(gè)反應(yīng)pH。按照上述不同反應(yīng)pH的條件,對(duì)各反應(yīng)pH條件下的樣品分別測(cè)定其α-CGTase活性,將酶活性最高者定義為100%,并計(jì)算相對(duì)酶活性。
1.5.4 酶的pH穩(wěn)定性
先將粗酶液與不同pH值(3.0~12.0)的緩沖液混合,放置處理1、2 h。按照上述不同反應(yīng)pH和處理時(shí)間的條件,對(duì)各pH處理?xiàng)l件下的樣品分別在1、2 h下分別測(cè)定其α-CGTase活性,將未經(jīng)過(guò)不同pH緩沖液處理的酶活性定義為100%,并計(jì)算相對(duì)酶活性。
1.5.5 金屬離子對(duì)酶活力的影響
配制濃度為1 mmol/L的不同金屬離子(K+、Zn2+、Mn2+、Cu2+、Mg2+、Ca2+、Fe2+、Co2+)溶液,分別取適量與粗酶液混勻。對(duì)添加不同金屬離子的樣品分別測(cè)定其α-CGTase活力,將未添加金屬離子的酶液作為對(duì)照組,定義其酶活力為100%,并計(jì)算各組相對(duì)酶活力。
2 結(jié)果與分析
2.1 菌種篩選
初篩培養(yǎng)基因加入酚酞而呈紅色,菌株所產(chǎn)α-CGTase可降解培養(yǎng)基中的可溶性淀粉形成環(huán)糊精,環(huán)糊精可包埋酚酞,使菌株周圍呈現(xiàn)黃色透明圈,透明圈越大,說(shuō)明菌株產(chǎn)α-CGTase越多[19]。據(jù)此從土壤中篩選出117株產(chǎn)α-CGTase的菌株,從中挑選出透明圈直徑與菌落直徑比值較大的菌株30株進(jìn)行發(fā)酵產(chǎn)酶培養(yǎng)復(fù)篩,通過(guò)甲基橙褪色法分別測(cè)定酶活性,獲得酶活性較高(表1)菌株TLLY7。本試驗(yàn)將菌株TLLY7作為出發(fā)菌株,進(jìn)行后續(xù)試驗(yàn),其酶性活為1.35 U/mL,這與其他學(xué)者篩選出的野生菌株的酶活性相似,例如陳龍然[4]篩選出的地衣芽孢桿菌(Bacilluslicheniformis)產(chǎn)α-CGTase的酶活性(0.95 U/mL)、陳龍軍等[20]篩選出的嗜熱芽胞桿菌(Gebacilliussp.)產(chǎn)α-CGTase的酶活性(0.66 U/mL)、葉學(xué)軍[21]篩選出的地芽孢桿菌(Geobacilluscaldoxylosilyticus)產(chǎn)α-CGTase的酶活性(1.29 U/mL),低于他們進(jìn)行復(fù)合誘變、產(chǎn)酶條件優(yōu)化和基因的克隆與表達(dá)等方法后的酶活性,分別為2.28、5.3和6.18 U/mL,這說(shuō)明篩選出活性高的野生菌株只是完成了第1步,只依靠野生菌株發(fā)酵有很大的局限性,需要結(jié)合其他方法提高酶活性,才有更大的工業(yè)應(yīng)用潛力。

表1 產(chǎn)α-CGTase部分菌株的篩選結(jié)果Table 1 Screening results of α-CGTase producing strains
2.2 菌種鑒定
2.2.1 菌種的形態(tài)觀察
菌株TLLY7為革蘭氏陽(yáng)性,菌體成桿狀,有芽孢產(chǎn)生。圖1-a為菌株TLLY7在初篩培養(yǎng)基上的菌落透明圈形態(tài)。圖1-b為菌株TLLY7平板菌落形態(tài),菌落呈黃白色,圓形隆起,不光滑,不透明,大小2~5 mm,有褶皺,邊緣整齊。圖1-c為菌株TLLY7經(jīng)革蘭氏染色后在油鏡下的觀察圖。

a-初篩培養(yǎng)基菌落透明圈形態(tài);b-平板菌落形態(tài);c-細(xì)胞顯微形態(tài)圖1 菌株 TLLY7 菌落形態(tài)和在油鏡下的細(xì)胞形態(tài)Fig.1 The colony morphology and cell morphology under oil immersion lens of strain TLLY7
2.2.2 生理生化鑒定
根據(jù)相關(guān)文獻(xiàn)[16-17],對(duì)菌株TLLY7進(jìn)行生理生化鑒定。表2為菌株TLLY7的生理生化鑒定結(jié)果。

表2 菌株TLLY7的生理生化特征Table 2 Biochemical characteristics of strain TLLY7
2.2.3 16S rRNA鑒定及系統(tǒng)發(fā)育樹(shù)構(gòu)建
圖2為菌株TLLY7的PCR產(chǎn)物電泳條帶圖。由圖2可知菌株TLLY7經(jīng)PCR擴(kuò)增后,條帶約1 500 bp,擴(kuò)增產(chǎn)物經(jīng)測(cè)序得到的16S rRNA序列為1 480 bp,登錄NCBI官網(wǎng)上傳序列并進(jìn)行BLAST比對(duì),結(jié)果顯示高于Ident值96%的菌株有100多株,說(shuō)明較多菌株與菌株TLLY7序列相似,將它們序列下載后通過(guò)MEGA-X的NJ法構(gòu)建系統(tǒng)發(fā)育樹(shù)(圖3)[18, 22]。由圖3可發(fā)現(xiàn)菌株TLLY7和P.maceransNBRC 15 307T(NR 112729.1)在同一分支上,其相似性高達(dá)98.91%,說(shuō)明兩者同為類芽孢桿菌屬,且Bootstrap檢驗(yàn)值為100,說(shuō)明發(fā)育樹(shù)所表示的2種菌株之間的進(jìn)化關(guān)系可信[23]。結(jié)合形態(tài)學(xué)、生理生化鑒定可確定菌株TLLY7為浸麻類芽孢桿菌(P.macerans)。將菌株TLLY7的核酸序列通過(guò)Bankit向GenBank申請(qǐng)的登錄號(hào)為MT 705866。

圖3 基于16S rRNA序列分析的菌株TLLY7的系統(tǒng)發(fā)育樹(shù)Fig.3 Phylogenetic tree of strain TLLY7 based on 16S rRNA sequence analysis
2.3 菌株TLLY7酶學(xué)性質(zhì)初步研究
2.3.1 α-CD標(biāo)準(zhǔn)曲線的繪制
根據(jù)標(biāo)準(zhǔn)方法繪制α-CD標(biāo)準(zhǔn)曲線。線性回歸方程為y=0.546 1x-0.000 8,R2=0.999 1,表明線性良好。
2.3.2 酶的最適作用溫度
圖4為溫度對(duì)TLLY7所產(chǎn)α-CGTase活性的影響。當(dāng)反應(yīng)溫度在20~50 ℃,酶活性不斷升高,從30 ℃開(kāi)始酶活性升高的很快。溫度高于50 ℃,酶活性開(kāi)始下降。尤其是溫度高于60 ℃后,酶活性下降的很快,在80 ℃時(shí)酶活性僅15%。溫度在40~60 ℃,酶活性保持在80%以上。所以酶的最適作用溫度為50 ℃,是中溫酶。該酶的最適反應(yīng)溫度低于張曉磊[19]從黃海海域中篩選出的包含黏瓊脂芽孢桿菌所產(chǎn)α-CGTase的最適反應(yīng)溫度(55 ℃),低于張昌志[24]從羅漢果中篩選出的解淀粉芽孢桿菌(Bacillusamyloliquefaciens)所產(chǎn)β-CGTase的最適反應(yīng)溫度(60 ℃),具有節(jié)約工業(yè)應(yīng)用的能源,提高發(fā)酵效率的潛力。
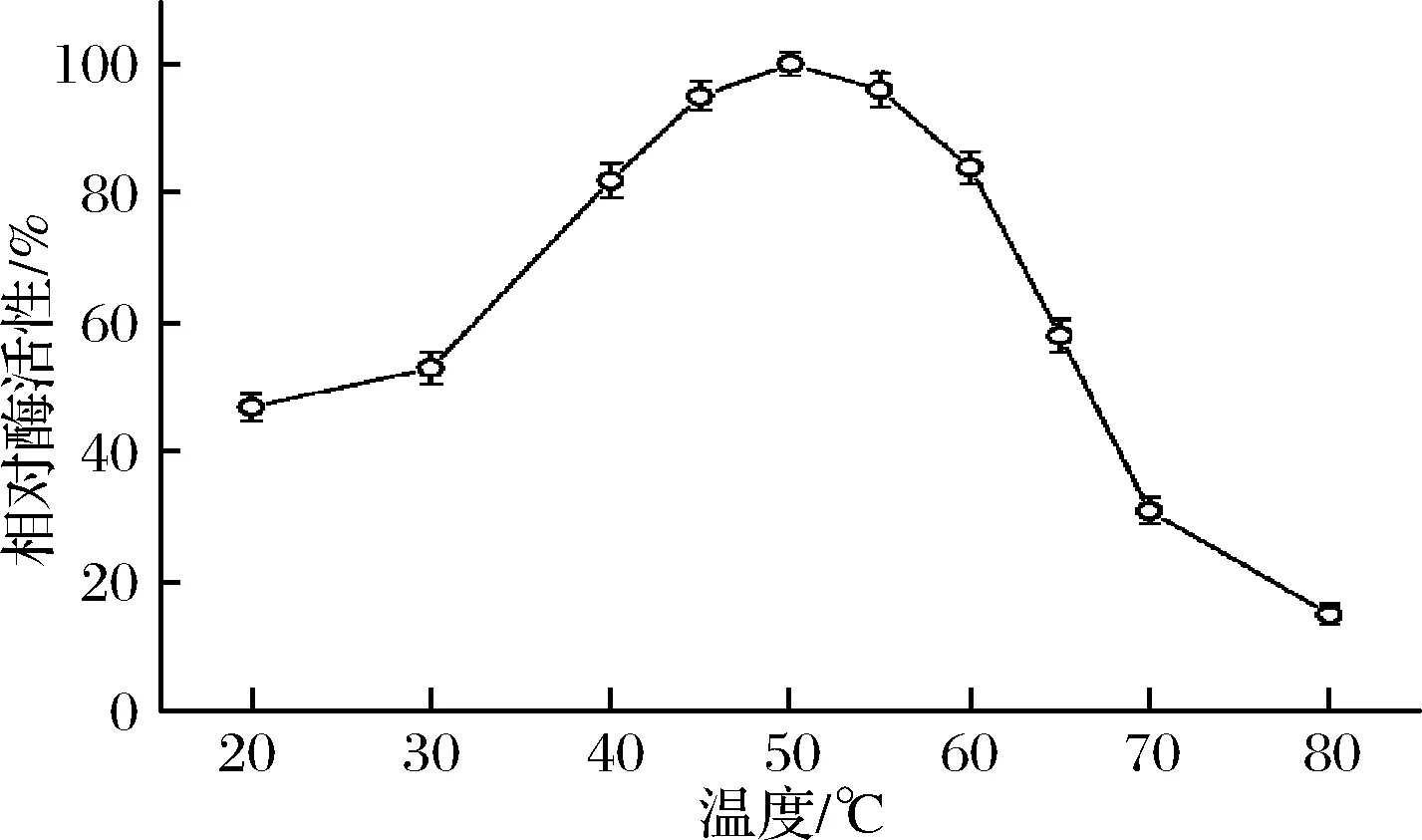
圖4 溫度對(duì)TLLY7所產(chǎn)α-CGTase活力的影響Fig.4 Effects of temperature on the α-CGTase produced by TLLY7
2.3.3 酶的熱穩(wěn)定性
圖5為溫度對(duì)TLLY7所產(chǎn)α-CGTase熱穩(wěn)定性的影響。在40 ℃下保溫2 h酶活性保留82%,保溫6 h保留30%的酶活性。在45 ℃保溫1 h酶活性保留90%,保溫5 h保留30 %酶活性。在50 ℃保溫1.5 h,酶活性保留50%。在55 ℃保溫0.75 h酶活性喪失50%。在60 ℃保溫1 h酶活性保留28%。陳龍然[4]從淀粉廠泥土中篩選出的地衣芽孢桿菌所產(chǎn)α-CGTase在60 ℃保溫1 h酶活性保留17%。本試驗(yàn)所產(chǎn)α-CGTase熱穩(wěn)定性相對(duì)較好,但熱穩(wěn)定性仍需要提高。因?yàn)槊傅臒岱€(wěn)定性不足會(huì)限制酶的工業(yè)化應(yīng)用,所以還需要進(jìn)行試驗(yàn)提高酶的熱穩(wěn)定性。

圖5 溫度對(duì)TLLY7所產(chǎn)α-CGTase穩(wěn)定性的影響Fig.5 Effects of temperature on the stability of α-CGTase produced by TLLY7
2.3.4 酶的最適作用pH
圖6為pH對(duì)TLLY7所產(chǎn)α-CGTase的影響。pH 3.0~4.0,酶活力很低。pH 4.0~6.0,酶活性升高的很快。pH>6.0,酶活性不斷下降。pH 12.0時(shí),酶活性僅5%。表明本試驗(yàn)所產(chǎn)α-CGTase的最適作用pH值為6.0,是弱酸性酶。

圖6 pH對(duì)TLLY7所產(chǎn)α-CGTase活力的影響Fig.6 Effects of pH on the α-CGTase produced by TLLY7
2.3.5 酶的pH穩(wěn)定性
圖7為pH對(duì)TLLY7所產(chǎn)α-CGTase穩(wěn)定性的影響。在pH 6.0~8.0,處理1 h酶活性保留95%以上,處理2 h酶活性保留90%以上。pH值<6.0或>8.0,酶活性明顯下降。pH 3.0和12.0處理1 h分別保留9%和11%酶活性,處理2 h酶幾乎失活。該酶在pH 10.0處理1 h保留77%酶活性。曹冬梅[25]從長(zhǎng)白山溫泉泥土中篩選出的高溫芽孢桿菌所產(chǎn)β-CGTase在pH 10.0處理1 h保留60%酶活性。本試驗(yàn)的pH穩(wěn)定性相對(duì)較好,具有更寬pH范圍的應(yīng)用前景。

圖7 pH對(duì)TLLY7所產(chǎn)α-CGTase穩(wěn)定性的影響Fig.7 Effects of pH on the stability of α-CGTase produced by TLLY7
2.3.6 金屬離子對(duì)酶活的影響
由圖8可知,對(duì)酶有不同程度的促進(jìn)作用的是Zn2+、Mn2+和Ca2+,而對(duì)酶的促進(jìn)作用最強(qiáng)的是Ca2+,相對(duì)酶活性約為空白對(duì)照的1.25倍。對(duì)酶有不同程度的抑制作用的是Cu2+、Fe2+和Co2+,其中對(duì)酶的抑制作用最強(qiáng)的是Cu2+,酶活性被抑制33%左右,可能由于離子結(jié)合蛋白的作用區(qū)域而抑制酶活。K+、Mg2+對(duì)酶活力的影響不是很明顯。這與國(guó)內(nèi)外學(xué)者篩選的菌株所產(chǎn)α-CGTase的性質(zhì)相似,具有參考意義[26-27]。

圖8 金屬離子對(duì)α-CGTase活力的影響Fig.8 Effects of metal ions on the α-CGTase activity
3 結(jié)論與討論
本試驗(yàn)利用甲基橙-酚酞平板法和甲基橙褪色法從上海浦東新區(qū)新場(chǎng)鎮(zhèn)某農(nóng)場(chǎng)土豆、紅薯、玉米種植田分離出1株高產(chǎn)α-CGTase的菌株TLLY7,16S rRNA測(cè)序分析其基因序列,經(jīng)BLAST比對(duì)后構(gòu)建系統(tǒng)發(fā)育樹(shù),結(jié)合形態(tài)學(xué)特征、生理生化鑒定后確定該菌株為浸麻類芽孢桿菌,命名為P.maceransTLLY7。將菌株TLLY7的核酸序列通過(guò)Bankit向GenBank申請(qǐng)的登錄號(hào)為MT 705866。
菌株TLLY7產(chǎn)α-CGTase的酶活性為1.35 U/mL,酶學(xué)性質(zhì)的初步研究表明,50 ℃、pH 6.0為該酶的最適反應(yīng)條件,為弱酸性中溫酶。該酶在40~45 ℃保溫1 h保留90%以上的酶活性,在60 ℃保溫1 h保留27%酶活性,pH 6.0~9.0處理1 h保留95%以上的酶活性,處理2 h保留90%以上的酶活性,熱穩(wěn)定性和pH穩(wěn)定性較好。Zn2+、Mn2+和Ca2+對(duì)酶有促進(jìn)作用,Cu2+、Fe2+和Co2+對(duì)酶有抑制作用。其中Ca2+對(duì)酶的促進(jìn)作用最強(qiáng),Cu2+對(duì)酶的抑制作用最強(qiáng)。K+、Mg2+對(duì)酶活性的影響作用較小。
由于環(huán)糊精具有特殊的分子結(jié)構(gòu),可以包絡(luò)不同化合物,改變它們理化性質(zhì),目前被應(yīng)用到了多個(gè)領(lǐng)域,例如在食品領(lǐng)域中可以達(dá)到抗氧化、保護(hù)色素等效果,使使提高食品的貯藏時(shí)間、改善食品的保存;在醫(yī)藥領(lǐng)域中可以改變藥物的性質(zhì)使得藥物刺激減少、提高藥物的穩(wěn)定性和降低毒副作用等效果,使藥品更能被人們接受,還可被應(yīng)用于化妝品、環(huán)保、化學(xué)分析與檢測(cè)等諸多領(lǐng)域,因此對(duì)CGTase的產(chǎn)酶菌株進(jìn)行分離純化和酶學(xué)性質(zhì)的研究是很有意義的[5]。本試驗(yàn)篩選出的產(chǎn)α-CGTase野生菌株可為未來(lái)的工作奠定基礎(chǔ),也為酶的分離純化與工業(yè)化應(yīng)用提供了依據(jù)。

