有氧運動對2型糖尿病大鼠腎臟的保護作用
龔 云,李 敏
糖尿病腎病(diabetic nephropathy,DN)是糖尿病主要微血管并發癥之一,在糖尿病患者中發病率為20%~40%,病變主要累及腎臟小血管和腎小球,引起蛋白尿排泄和濾過異常(許曼音,2012)。目前研究認為,其發病機制可能與遺傳易感性、糖脂代謝紊亂及腎小球血流動力學改變等因素有關。這些因素長期存在可導致腎小球系膜基質及基底膜合成增加、降解減少,最終導致腎小球硬化(許曼音,2012)。孟瑞(2008)的研究發現,胰島素抵抗大鼠腎小球、腎小管、足細胞等多部位形態結構發生改變,且這些變化出現早于糖尿病臨床癥狀。劉曦等(2017)的研究顯示,姜黃素類似物L6H4可能通過下調TGF-β1的表達來抑制FN、Col-IV的大量分泌,減輕細胞外基質的沉積,從而起到保護2型糖尿病大鼠腎臟的作用。但鮮見有氧運動對糖尿病大鼠糖代謝、腎臟顯微結構及功能影響的相關研究。本研究通過8周有氧跑臺運動,觀察糖尿病大鼠糖代謝、腎臟顯微結構與功能的變化,并探討早期有氧運動干預對2型糖尿病大鼠腎臟的保護作用及其機制。
1 材料與方法
1.1 實驗對象
選取8周齡健康雄性Wistar大鼠[購自蘭州大學實驗動物中心,SPF 級,SCXK(甘)2010-0001、SYXK(甘)2010-0002]40只,體質量185~220 g,SPF級維持飼料喂養、自由飲食。動物室溫度22℃~23℃,相對濕度38%~42%,自然通風、光照,每周紫外線消毒1次飼養室和用具。
1.2 建模、分組及運動
所有大鼠適應性喂養1周后,隨機選取10只作為對照組(NC組,普通飼料喂養、自由飲水)。其余大鼠以高脂、高糖飼料(10%蔗糖、10%豬油、5%膽固醇)喂養4周,期間正常飲水,第30天(前1天禁食12~16 h,不禁水)按30 mg/kg體質量逐只腹腔注射STZ(鏈尿佐菌素,購自sigma公司,用1%枸櫞酸鈉緩沖液,pH 4.2),48 h后,連續3天同一時間取血測血糖,若血糖≥16.67 mmol/L且出現“三多一少”體征,即可判為建模成功,成功率約為70%(Matteucci et al.,2008)。NC組大鼠注射等量的枸櫞酸鈉緩沖液。將建模成功的大鼠隨機分為兩組:糖尿病組(DM,8只)和糖尿病運動組(DS,8只)。參考Bedford等(1979)的方法,DS組大鼠先行3天適應性跑臺(DSPT-202,中國杭州錢江科工貿公司制造)運動,強度從15 m/min(15 min,0°)開始,逐漸增加到 25 m/min(30 min,0°)(趙杰修 等,2007),連續運動8周,1次/天,逢周日休息1天。NC組、DM組大鼠不運動,籠內自由活動。期間觀察各組大鼠飲食、尿量及精神狀態等。
常用的糖尿病動物模型的建造方法有手術法和實驗法兩種,前者行外科手術切除胰腺后成模,后者多用四氧嘧啶或鏈脲佐菌素(STZ)腹腔注射成模。其中STZ對β細胞有毒性作用,可使β細胞變性、壞死,因其毒性較小、比較穩定而多被選用。2型糖尿病屬非胰島素依賴型糖尿病,即胰島素分泌相對不足,其發病機理存在兩方面因素:胰島素抵抗和β細胞分泌功能障礙。在2型糖尿病大鼠模型具體建造方法上,因成年、雄性成模率高多被選用,通常采用高脂、高糖飼料喂養1月余以誘發胰島素抵抗,并佐以小劑量單次STZ腹腔注射而成模,整個過程與人類2型糖尿病發病過程極為相似。國內外學者多采用血糖≥16.67 mmol/L為建模成功的判定標準(Matteucci et al.,2008),這有別于部分學者采用血糖≥11.1 mmol/L或≥13.8 mmol/L的判定標準。在STZ注射劑量選擇上,常以50 mg/kg為中等劑量判定標準,大于或小于該值均會對模型產生不同影響。模型建立的成功與否是決定實驗成敗的關鍵環節。本實驗選用Wistar成年雄性大鼠建模,以高脂、高糖飼料連續喂養4周,單次小劑量腹腔注射STZ(30 mg/kg),以血糖≥16.67 mmol/L為成模判定標準,所以本實驗建造的2型糖尿病大鼠模型在質量控制上是科學的、可靠的。
1.3 取材及指標測試
在實驗前、后分別逐只準確測量各組大鼠體質量(清晨空腹)。實驗結束時,將各組大鼠逐一腹腔注射0.4%戊巴比妥鈉麻醉,真空管心尖取血測血糖(FBG,美國會好血糖儀)、血清胰島素(Ins,放射免疫法,GC-911放射免疫γ計數器,科大創新有限公司中佳分公司)及糖化血清蛋白(GSP,比色法)含量;采用Microlab zoo(荷蘭威圖)半自動生化分析儀測血肌酐(Scr)、血尿素氮(BUN)及尿酸(UA)值,后置于冰盤上迅速取左側腎臟,濾紙拭干血漬后用鑷子去除腎包膜,并分離其皮質,縱切左腎一半置于10%福爾馬林浸泡過夜,組織切片備用。
1.4 制片、觀察及數據處理
隨機切取各組大鼠左腎5 mm3皮質2塊,脫水后行常規石蠟包埋并切片(組織切片機,德國徠卡儀器有限公司),隔2選1脫蠟、H.E.染色,中性樹膠封片,每組制片10張,用Motic數碼顯微鏡(BA400/450,麥克奧迪實業集團有限公司)觀察大鼠腎臟顯微結構,每張切片再隨機選取3個視野,分別在100及400倍下拍照。采用SPSS 13.0統計軟件處理數據,數據以平均值±標準差(M±SD)表示。組間差異采用單因素方差分析,組內差異比較采用t檢驗,P<0.05表示差異顯著,P<0.01表示差異極顯著,用GraphPad Prism 6.02作圖。
2 結果
2.1 各組大鼠體質量
多飲、多食、多尿及進行性體重下降是糖尿病患者的重要體征。建模前、后及實驗末各組大鼠體重變化見表1。
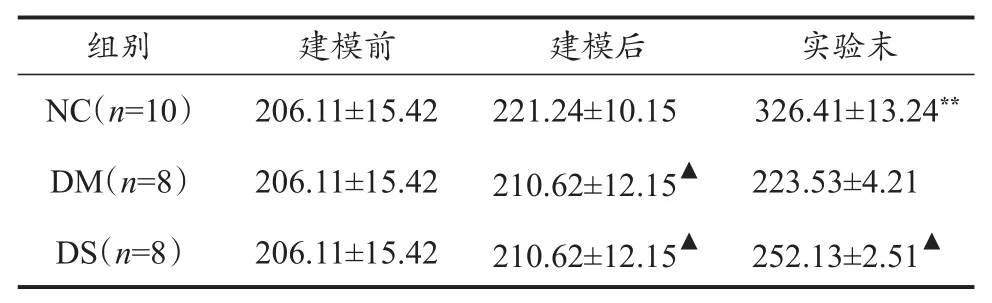
表1 建模前、后及實驗末大鼠體質量變化Table 1 The Changes of Body Weight Before,After and End of the Experiment M±SD,g
2.2 實驗前、后各組大鼠血糖
血糖穩態的維持對機體生理生化反應十分重要,適時檢測血糖可及時了解機體糖代謝狀況。注射STZ前后及實驗末各組大鼠血糖變化情況見表2。
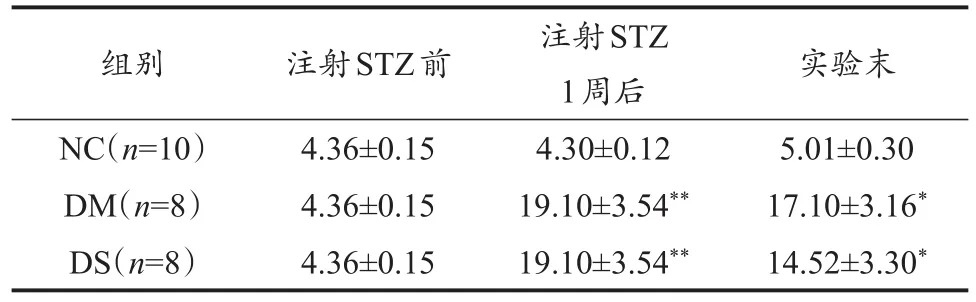
表2 注射STZ前、后及實驗末大鼠血糖變化Table 2 The Changes of Blood Glucose Before andAfter Injected STZ and at the End of ExperimentM±SD,mmol/L
2.3 各組大鼠血清Ins及GSP
實驗末,各組大鼠血清Ins及GSP測試結果見表3及圖1。

表3 各組大鼠血清胰島素和糖化血清蛋白的變化Table 3 The Changes of Serum Insulin and GSPby the End of Experiment in Each Group M±SD
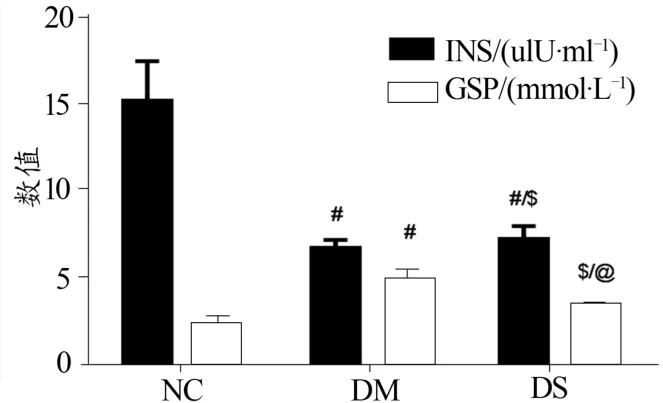
圖1 3組大鼠血清胰島素、糖化血清蛋白比較Figure 1. The Comparison of Serum Insulin and GSPin Three Groups at the End of Experiment
2.4 實驗末各組大鼠腎功的變化
臨床上,血清肌酐、血尿素氮及尿酸是反映腎臟功能狀況的重要指標。實驗末,3組大鼠Scr、BUN及UA測試結果見表4。

表4 各組大鼠血清肌酐、尿素氮和尿酸的測定結果Table 4 The Results of Scr,BUN and UAin Each GroupM±SD
2.5 各組大鼠腎臟顯微結構觀察
取各組腎臟組織常規固定后行石蠟切片、H.E.染色,選定視野后分別在100、400倍顯微鏡下拍照,用Motic數碼顯微鏡(BA400/450)在100倍照片上測量腎小球周長、面積,由此計算形狀因子(shape factor,SF)(表5)。
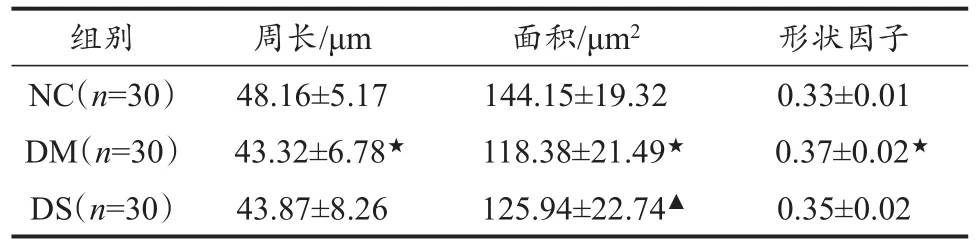
表5 各組大鼠腎小球周長、面積及形狀因子推算結果Table 5 The Results of Perimeter,Area and SF in Glomerulus in Each Group M±SD
NC組大鼠腎小球結構正常(圖2a),毛細血管腔開放(圖2b);DM組大鼠腎小球萎縮變小(圖2c),基底膜出現不均勻增厚,足突融合、消失、系膜細胞增生(圖2d),腎小囊腔變寬(圖2d);經8周有氧運動干預后,DS大鼠腎組織結構較DM組有明顯改善,腎小球結構基本正常(圖2e),毛細血管腔部分開放(圖2f)。
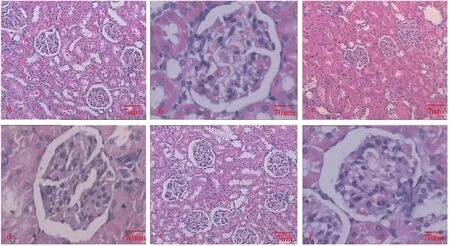
圖2 各組大鼠腎臟H.E.染色切片Figure 2. The Slices of Kidney H.E.Staining in Each Group
3 討論
隨著人們生活水平不斷提高,糖尿病發病率也逐年提高,特別是2型糖尿病占比持高不下,可直接累及心、腦、腎等臟器,并出現腎功異常乃至衰竭等并發癥,嚴重危害患者生命健康。其中,腎臟因其位置深、血流量大,功能變化比較隱匿不常被發現,一旦功能異常或遷延不愈或無法逆轉而走向替代療法。因此,關注2型糖尿病患者腎臟早期變化意義重大。
3.1 各組大鼠體質量、血糖、血清Ins及GSP的變化
2型糖尿病患者的典型體征為“三多一少”,即多食、多飲、多尿及體質量減輕。體質量變化在一定程度上是判定糖尿病病情發展轉歸的易測指標。由實驗結果(表1)可知,注射STZ 1周后,DM、DS組大鼠體質量較NC組明顯下降(P<0.05),從側面印證了該模型建立是成功的;8周跑臺運動結束時,NC組大鼠體質量極顯著(P<0.01)高于建模前及實驗末DM、DS組大鼠;此時DS組大鼠體重也顯著(P<0.05)高于DM組大鼠,表明中等強度有氧運動在一定程度上有延緩2型糖尿病大鼠體質量持續下降的作用。這與本組以前的實驗結果及同類實驗結果保持一致。
血糖是反映糖尿病病情及病程的重要指標。機體血糖穩態的維持對各項生理功能影響頗大。2型糖尿病由于機體胰島素的分泌不足或胰島素抵抗,使機體不能有效利用葡萄糖,造成血糖濃度超過腎糖閾而出現尿糖,持續高血糖易引發機體諸多不適及并發癥。因此,血糖濃度成為評判機體糖代謝正常與否的重要指標,但其受諸多因素影響而波動。葡萄糖是機體能量代謝的重要底物,在運動與血糖關系上,前期研究證明運動能增強胰島素的敏感性(Maiorana et al.,2002),并能上調骨骼肌GLUT4的基因和蛋白表達水平而提高其轉運效率(龔云等,2017),抑制糖異生,也可改善蛋白質和脂肪代謝而降低糖、脂毒性(王桂芳 等,2019),降低機體炎癥反應(Mathur et al.,2008),改善氧化應激水平及血管內皮損傷狀況,進而有效降低糖尿病患者的血糖水平(Lukács et al.,2015;Riddell et al.,2017)。有研究顯示,對T2DM患者進行中等強度運動干預后,血糖水平明顯下降(王耀光等,2004;徐國琴等,2002)。李俊等(2017)的研究提示,有氧運動可能通過改善胰島素敏感性,降低血糖,減輕機體糖應激。朱洪竹等(2016)的研究表明,6周有氧游泳訓練能顯著降低2型糖尿病大鼠的血糖。注射STZ 1周后,DM、DS組大鼠血糖比注射前及NC組大鼠血糖極顯著增高(P<0.01,表2),說明注射STZ并復合高糖、高脂飼料建造的2型糖尿病模型是成功的。經過8周的跑臺運動,DS組大鼠血糖盡管仍比NC組大鼠血糖極顯著增高(P<0.01),但與DM、運動前DS組大鼠相比,有顯著下降趨勢,說明中等強度有氧運動有阻抑糖尿病病情持續發展的作用。
胰島素是體內唯一的降血糖激素,由胰島β細胞分泌。血清蛋白及其他肽鏈N端為纈氨酸的蛋白質可與葡萄糖發生非酶糖基化反應,形成高分子酮胺化合物,結構類似于“果糖胺”(GSP),其半衰期較短,可有效地反映患者1~3周前的血糖均值,是追蹤病情、觀察糖尿病療效的重要指標。本實驗結果(表3、圖1)顯示,實驗末,與NC組比較,DM、DS組大鼠血清Ins水平均極顯著下降(P<0.01),但DS組Ins水平較DM組顯著上升(P<0.05),表明中等強度有氧運動可升高DM大鼠血清Ins水平;在GSP方面,與NC組相比,DM組極顯著升高(P<0.01),而DS組較DM組顯著下降(P<0.05),仍顯著高于NC組大鼠,提示有氧運動可以顯著改善DM大鼠血糖水平。叢琳等(2001)曾對DM大鼠進行12周中低強度跑臺運動訓練,發現實驗組大鼠血清Ins和C肽水平顯著增高,糖代謝紊亂得到改善,并可減輕胰島素抵抗。這與本實驗結果基本一致。其機制可能是機體糖尿病狀態下,因STZ對胰島β細胞的損害而導致胰島素分泌相對減少,血糖順應性升高,而8周有氧運動應激后血糖幾近耗竭,且這種下降的糖負荷或可反饋調節胰島β細胞、外加受損的部分β細胞得到修復而分泌較多的胰島素。具體機制可能涉及胰島β細胞分泌胰島素信號轉導及調控過程。
3.2 有氧運動對DM大鼠腎臟結構的影響
腎臟是糖尿病累及的主要臟器,DN是糖尿病最嚴重和最常見的慢性并發癥之一。糖尿病可通過多種途徑損害腎臟,并累及從腎小球到腎小管和腎間質的幾乎所有結構,但以腎小球病變最為突出。有研究證明,DN的病理變化主要表現為腎小球血管間質增生和膠原合成增加,造成結節型和彌漫型腎小球硬化(趙守香等,2004)。光學顯微鏡和電鏡觀察可見腎小球基底膜有線狀沉積物,并已證實為IgG、IgM、HbAlc和白蛋白,且常發生于晚期,沉積反映了基底膜異常及漏出增加。本研究顯示,NC組大鼠腎小球結構正常,毛細血管腔開放;DM組大鼠腎小球基底膜出現不均勻增厚,足突融合、消失、系膜細胞增生;經有氧運動干預后,DS組大鼠腎小球結構較DM組有明顯改善,腎小球結構基本正常,毛細血管腔部分開放。另外,糖尿病屬于內分泌性代謝紊亂綜合癥。機體糖代謝紊亂可導致腎臟微血管病變(蔣國彥,1992;孫洞簫等,1997),高血糖使膠原纖維之間的葡萄糖異常交叉聯結增多、穩定性增強,導致糖化膠原纖維分解緩慢,同時糖化膠原與白蛋白、IgG結合增加,引起基底膜蛋白沉淀而增厚;高血糖還可使腎小球上皮細胞糖蛋白合成增加,致使基底膜增厚;基底膜纖維聯結蛋白糖化,以其為媒介的膠原纖維之間的正常聯結減少,造成腎小球濾過膜的孔徑增大,導致微血管損傷,從而引發糖尿病腎病(關子安等,2000)。良好的血糖控制可使腎小球濾過率顯著改善,延緩糖尿病微血管病變的發生。
SF是反應細胞組織形態結構變化的重要參數,本實驗表示腎小球周長與面積的比值(崔亞南等,2002),可反應腎小球形狀的變化。實驗結果(表5)顯示,DM組大鼠腎小球周長及面積均較NC組大鼠顯著減小(P<0.05),而SF顯著增大(P<0.05);經8周有氧運動干預后,DS組大鼠腎小球面積較DM組大鼠顯著增加(P<0.05),但仍顯著低于NC組大鼠。據此推測,8周有氧運動對受損的腎小球形態結構有顯著改善作用。
3.3 有氧運動對DM大鼠腎功的影響
現已知,Scr是骨骼肌中磷酸肌酸代謝的終產物,而BUN是血漿中除正常蛋白質外的其他含氮代謝廢物,二者雖不能作為腎臟結構及功能受損的早期預警敏感指標,但其升降確也能提示腎臟結構及功能的微細變化,特別是腎小球濾過功能及血尿屏障的微細變化,所以值得高度關注。本實驗腎功檢查結果(表4)顯示,雖然各組Scr、BUN沒有突破正常高值,但DM組大鼠Scr、BUN極顯著高于NC組大鼠(P<0.01),經8周有氧運動干預后,DS組大鼠Scr、BUN雖仍顯著(P<0.05)高于NC組大鼠,但比DM組大鼠顯著下降(P<0.05)。UA是嘌呤代謝的終產物,在本實驗各組間均無統計學差異(P>0.05)。提示8周有氧運動可以顯著改善2型糖尿病大鼠腎臟功能,腎小球濾過能力顯著增強。何黛等(2009)的研究提示,6周有氧運動可通過提高糖尿病腎損傷大鼠機體抗氧化能力、減少AR(醛糖還原酶)基因表達,由此抑制多元醇通路激活;并通過下調TGF-β1mNA和Smad蛋白表達,進而抑制TGF-β1/Smad信號通路傳遞效率。可能通過這兩條途徑發揮其對糖尿病腎損傷大鼠腎功能的保護作用。
DN的發病機制復雜,目前尚不完全清楚。但最根本的原因是在遺傳易感的基礎上出現了糖代謝異常、血流動力學障礙、生長因子和細胞因子等的免疫損傷。糖代謝異常通過晚期糖基化終末產物生成、多元醇通路激活、蛋白激酶C(PKC)的激活3條途徑導致微血管病變,從而損傷腎臟。血流動力學改變的機械力和剪切力可能引起內皮細胞或上皮細胞的損害,從而破壞正常的濾過屏障,并且可直接激活PKC。據此推測,在DN早期,血流動力學異常可能發揮了重要作用,或為上述諸多因素相互作用、相互影響的綜合表征。
4 結論
中等強度有氧跑臺運動可以顯著降低2型糖尿病大鼠的血糖,阻抑體質量下降趨勢,升高血清胰島素水平;顯著改善實驗組大鼠腎小球結構及濾過功能,促使其結構及功能向良好方向轉變,或有延遲或阻抑DN發生、發展的作用。

