QbD理念在微球制劑開發中的應用
安廣峰 呂丕平

摘 要 質量源于設計(QbD)是以合理的科學和質量風險管理為依據的,起始于預定的質量目標,注重對產品和工藝的理解以及對生產工藝過程控制的系統研發方法。作為一種特殊注射劑型,微球制劑具有給藥方便,超長效緩釋作用明顯,毒副作用低,生物利用度高和患者依從性好等明顯的臨床優勢,日益成為各大藥企的新寵。但由于微球制備工藝復雜、中試放大困難等技術壁壘原因,僅有少數企業的產品落地。本文介紹了常用的微球制備方法,闡述了運用QbD理念進行微球研發的具體過程,為今后微球制劑的研發提供參考。
關鍵詞 微球 質量源于設計 關鍵質量屬性 關鍵工藝參數
中圖分類號:R944.11; F406.3 文獻標志碼:A 文章編號:1006-1533(2021)05-0077-05
Application of quality by design in development of microsphere
AN Guangfeng*,LYU Piping
(Shanghai Jiyu Pharmaceutical Technology Co., Ltd., Shanghai 201203, China)
ABSTRACT Quality by design (QbD) is based on reasonable science and quality risk management, starting from a predetermined quality goal, focusing on the understanding of products and processes and the systematic research and development methods of production process control. As a complex drug delivery system, the microsphere formulation is becoming a new favorite of major pharmaceutical companies due to some obvious clinical advantages, such as more convenient administration, super long-term sustained release, lower toxic and adverse reactions, higher bioavailability and better patient compliance. However, only a few businesses drive related product landing because of some technical barriers, including but not limited to complicated preparation process and more difficulties in pilot scale-up. In this article, we introduce traditional preparation methods, explain the specific process using the QbD concept to develop microspheres, and provide guidance for the development of microsphere drug products in the future.
KEY WORDS microsphere; quality by design (QbD); critical quality attributes (CQAs); critical process parameters (CPPs)
微球(microsphere)是指將藥物溶解或分散在天然或合成高分子材料中所形成的微小球狀聚合物[1],粒徑一般在1~250 mm[2],通過皮下或肌肉注射給藥,通過載體表面釋放、藥物擴散、聚合物的溶蝕、降解等方式,實現藥物的緩慢釋放。
質量源于設計(QbD)是一個系統的藥物開發方法,從預先確定的目標出發,基于科學和質量風險管理,把研究重點放在對產品和生產工藝的理解及控制策略上[3]。
本文以微球制劑為例,綜述運用QbD理念進行微球制劑研發的具體過程。
1 微球制劑處方
微球藥物主要由兩部分組成:主藥和生物可降解聚合物。生物可降解聚合物是指在水和酶作用下降解的高分子材料,已在長效注射劑領域得到廣泛成功的應用。目前最常用的是聚乳酸(ploy lactic acid,PLA)、聚乳酸-羥基乙酸(poly lactic-co-glycolic acid,PLGA)等。該材料具有無毒、可生物降解、生物相容性較好等優點[4]。
2 微球制備工藝
目前,制備微球的方法有多種,根據所包裹藥物的不同性質而采用不同的制備方法。已經可以工業化生產的方法包括熱熔擠出法、乳化-溶劑揮發法、相分離法、噴霧干燥法等。
2.1 熱熔擠出法
熱熔擠出(hot melt extrusion,HME)技術是利用擠出機將API均勻分散于聚合物載體中的連續工藝[5],該工藝可用于微球制劑工藝[6],Watson Labs公司2000年使用該法上市了雙羥萘酸曲普瑞林微球。盡管該技術工藝步驟少,可不使用溶劑,是一種可重復性的容易放大的連續制備工藝,但難以生產少量樣品,對于價格昂貴的原輔料來說,前期研發投入很大。更重要的是,各物料加入順序、時間、物料混合等容易導致批間一致性差,熱熔使得熱敏性藥物穩定性差[7]。
2.2 乳化-溶劑揮發法
乳化-溶劑揮發法包括單乳法和復乳法。當包封疏水性藥物時,采用水包油體系(O/W)進行單乳法制備,Johnson & Johnson公司在2003年使用單乳法上市了利培酮微球。當包封親水性藥物時,采用水包油包水體系(W1/O/W2)進行復乳法制備,而Takeda公司早在1989年使用復乳法上市了醋酸亮丙瑞林微球。該法可在較低的溫度下進行,對藥物活性保持較好,是近年來較為常用的微球制備方法。在乳液制備過程中,乳液粒徑的控制非常重要,包括粒徑的大小和均一性,膜乳化法[8]是業內較受歡迎的方法之一。
2.3 相分離法
相分離法又稱溶劑-非溶劑法或凝聚法。在藥物和高分子聚合物形成的有機溶液中,加入與聚合物不相容的溶劑或非溶劑,高分子聚合物由于溶解度降低發生相分離,將有機溶劑揮發出去,固化形成載藥微球[9]。Novartis公司在1998年使用該法上市了醋酸奧曲肽微球。該方法操作簡單,可實現連續化生產。但產品后處理困難,突釋率較高,有機溶劑用量很大。
2.4 噴霧干燥法
包埋油溶性藥物比較簡單,將藥物和高分子聚合物溶解在有機溶劑中,噴入惰性氣流,使低沸點的有機溶劑迅速蒸發而成球。當包埋親水性藥物時,先將藥物水溶液用超聲或高速乳化器制備成W/O型乳液,再噴入惰性氣流中制備微球[10]。Flexion公司在2017年使用該法上市了曲安奈德微球。該技術既適合熱敏性藥物又適合耐熱性藥物,可實現連續化生產。但獲得的產品之間容易粘連,存在溶劑殘留和水分較高,粒徑不可控,均一性差[11]等問題。
3 QbD的基本要素
3.1 確定QTPP
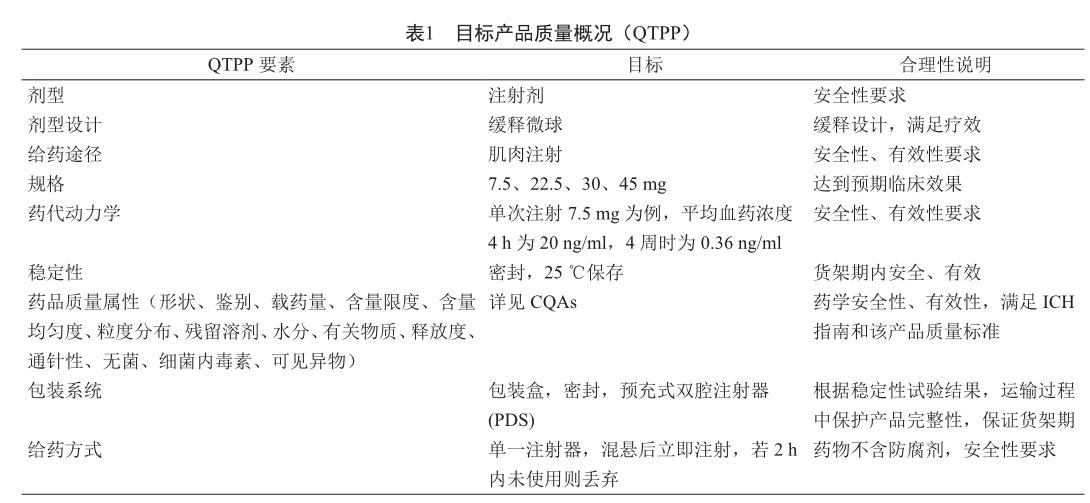
通過查閱部分文獻[12-13],分析曲安奈德微球[14-15]、醋酸亮丙瑞林微球[16-17]、醋酸奧曲肽微球[18-19]的Label和Chemistry Review(s),以及中國藥典2015版四部微粒制劑指導原則[2],運用“以終為始”的反向思維方式,對微球制劑的CQAs從理論上進行前瞻性的總結,定義了該類產品的QTPP,以醋酸亮丙瑞林微球為例,運用QbD的理念確定QTPP(表1)。
3.2 確定產品的CQAs
關鍵質量屬性(critical quality attribute,CQA):指產品的物理、化學、生物或微生物性質或特征,應在適當的限度、范圍或分布之內,以確保預期的產品質量[3]。參照國家食品藥品監督管理總局注射用醋酸曲普瑞林進口藥品注冊標準(JX20160400),結合前文文獻初步分析出微球制劑的CQAs(表2)。
3.3 風險評估:關鍵物料屬性、工藝參數與產品CQAs
風險評估是質量管理風險中一個重要的、以科學為依據的過程,有助于確定哪些物料特性和工藝參數對產品的CQAs有影響。
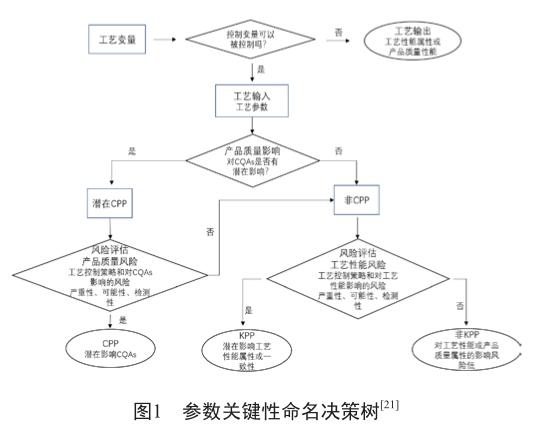
在實施過程中,通常會借助試驗設計等工具找出對CQAs有顯著影響的物料屬性和工藝參數,加深工藝理解,建立設計空間[20]。圖1是參數關鍵性命名的決策樹。
例如,鮑菲等[22]采用QbD理念對伊潘立酮微球的凍干工藝進行了優化,風險分析中明確了水分的殘留會影響藥物釋放,二氯甲烷殘留和有關物質影響藥物安全性,需要進行嚴格控制。同時,指明了影響水分、二氯甲烷殘留和有關物質的主要因素為一期和二期干燥溫度,通過試驗、借助軟件分析,確定了凍干工藝參數。
3.4 確定設計空間
設計空間(design space)是指建立合理的工藝參數、質量和標準參數,在應用工藝參數及物料屬性時,在設計空間內運行通常不被認為是變更,超出了設計空間就會被看作是變更。
首先,查閱文獻資料,結合已有的知識、經驗設計出一個知識空間。再通過風險分析、試驗設計(DoE),找出變量對CQAs的影響,從而得到一個可靠的設計空間。然后進行與規模和設備無關的物料屬性和工藝參數的調整[23-24]。工業界通常會進一步工藝研究,制定控制策略,確定出一個符合質量標準的控制空間。
例如,高飛等[25]應用QbD理念,對醋酸奧曲肽PLGA微球的凍干工藝進行了研究,使用JMP 10.0.0軟件進行試驗設計(DoE)和統計分析,找出了工藝參數和CQAs之間的關系,得到了該產品凍干工藝參數的設計空間。
3.5 定義控制策略
控制策略(control strategy):根據當前對產品和工藝的了解,為確保工藝性能和產品質量而計劃進行的一系列控制。這些控制可包括與原料藥以及制劑的材料和組分相關的參數和屬性、設施和設備運行條件、過程控制、成品質量標準以及相關的監測和控制方法與頻率[26]。
高飛等[25]在對醋酸奧曲肽PLGA微球的凍干工藝研究中,通過對凍干機板溫、凍干時間、真空度的控制,來確保微球的有關物質、水分、溶劑殘留達到目標要求。
3.6 產品生命周期管理與持續改進
生命周期(lifecycle):一個產品從開始研發到上市,直至產品終止的所有階段[3]。在產品生命周期內,隨著知識和經驗的增加,對工藝和產品的認識不斷加深,產品的質量也必將得到不斷改進。
4 總結與展望
微球制劑長效緩釋,可以大大提升患者用藥的方便性、依從性,在臨床上優勢明顯,是一種極具潛力的劑型。遺憾的是,由于注射用微球生產工藝復雜、釋藥行為難以控制、中試放大困難等技術壁壘原因,伴隨研發成本高、開發周期長等特點,國內成功上市的的產品較少。QbD是基于科學的風險評估和試驗設計來識別關鍵物料屬性和關鍵質量屬性,將QbD理念應用到微球制劑的研發過程中,將有助于加快該領域的產品落地,會起到很好的指導作用。目前QbD在微球制劑研發中的應用尚不全面,例如各國藥典中均缺乏相關指導原則,由于微球制劑的釋藥周期長,體外加速釋放與長期釋放的相關性,以及體內外相關性的研究仍是質控的難點,有待我們進一步研究。隨著科學技術的進步,新方法、新技術不斷被應用到微球領域,這些問題都將得到解決,也必會有更多的微球藥物在臨床上得到應用。
參考文獻
[1] Wang YJ, Sun XZ, Xu L, et al. Research progress and prospect of microsphere product[J]. Biol Chem Eng, 2017, 3(2): 80-83.
[2] 國家藥典委員會. 中華人民共和國藥典2015年版四部[M]. 北京: 中國醫藥科技出版社, 2015: 370-371.
[3] ICH. Pharmaceutical Development Q8(R2) [EB/OL]. [2020-04-12]. https: //database.ich.org/sites/default/files/Q8_R2_ Guideline.pdf.
[4] 顧書英, 詹輝, 任杰. 聚乳酸/PBAT共混物的制備及其性能研究[J]. 中國塑料, 2006, 20(10): 39-42.
[5] 楊高品. 熱熔擠出技術在制藥領域的應用[J]. 流程工業, 2017(24): 55-60.
[6] 趙轉霞, 符雯, 劉哲鵬, 等. 熱熔法制備曲普瑞林長效生物可降解微粒處方工藝的研究[J]. 中國現代應用藥學, 2016, 33(12): 1533-1538.
[7] 楊碩, 王立, 張文君, 等. 熱熔擠出技術在藥物制劑中的應用進展[J]. 藥學研究, 2017, 36(11): 664-666.
[8] Li X, Wei Y, Lv P, et al. Preparation of ropivacaine loaded PLGA microspheres as controlled-release system with narrow size distribution and high loading efficiency[J]. Colloids and Surfaces A: Physicochem Eng Aspects, 2019: 237-246.
[9] Awwad S, Day RM, Khaw PT, et al. Sustained release ophthalmic dexamethasone: in vitro in vivo correlations derived from the PK-Eye[J]. Int J Pharm, 2017, 522(1): 119-127.
[10] Wan F, Yang MS. Design of PLGA-based depot delivery systems for biopharmaceuticals prepared by spray drying[J]. Int J Pharm, 2016, 498(1/2): 82-95.
[11] 呂丕平, 王玉霞, 崔一民, 等. 蛋白類藥物緩釋微球制劑的研究進展[J]. 臨床藥物治療雜志, 2015, 13(3): 5-9.
[12] 劉承. D008緩釋微球的研究[D]. 武漢: 武漢工業大學, 2017.
[13] 李瑤瑤, 余飛, 薛英, 等. LC-MS/MS法測定曲普瑞林微球的酰化雜質[J]. 煙臺大學學報(自然科學與工程版), 2018, 31(4): 304-310.
[14] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 208845 [EB/OL]. [2020-04-12]. https:// www.accessdata.fda.gov/drugsatfda_docs/label/2017/ 208845s000lbl.pdf.
[15] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 208845 [EB/OL]. [2020-04-12]. https://www. accessdata.fda.gov/drugsatfda_docs/nda/2017/208845Orig1s0 00ChemRedt.pdf.
[16] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 019732 [EB/OL]. [2020-04-12]. https://www. accessdata.fda.gov/drugsatfda_docs/label/2019/020517s042, 019732s044lbl.pdf.
[17] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 019732 [EB/OL]. [2020-04-12]. https://www. accessdata.fda.gov/drugsatfda_docs/nda/2005/019732_S029_ Lupron%20Depot_APPROVAL%20PACKAGE.pdf.
[18] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 021008[EB/OL]. [2020-04-12]. https://www. accessdata.fda.gov/drugsatfda_docs/label/1998/21008lbl.pdf.
[19] FDA. Approval Date(s) and History, Letters, Labels, Reviews for NDA 021008[EB/OL]. [2020-04-12]. https://www. accessdata.fda.gov/drugsatfda_docs/nda/98/021008a_chemr. pdf.
[20] Zhang L, Mao S. Application of quality by design in the current drug development[J]. Asian J Pharm Sci, 2017, 12(1): 1-8.
[21] PDA. PDA technical report No. 60 (TR60). Process validation: a lifecycle approach [EB/OL]. [2020-04-12]. https://www.pda.org/bookstore/product-detail/1931-tr-60-process-validation.
[22] 鮑菲, 孫翠香, 高飛, 等. 基于QbD理念優化伊潘立酮微球的凍干工藝[J]. 食品與藥品, 2018, 20(2): 97-101.
[23] Li J, Qiao Y, Wu Z. Nanosystem trends in drug delivery using quality-by-design concept[J]. J Controlled Release, 2017, 256: 9-18.
[24] Van Heugten AJP, Vromans H. Scale up of semisolid dosage forms manufacturing based on process understanding: from lab to industrial scale[J]. AAPS Pharm Sci Tech, 2018, 19(5): 2330-2334.
[25] 高飛, 安廣峰, 鮑菲, 等. 基于QbD理念研究醋酸奧曲肽PLGA微球的凍干工藝[J]. 食品與藥品, 2017, 19(1): 7-12.
[26] ICH. Pharmaceutical Quality System Q10[EB/OL]. https:// database.ich.org/sites/default/files/Q10_Guideline.pdf.

