穩中有變 變中有新 重視能力
——2020年高考全國Ⅱ卷理綜化學試題特點分析
吳來慶 佘學智 陳再來
(甘肅省民樂縣第一中學 734500)
國務院辦公廳印發的《關于新時代推進普通高中育人方式改革的指導意見》明確指出,“實施普通高中新課程的省份不再制定考試大綱”.至此,“一核四層四翼”高考評價體系將成為新的命題指南和教學指導.2020年高考全國Ⅱ卷理綜卷化學試題嚴格遵循了基礎性、綜合性、應用性和創新性的命題要求,將必備知識、關鍵能力和學科核心素養進行了全面的考查,并在命題中充分體現出了學科價值的引領作用,達到了高考命題的立德樹人、服務選材和教學導向的作用.總體特點用八個字概括為“穩中有變,變中有新”.大部分試題延續了往年的考查內容和題型特點,今年的化學試題值得我們關注是由“知識考查” 向“能力考查”的轉化,重視情境載體中學科素養的培養.筆者就2020年高考全國Ⅱ卷理綜化學試題特點從兩個方面做一分析.
一、近三年全國Ⅱ卷化學試題對比分析 (考點分布)
2018~2020年全國Ⅱ卷化學試題考點分布見表1.
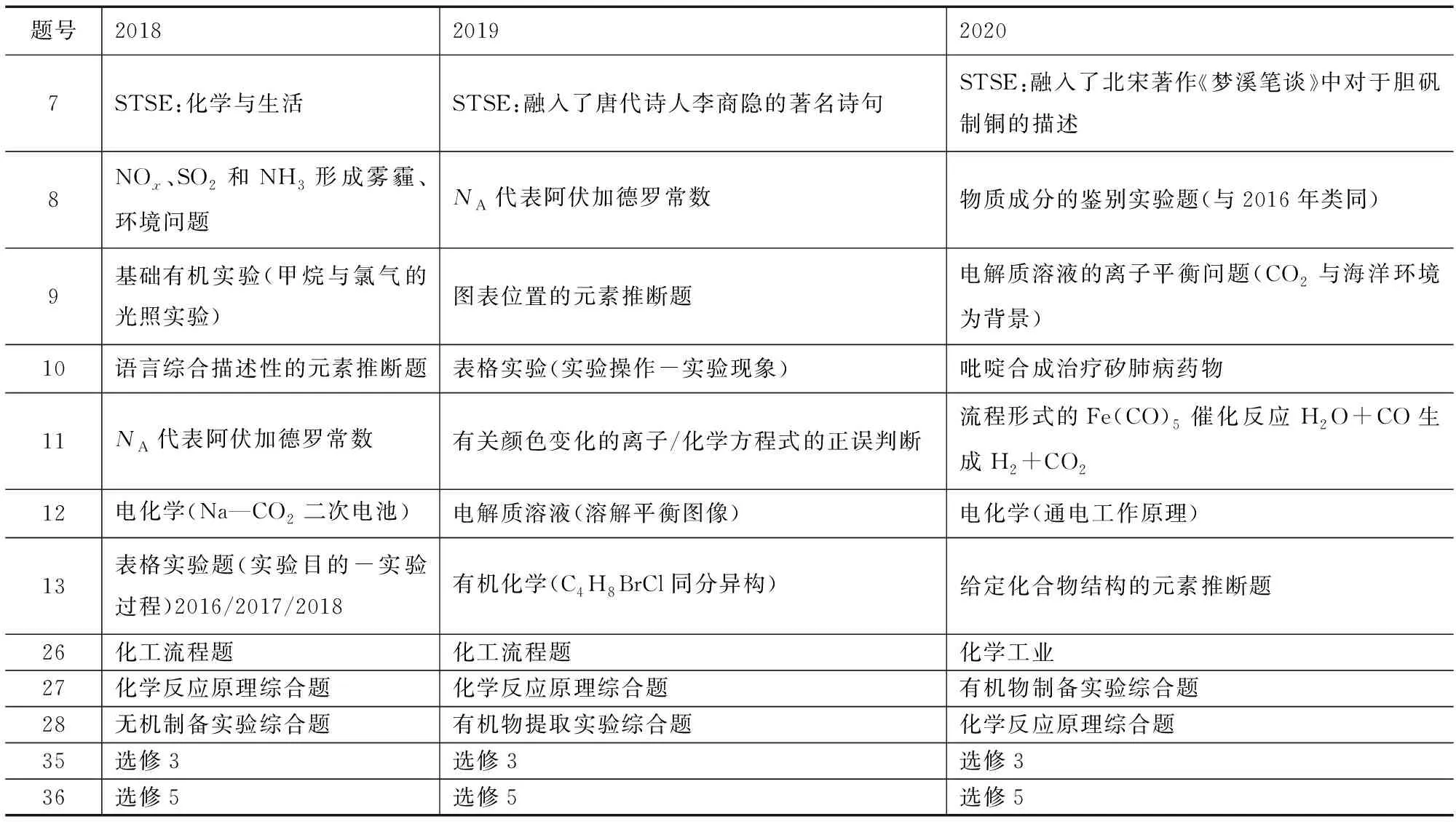
表1
通過近三年高考對比分析,2020年高考更注重學科基礎知識的考查,強調化學學科必備知識對化學學科素養培育的根基作用,但題型設置有所變化.試題采用了大量的真實情境素材,體現出對知識的應用性考查,凸顯學生學科關鍵能力和化學核心素養水平的測量.
二、2020年全國Ⅱ卷化學試題分析
7.北宋沈括《夢溪筆談》中記載:“信州鉛山有苦泉,流以為澗.挹其水熬之則成膽礬,烹膽礬則成銅.熬膽礬鐵釜,久之亦化為銅”.下列有關敘述錯誤的是( ).
A. 膽礬的化學式為CuSO4
B. 膽礬可作為濕法冶銅的原料
C. “熬之則成膽礬”是濃縮結晶過程
D. “熬膽礬鐵釜,久之亦化為銅”是發生了置換反應
分析與評價繼承2019年全國II卷考查題型,都是古文情景載體融入生產、生活中的實際情境,能培養學生應用化學知識處理并解決復雜任務的綜合品質.涉及必修一元素化合物知識,考查學生接受、吸收、整合化學信息的能力.難度不大,根據礬的概念可以直選答案.答案:A
8.某白色固體混合物由NaCl、KCl、MgSO4、CaCO3中的兩種組成,進行如下實驗:① 混合物溶于水,得到澄清透明溶液;② 做焰色反應,通過鈷玻璃可觀察到紫色;③ 向溶液中加堿,產生白色沉淀.根據實驗現象可判斷其組成為( ).
A. KCl、NaCl B. KCl、MgSO4
C. KCl、CaCO3D. MgSO4、NaCl
分析與評價涉及多年不常考的一種題型——物質鑒別的實驗題,凸顯對基礎實驗知識的考查,這或許是替換了2017、2018、2019年連續三年的表格實驗題,看似風格有明顯變化,但與2016年第12題幾乎是雙胞胎,涉及必修一元素化合物知識,考查學生接受、吸收、整合化學信息的能力和實驗的基本技能.答案:B
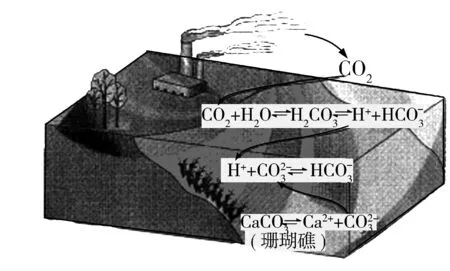
圖1
9.二氧化碳的過量排放可對海洋生物的生存環境造成很大影響,其原理如圖1所示.下列敘述錯誤的是( ).
B. 海水酸化能促進CaCO3的溶解,導致珊瑚礁減少
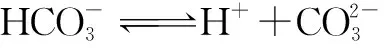
D. 使用太陽能、氫能等新能源可改善珊瑚的生存環境
分析與評價繼承往年涉及電解質溶液的題型,試題風格變化較大,以CO2排放對海洋生物的生存環境造成影響為背景,能突出考查學生的學科素養,考查溶液中的離子平衡問題,難度不大,替代了多年來難度較大的離子平衡問題的壓軸地位.答案:C
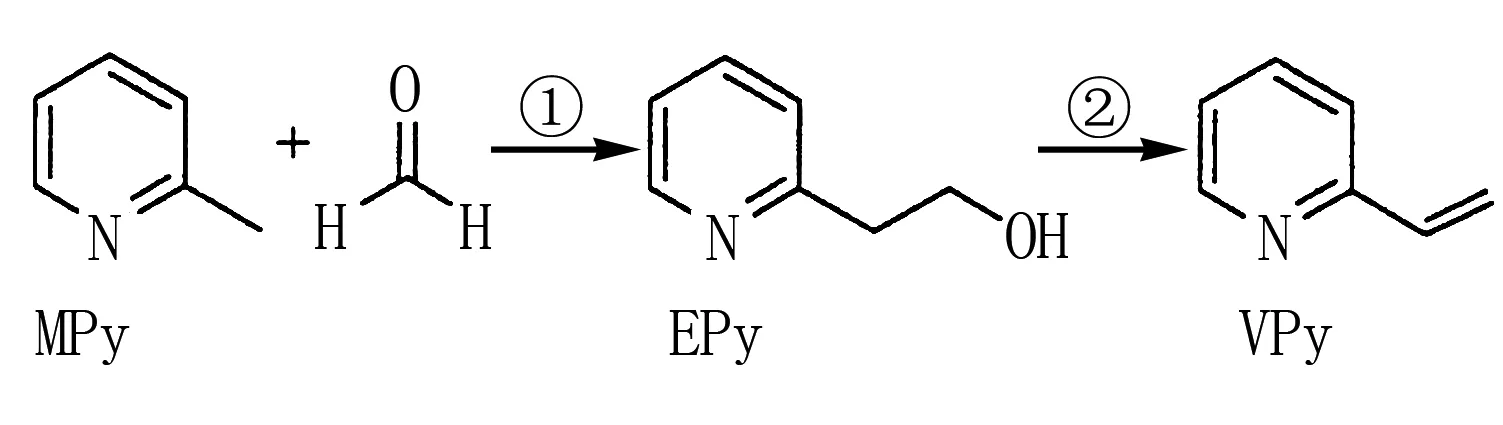
圖2
A. Mpy只有兩種芳香同分異構體
B. Epy中所有原子共平面
C. Vpy是乙烯的同系物
D. 反應②的反應類型是消去反應
分析與評價幾乎年年考的常規題型——有機物基礎知識的考查,旨在引導學生關注健康,體現學科素養,展示化學價值.考查學生的綜合能力,涉及鍵線式、同系物、同分異構、原子共面、反應類型,對不選選修5的同學來說,還是有挑戰性的.答案:D
11.據文獻報道:Fe(CO)5催化某反應的一種反應機理如圖3所示.下列敘述錯誤的是( ).
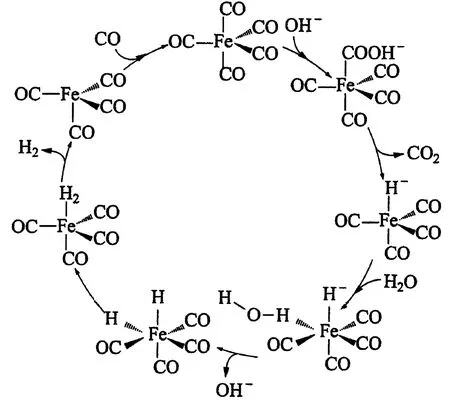
圖3
A. OH-參與了該催化循環
B. 該反應可產生清潔燃料H2
C. 該反應可消耗溫室氣體CO2
D. 該催化循環中Fe的成鍵數目發生變化
分析與評價涉及選修四化學反應原理中配位催化反應機理的問題,考查學生對化學反應歷程分析的關鍵能力,新課標教學要求新增加的(“知道化學反應是有歷程的和基元反應活化能”、“ 知道催化劑可以改變反應歷程”),只要根據歷程示意將參加的物質和生成的物質提取出來作對比即可做出選擇.答案:C
12.電致變色器件可智能調控太陽光透過率,從而實現節能.圖4是某電致變色器件的示意圖.當通電時,Ag+注入到無色WO3薄膜中,生成AgxWO3,器件呈現藍色,對于該變化過程,下列敘述錯誤的是( ).
A. Ag為陽極
B. Ag+由銀電極向變色層遷移
C.W元素的化合價升高

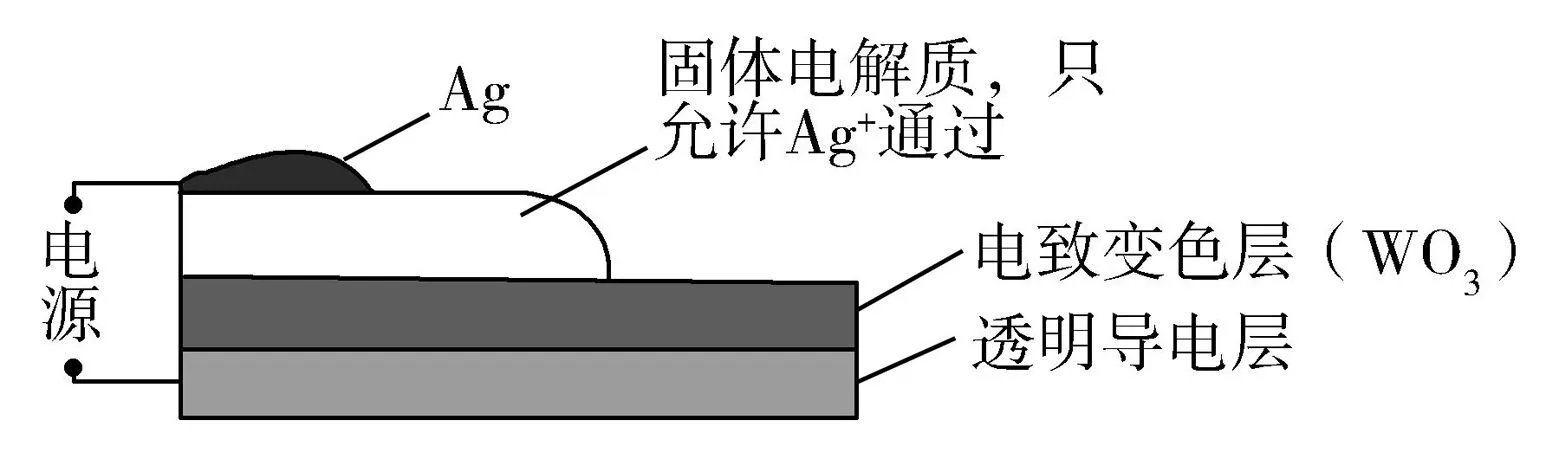
圖4
分析與評價繼承2017年、2018年全國Ⅱ卷常考題型——電化學知識,凸顯對信息提取能力、綜合分析能力的考查.選項很有特點,符合題意的一個選項與其他三個選項處出現矛盾.考查到了關鍵能力和學科素養.答案:C
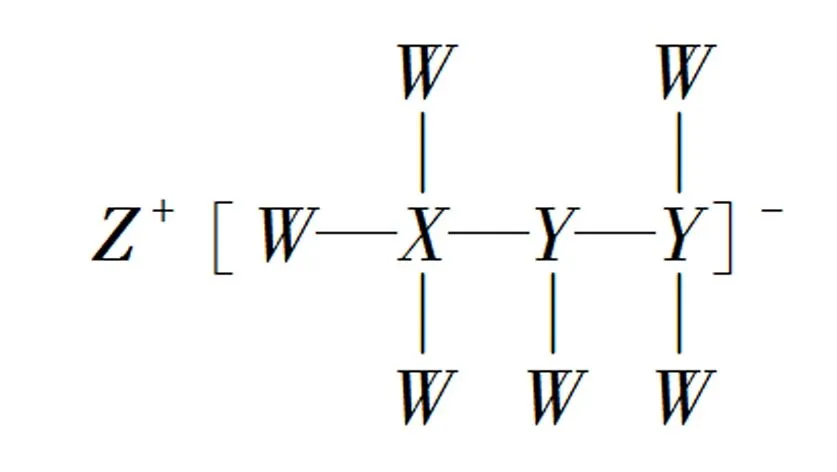
圖5
13.一種由短周期主族元素組成的化合物(如圖5所示),具有良好的儲氫性能,其中元素W、X、Y、Z的原子序數依次增大、且總和為24.下列有關敘述錯誤的是( ).
A. 該化合物中,W、X、Y之間均為共價鍵
B.Z的單質既能與水反應,也可與甲醇反應
C.Y的最高化合價氧化物的水化物為強酸
D.X的氟化物XF3中原子均為8電子穩定結構
分析與評價5年5考的常規題型——元素推斷題,學生的易錯點就是將未知X元素確定為碳元素,實際為硼元素,可能降低了正答率,真正打破了傳統的化學思維觀念.答案:D
二、非選擇題
1.必考題
26.化學工業為疫情防控提供了強有力的物質支撐.氯的許多化合物既是重要化工原料,又是高效、廣譜的滅菌消毒劑.回答下列問題:
(1)氯氣是制備系列含氯化合物的主要原料,可采用如圖6(a)所示的裝置來制取.裝置中的離子膜只允許____離子通過,氯氣的逸出口是____(填標號).
(3)Cl2O為淡棕黃色氣體,是次氯酸的酸酐,可由新制的HgO和Cl2反應來制備,該反應為歧化反應(氧化劑和還原劑為同一種物質的反應).上述制備Cl2O的化學方程式為____.
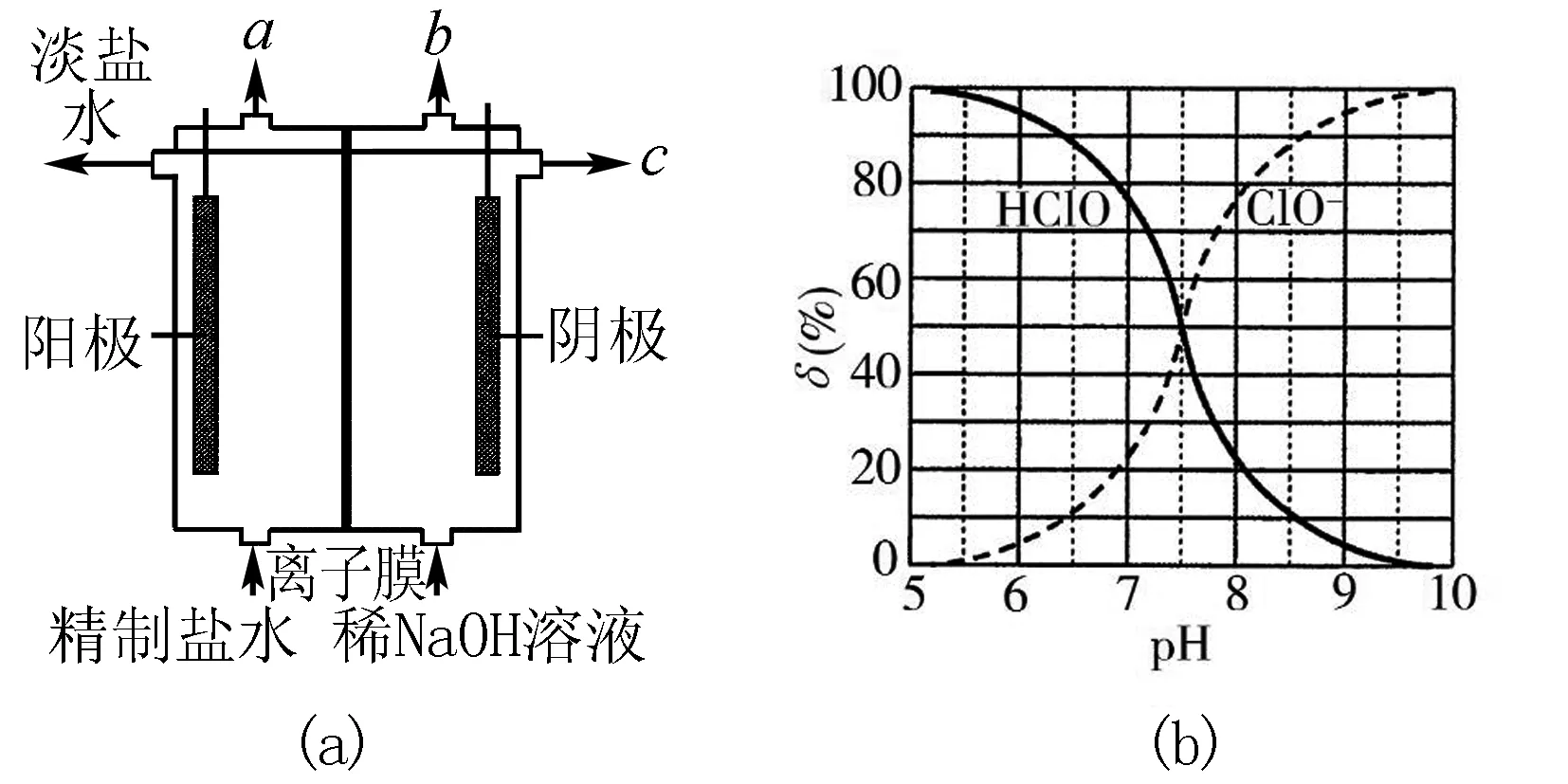
圖6
(4)ClO2常溫下為黃色氣體,易溶于水,其水溶液是一種廣譜殺菌劑.一種有效成分為NaClO2、NaHSO4、NaHCO3的“二氧化氯泡騰片”,能快速溶于水,逸出大量氣泡,得到ClO2溶液.上述過程中,生成ClO2的反應屬于歧化反應,每生成1 mol ClO2消耗NaClO2的量為____mol;產生“氣泡”的化學方程式為____.
(5)“84消毒液”的有效成分為NaClO,不可與酸性清潔劑混用的原因是____(用離子方程式表示).工業上是將氯氣通入到30%的NaOH溶液中來制備NaClO溶液,若NaClO溶液中NaOH的質量分數為1%,則生產1000 kg該溶液需消耗氯氣的質量為____kg(保留整數).

分析與評價聚焦時代主題,展示化學價值,普及公共衛生中化學知識,展現化學科學的社會功能.取消傳統的化工流程題的模式,試題分格有明顯變化,但沒有脫離化工題的軌道,與全國Ⅱ卷理綜2019年第26題以立德粉的生產工藝考查常見無機物性質及應用命題風格類似.試題內容以疫情防控所需含氯消毒劑的工業制法為背景,考查元素化合物、實驗基礎、電化學知識和圖表非文字信息的提取能力,試題中提到工業生產過程中氯及其化合物的相關性質及制備,加強氧化還原反應(歧化反應)基本概念、基本原理和相關計算的考查.本題既貼近課本基礎,有貼生活與健康.
27.苯甲酸可用作食品防腐劑.實驗室可通過甲苯氧化制苯甲酸,其反應原理簡示如下:
表2所列為甲苯、苯甲酸的有關數據.
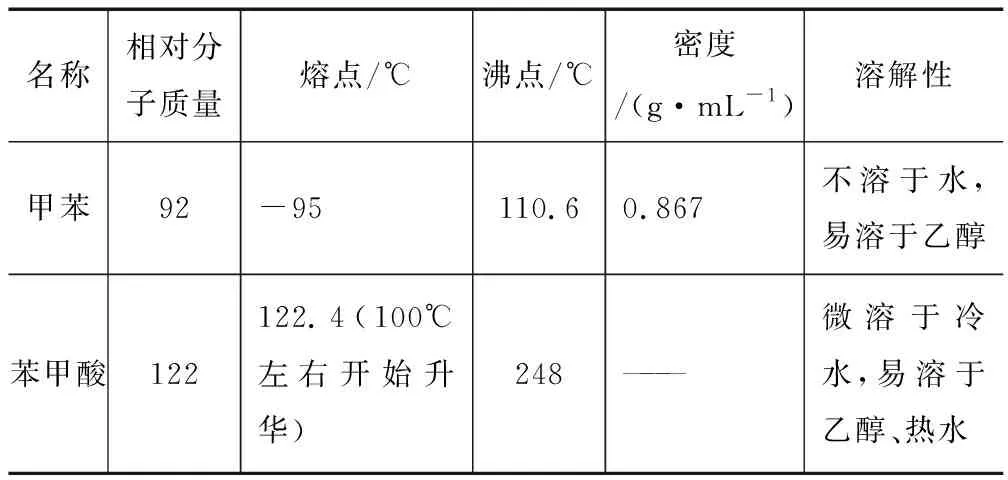
表2
實驗步驟:(1)在裝有溫度計、冷凝管和攪拌器的三頸燒瓶中加入1.5 mL甲苯、100 mL水和4.8 g(約0.03 mol)高錳酸鉀,慢慢開啟攪拌器,并加熱回流至回流液不再出現油珠.(2)停止加熱,繼續攪拌,冷卻片刻后,從冷凝管上口慢慢加入適量飽和亞硫酸氫鈉溶液,并將反應混合物趁熱過濾,用少量熱水洗滌濾渣.合并濾液和洗滌液,于冰水浴中冷卻,然后用濃鹽酸酸化至苯甲酸析出完全.將析出的苯甲酸過濾,用少量冷水洗滌,放在沸水浴上干燥.稱量,粗產品為1.0 g.(3)純度測定:稱取0.122 g粗產品,配成乙醇溶液,于100 mL容量瓶中定容.每次移取25.00 mL溶液,用0.01000 mol·L-1的KOH標準溶液滴定,三次滴定平均消耗21.50 mL的KOH標準溶液.
回答下列問題:
(1)根據上述實驗藥品的用量,三頸燒瓶的最適宜規格為____(填標號).
A.100 mL B.250 mL C.500 mL D.1000 mL
(2)在反應裝置中應選用____冷凝管(填“直形”或“球形”),當回流液不再出現油珠即可判斷反應已完成,其判斷理由是____.
(3)加入適量飽和亞硫酸氫鈉溶液的目的是____;該步驟亦可用草酸在酸性條件下處理,請用反應的離子方程式表達其原理____.
(4)“用少量熱水洗滌濾渣”一步中濾渣的主要成分是____.
(5)干燥苯甲酸晶體時,若溫度過高,可能出現的結果是____.
(6)本實驗制備的苯甲酸的純度為____;據此估算本實驗中苯甲酸的產率最接近于____(填標號).
A.70% B.60% C.50% D.40%
(7)若要得到純度更高的苯甲酸,可通過在水中____的方法提純.

分析與評價考查內容為有機物的制備實驗——食品防腐劑苯甲酸的制備,該題打破常規,題目沒有給出裝置圖,沒有讓學生去填寫實驗儀器,而是讓學生根據實驗所需選擇三頸瓶的規格和冷凝管的種類,凸顯由“知識考查”向“能力考查”的轉化,考查學生對題干文字信息提取和加工能力以及分析、解決化學問題的能力.最后一問有關苯甲酸的提純方法直接來源于選修五課本內容,提醒時刻不能忘“本(課本)”本題也是既貼近課本基礎,有貼生活與健康.
28.天然氣的主要成分為CH4,一般還含有C2H6等烴類,是重要的燃料和化工原料.

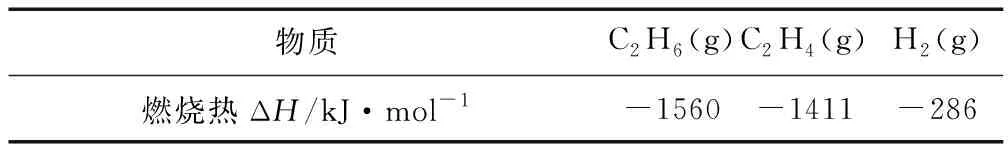
表3
①ΔH=____kJ·mol-1.
②提高該反應平衡轉化率的方法有____、____.
③容器中通入等物質的量的乙烷和氫氣,在等壓下(p)發生上述反應,乙烷的平衡轉化率為α.反應的平衡常數Kp=____(用平衡分壓代替平衡濃度計算,分壓=總壓×物質的量分數).
(2)高溫下,甲烷生成乙烷的反應如下:
反應在初期階段的速率方程為:r=k×c(CH4),其中k為反應速率常數.
①設反應開始時的反應速率為r1,甲烷的轉化率為α時的反應速率為r2,則r2=____r1.
②對于處于初期階段的該反應,下列說法正確的是____.
A.增加甲烷濃度,r增大 B.增加H2濃度,r增大
C.乙烷的生成速率逐漸增大 D.降低反應溫度,k減小
(3)CH4和CO2都是比較穩定的分子,科學家利用電化學裝置實現兩種分子的耦合轉化,其原理如圖7所示:
①陰極上的反應式為____.
②若生成的乙烯和乙烷的體積比為2∶1,則消耗的CH4和CO2體積比為____.
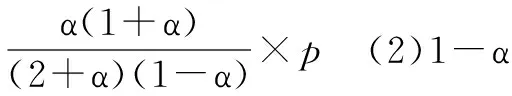
分析與評價滲透能源問題,化學反應原理綜合題,涉及反應熱的計算,影響化學平衡移動的因素,壓強平衡常數和速率平衡常數,電化學知識,其中的壓強平衡常數和速率平衡常數相關知識是高中化學課本中沒有的,這也是近幾年為高校選拔人才設計的理解應用綜合水平能力的考查,體現了高考的核心價值.
2.選考題
[化學——選修3:物質結構與性質]
35.鈣鈦礦(CaTiO3)型化合物是一類可用于生產太陽能電池、傳感器、固體電阻器等的功能材料,回答下列問題:
(1)基態Ti原子的核外電子排布式為____.
(2)Ti的四鹵化物熔點見表4,TiF4熔點高于其他三種鹵化物,自TiCl4至TiI4熔點依次升高,原因是____.
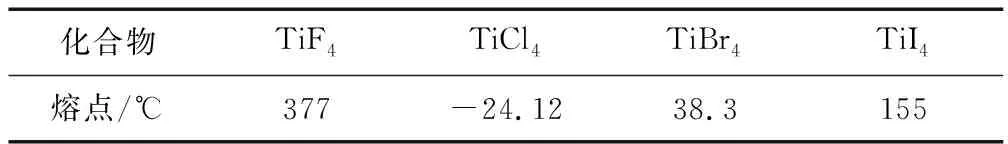
表4
(3)CaTiO3的晶胞如圖8(a)所示,其組成元素的電負性大小順序是____;金屬離子與氧離子間的作用力為____,Ca2+的配位數是____.

圖8
(5)用上述金屬鹵化物光電材料制作的太陽能電池在使用過程中會產生單質鉛和碘,降低了器件效率和使用壽命.我國科學家巧妙地在此材料中引入稀土銪(Eu)鹽,提升了太陽能電池的效率和使用壽命,其作用原理如圖8(c)所示,用離子方程式表示該原理____、____.
答案:(1) 1s22s22p63s23p63d24s2
(2) TiF4為離子化合物,熔點高,其他三種均為共價化合物,隨相對分子質量的增大分子間作用力增大,熔點逐漸升高
(3) O>Ti>Ca 離子鍵 12
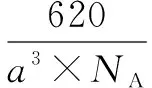

分析與評價鈣鈦礦型化合物可用于生產太陽能電池、傳感器、固體電阻器等的功能材料,這是我國科學家的研究成果,激發學生的愛國主義情懷,以鈣鈦礦為背景考查結構化學相關知識,大部分小題都比較常規,比較難的是通過比較兩個晶胞確定Ti4+的空間位置.
[化學——選修5:有機化學基礎]
12.維生素E是一種人體必需的脂溶性維生素,現已廣泛應用于醫藥、營養品、化妝品等.天然的維生素E由多種生育酚組成,其中α-生育酚(化合物E)含量最高,生理活性也最高.圖9是化合物E的一種合成路線,其中部分反應略去.
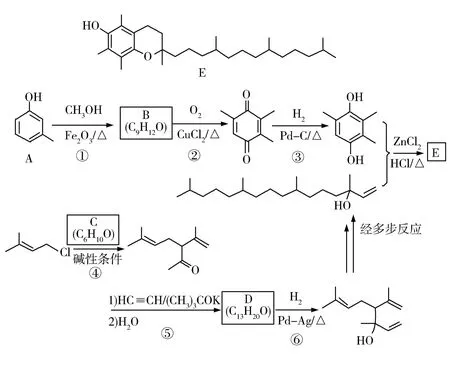
圖9
已知以下信息:
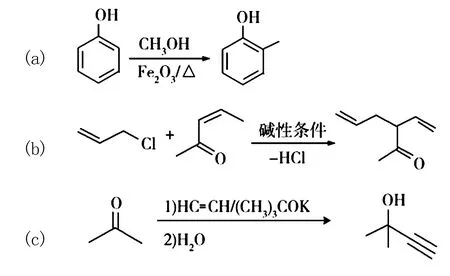
回答下列問題:
(1)A的化學名稱為____.
(2)B的結構簡式為____.
(3)反應物C含有三個甲基,其結構簡式為____.
(4)反應⑤的反應類型為____.
(5)反應⑥的化學方程式為____.
(6)化合物C的同分異構體中能同時滿足以下三個條件的有____個(不考慮立體異構體,填標號).
(ⅰ)含有兩個甲基;(ⅱ)含有酮羰基(但不含C=C=O);(ⅲ)不含有環狀結構.
(a)4 (b)6 (c)8 (d)10
其中,含有手性碳(注:連有四個不同的原子或基團的碳)的化合物的結構簡式為____.
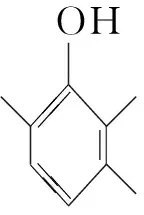
答案:(1). 3-甲基苯酚(或間甲基苯酚)
(4)加成反應
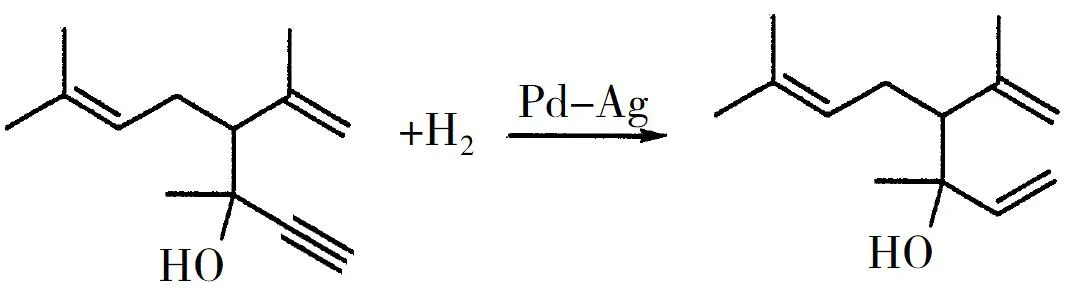
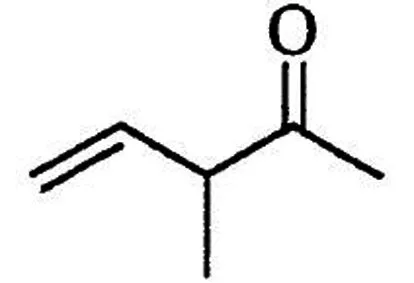
分析與評價關于維生素E的有機合成題,VE廣泛用于醫藥、營養品、化妝品,旨在引導學生關心社會、關心生活,關注健康.涉及問題比較常規,重點考查學生獲取和加工信息的能力,以及分析和解決化學問題的能力.
總之,2020高考全國Ⅱ卷整套化學試題的特點是立足基礎知識,關注學生能力,重視情境載體的融入.試卷在突出基礎知識考查的同時,更加重視對學生關鍵能力的考查.在信息設置時除了文字表述之外,側重于對數據、圖表、圖示等非文字信息的處理,考查學生獲取和加工信息的能力.試題中融入了大量生產、生活、健康、環境、科技、社會、能源、材料等中的實際情境,旨在培養學生在社會生活實踐或科學研究的復雜情境中,能在正確的思維觀念指導下綜合運用學科知識能力,處理并解決復雜任務的綜合品質.

