基于《課程標準》及《中國高考評價體系》的高考命題方案研究項目成果展示
江西河南
【例1】(超級全能生9月聯考,3題)下列有關常見有機物的說法錯誤的是
( )
A.可用NaOH溶液或溴水區別開植物油和裂化汽油
B.氯乙烷(C2H5Cl)與NaOH溶液反應轉化為C2H5OH屬于取代反應
C.苯、甲苯、硝基苯均可與H2反應
D.淀粉、纖維素、蛋白質均為天然高分子化合物
【答案】A
【新課程標準考查要求】1.知道有機化合物分子是有空間結構的,以乙烯、乙醇、乙酸、乙酸乙酯為例認識有機化合物中的官能團。知道有機化合物存在同分異構現象。2.認識乙烯、乙醇、乙酸的結構及其主要性質與應用;結合典型實例認識官能團與性質的關系,知道氧化、加成、取代、聚合等有機反應類型。知道有機化合物之間在一定條件下是可以轉化的。
【命題人命題角度】本題考查新課程標準要求中的第1點。常見有機物組成、性質、結構的考查屬于高頻考點。預設難度0.6。本題基于知識架構進行分析、推理及探究,設誤點為取代反應含義的應用。復習中老師應引導學生記住典型物質的組成、理解結構與性質之間的關系。
【試題分析】

考向分析錯誤方向規避錯誤關鍵點取代反應含義的理解不理解取代反應含義取代反應是指用一種基團替代有機物中原有的基團
【例2】(超級全能生9月聯考,4題)設NA為阿伏加德羅常數的值。下列有關說法錯誤的是
( )
A.常溫下,10 L pH=12的氨水中所含OH-的數目為0.1NA
B.2.0 g正丁烷和3.8 g異丁烷的混合物中極性鍵數目為NA
C.標準狀況下,22.4 L CH4與等體積的Cl2在光照條件下充分反應后,生成氣體的分子數為NA
D.物質的量為2 mol的Na2S和Na2S2混合物中含有的陰離子總數為2NA
【答案】C
【新課程標準考查要求】1.了解物質的量及其相關物理量的含義和應用。2.認識構成物質的微粒之間存在相互作用,結合典型實例認識離子鍵和共價鍵的形成,建立化學鍵概念。3.認識原子結構、元素性質與元素在元素周期表中位置的關系。知道元素、核素的含義,了解原子核外電子的排布。4.能基于物質的量認識物質組成及其化學變化,運用物質的量、摩爾質量、氣體摩爾體積、物質的量濃度之間的相互關系進行簡單計算。
【命題人命題角度】本題考查新課程標準要求中的第4點。阿伏加德羅常數屬于高頻考點。預設難度0.5。本題的設問角度主要是基于多元知識綜合考查,進行了基于知識架構下的分析、推理及探究。本題的設誤點為微粒數目的計算,甲烷和氯氣的反應。學生復習阿伏加德羅常數時,應綜合運用各知識點間的聯系對應典型例題練習,提升解題熟練程度。
【試題分析】
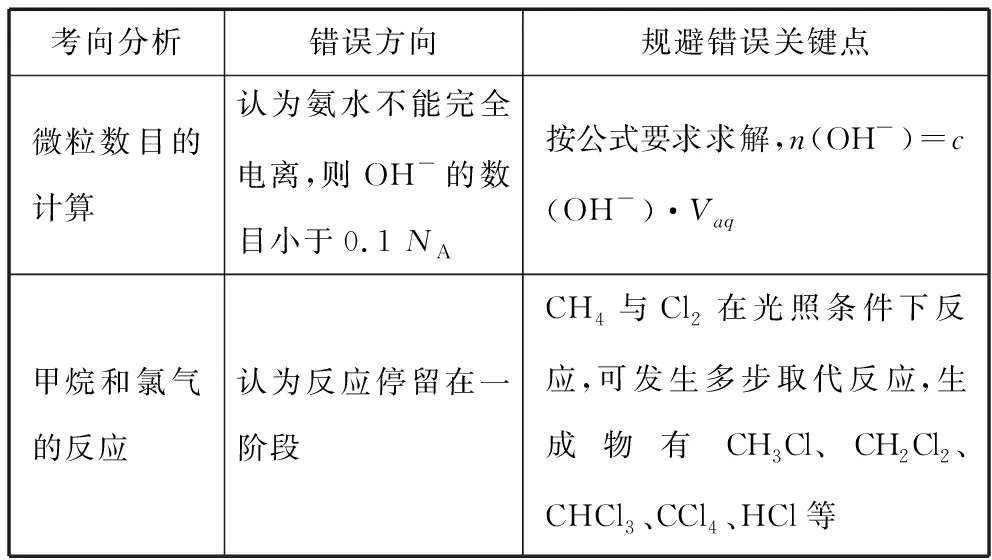
考向分析錯誤方向規避錯誤關鍵點微粒數目的計算認為氨水不能完全電離,則OH-的數目小于0.1 NA按公式要求求解,n(OH-)=c(OH-)·Vaq甲烷和氯氣的反應認為反應停留在一階段CH4與Cl2在光照條件下反應,可發生多步取代反應,生成物有CH3Cl、CH2Cl2、CHCl3、CCl4、HCl等
【例3】(超級全能生9月聯考,7題)一種制備高效漂白劑NaClO2的實驗流程如圖1所示,下列說法正確的是
( )
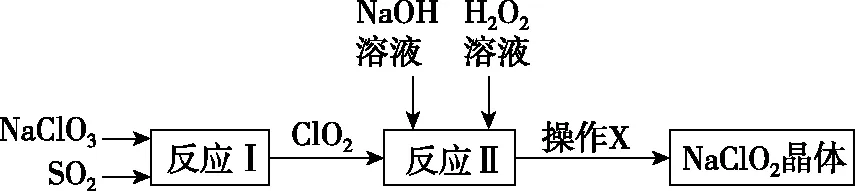
圖1
B.反應Ⅱ中H2O2發生還原反應
C.NaClO2有強氧化性,反應中只能作氧化劑
D.操作X為過濾、洗滌、干燥
【答案】A
【新課程標準考查要求】1.認識元素可以組成不同種類的物質,根據物質的組成和性質可以對物質進行分類。2.認識元素在物質中可以具有不同價態,可通過氧化還原反應實現含有不同價態同種元素的物質的相互轉化。3.結合真實情境中的應用實例或通過實驗探究,了解氯、氮、硫及其重要化合物的主要性質,認識這些物質在生產中的應用和對生態環境的影響。
【命題人命題角度】本題考查新課程標準要求中的第2點。元素性質屬于常考知識點。預設難度0.6。本題的設問角度主要是基于多元知識綜合考查,進行了基于知識架構下的分析、推理及探究。本題的設誤點為氧化還原反應理論的應用。學生在復習中應明確典型元素常見價態具體的存在形式;教師要深入講解如何利用化合價的變化分析知識間的轉化及化合價與物質氧化性、還原性的關系。
【試題分析】

考向分析錯誤方向規避錯誤關鍵點價態變化不能正確運用價態變化分析判斷物質的性質牢記價態升高的物質表現還原性,價態降低的物質表現氧化性
【例4】(超級全能生9月聯考,10題)電流型一氧化碳傳感器可用于室內CO含量的測定,其工作的原理可用如圖2裝置表示,傳感器工作過程中,下列敘述錯誤的是
( )
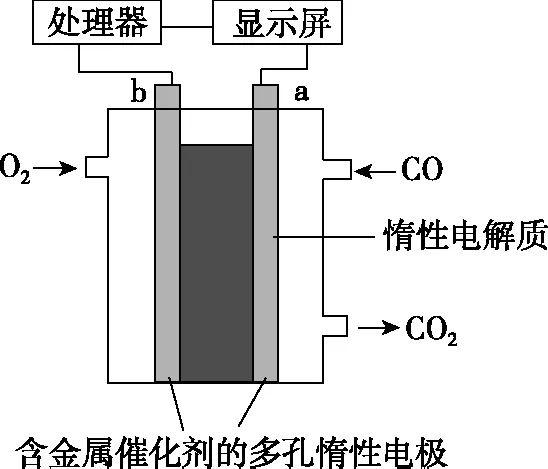
圖2
A.b為正極,電極表面發生還原反應
B.工作一段時間后溶液的pH幾乎不變

D.標準狀況下,當室內有11.2 mL的CO被反應時,理論上需消耗室內氧氣80 mg
【答案】D
【新課程標準考查要求】1.認識化學能與電能相互轉化的實際意義及其重要應用。2.了解原電池及常見化學電源的工作原理。3.了解電解池工作原理,認識電解在實現物質轉化和儲存中的具體應用。4.了解金屬發生電化學腐蝕的本質,知道金屬腐蝕的危害,了解防止金屬腐蝕的措施。
【命題人命題角度】本題考查新課程標準要求中的第2點。電化學題型屬于高頻考點。預設難度0.5。本題的設問方向主要是電池工作原理、pH判斷、電極反應式正誤的判斷及相關計算等。本題的設誤點為電極反應式正誤的判斷及相關計算。學生復習時,應熟練掌握原電池、電解池工作原理,能書寫電極反應式和總反應方程式并進行相關的計算。教師講解時要對這部分知識進行深度說明。
【試題分析】

考向分析錯誤方向規避錯誤關鍵點pH判斷只考慮某一個電極反應而忽略總反應判斷電池某一極的pH變化,考慮單個電極反應,判斷電解質溶液的pH,則需考慮總反應電極反應式正誤的判斷對原電池的工作原理理解不清,正、負電極或陰、陽極判斷錯誤理解常見原電池工作原理,掌握電極反應式書寫的一般步驟:
【規避錯誤應掌握的內容及習題選擇】
此類電化學題屬于難度中等考題。為避免出現錯誤則要熟練原電池工作原理,能書寫電極反應和總反應方程式,能進行相關的計算。聯系試題選擇方向為電化學(電解)試題。如下:
【例題1】高鐵酸鈉(Na2FeO4)是一種新型綠色水處理劑。工業上可用電解濃NaOH溶液制備Na2FeO4,其工作原理如圖3所示,兩端隔室中離子不能進入中間隔室。下列說法錯誤的是
( )

圖3
B.甲溶液可循環利用
C.離子交換膜a是陰離子交換膜
D.當電路中通過2 mol電子的電量時,會有1 mol H2生成
【答案】C
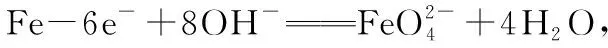
【例5】(超級全能生9月聯考,14題)在給定條件下,下列選項所示物質間的轉化均能實現的是
( )



【答案】D
【新課程標準考查要求】1.認識元素在物質中可以具有不同價態,可通過氧化還原反應實現含有不同價態同種元素的物質的相互轉化。2.結合實例認識金屬、非金屬及其化合物的多樣性,了解通過化學反應可以探索物質性質、實現物質轉化。
【命題人命題角度】本題考查新課程標準要求中的第1、2點。元素及其化合物的性質屬于高頻考點。預設難度0.5。本題的設問方向主要是元素及其化合物的性質等。本題的設誤點為偏鋁酸鈉蒸干灼燒得偏鋁酸鈉固體,氯化鋇溶液不與二氧化硫反應。學生復習時,應熟練掌握元素及其化合物之間的轉化。教師講解時要針對元素及其化合物之間的轉化等進行專題訓練。
【試題分析】

考向分析錯誤方向規避錯誤關鍵點偏鋁酸鈉溶液蒸干灼燒認為偏鋁酸根會水解,蒸干灼燒得氧化鋁熟練掌握如碳酸鈉、硅酸鈉、偏鋁酸鈉等溶液蒸干灼燒可得溶質氯化鋇溶液與二氧化硫反應認為氯化鋇溶液會與二氧化硫反應氯化鋇溶液不會與二氧化硫反應,違背了強酸制弱酸的原理
【規避錯誤應掌握的內容及習題選擇】此類元素及其化合物之間的轉化題型屬于難度中等考題。為防止出現錯誤要規避錯誤關鍵點。聯系試題選擇方向為元素及其化合物之間的轉化試題。如下:
【例題1】工業上,常用銅陽極泥(主要成分是Cu2Te,含少量的Ag、Au)回收碲,其工藝流程如圖4(已知TeO2微溶于水,易與濃強堿、濃強酸反應):
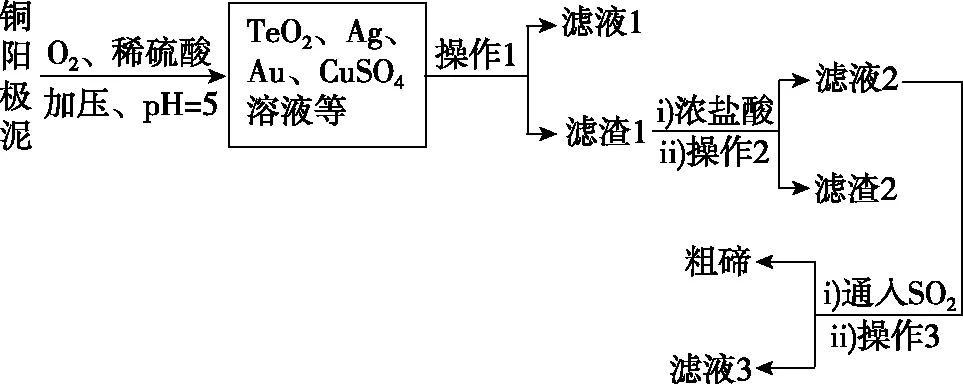
圖4
下列敘述錯誤的是
( )
A.合理處理陽極泥有利于保護環境和資源再利用
B.操作1、2、3均為過濾
C.可由濾渣2提取金屬Ag、Au
D.上述流程中用濃硝酸代替濃鹽酸可提高碲的回收率
【答案】D
【解析】銅陽極泥主要成分為Cu2Te,含少量的Ag、Au,在稀硫酸中溶解,并通入O2,得到TeO2、Au、Ag、CuSO4溶液;然后過濾,濾液1含有硫酸銅溶液等,濾渣1含有TeO2、Au、Ag,加入濃鹽酸過濾,則濾渣2含有Au、Ag,TeO2和加入的濃鹽酸反應得到TeCl4溶液,通入SO2氣體,可將溶液中的Te4+還原為Te,同時得到H2SO4。陽極泥中的Cu2Te可用于制備CuSO4、Te等,則合理處理陽極泥有利于保護環境和資源再利用,A項正確;由以上分析可知,操作1、2、3用于分離固體和液體,均為過濾,B項正確;可由濾渣2提取金屬Ag、Au,C項正確;濃硝酸可氧化Ag,使制備的碲中混有雜質,則不能用濃硝酸,故D項錯誤。

(1)基態錳原子的價電子排布圖為________,銅元素在周期表中位于________區。C、H、O、Cu四種元素的電負性由大到小的順序為________________,試從結構角度解釋在溶液中Mn2+比Fe2+穩定的原因:。
(2)上述反應前后,碳原子的雜化軌道類型分別為________,HCHO、CO2、H2O,三種分子中,HCHO分子構型是________,甲醛存在眾多的同系物,如乙醛、丙醛、丁醛等,上述四種醛中,沸點最高的醛是________。
(3)銅可形成兩種常見氧化物CuO、Cu2O,二者熔點依次為1 026℃、1 235℃,則二者的晶體類型是________。
(4)銅晶體中銅原子的堆積如圖5所示,銅的一種氧化物的晶胞如圖6所示。
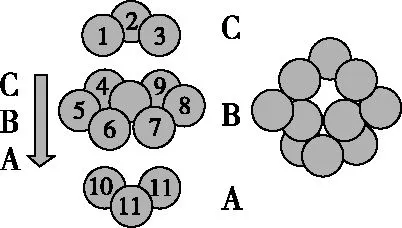
圖5
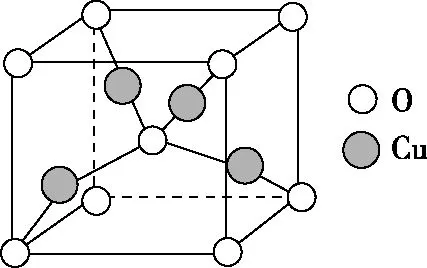
圖6
銅原子的堆積方式為____________________,未標號的銅原子形成晶體后的配位數為________,若晶胞參數為rpm,該氧化物的密度是ρg/cm3,則阿伏加德羅常數值NA=________。

(2)sp2、sp 平面三角形 丁醛
(3)離子晶體
【新課程標準考查要求】1.能結合能量最低原理、泡利不相容原理、洪特規則書寫1~36號元素基態原子的核外電子排布式和軌道表示式,并說明含義。2.能描述主族元素第一電離能、電負性變化的一般規律,能從電子排布的角度對這一規律進行解釋。3.能根據給定的信息分析常見簡單分子的空間結構,能利用相關理論解釋簡單的共價分子的空間結構。4.能借助分子晶體、共價晶體、離子晶體、金屬晶體等模型說明晶體中的微粒及其微粒間的相互作用。
【命題人命題角度】本題考查新課程標準要求中的第1、2、3、4點。屬于選考題中的必考內容。預設難度0.55。本題的設問角度主要是基于多元知識綜合考查,學生復習時要掌握三種結構與性質間的關系,掌握典型問題的分析思路。教師講解時引導學生建立結構決定性質的觀念,掌握問題的分析方法。
【試題分析】
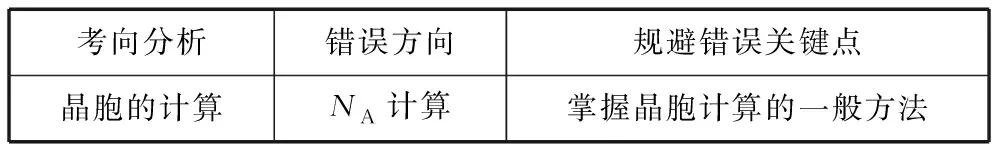
考向分析錯誤方向規避錯誤關鍵點晶胞的計算NA計算掌握晶胞計算的一般方法

