骨性關節炎基于補體系統發病機制的研究進展
汪亞婭,李妍,王福文
山東第一醫科大學(山東省醫學科學院),濟南250062
骨性關節炎(OA)又稱退行性關節病,是一種以關節軟骨退行性病變和繼發性骨質增生為主要病理改變的慢性關節疾病,臨床主要表現為關節疼痛、僵硬、腫脹、活動不便等,嚴重者會出現關節畸形,影響行走能力甚至喪失行走能力[1]。隨著我國人口老齡化加劇,OA 患者越來越多,已成為影響居民生活質量的常見疾病之一。研究表明,衰老、創傷、代謝障礙等多種因素參與OA 的發生、發展[2]。早期OA 患者滑膜液中即可出現T 細胞浸潤,而晚期某些細胞因子亦參與局部組織損傷。因此,炎癥反應可能在OA 的發生、發展過程中發揮重要作用。有研究認為,OA是由先天性免疫系統介導的低水平慢性炎癥性疾病,關節損傷后先天性免疫系統的固有識別病原體模式開啟,補體系統被激活形成膜攻擊復合物(MAC),促使軟骨細胞裂解,同時產生的C3a 和C5a等過敏毒素誘導免疫細胞產生炎癥因子,從而引起關節炎癥反應[3]。本文結合文獻就OA 基于補體系統發病機制的研究進展作一綜述。
1 補體系統概述
1.1 補體系統 補體是存在于正常人和動物血清與組織液中的一組經活化后具有酶活性的蛋白質,包括30 余種可溶性蛋白、膜結合性蛋白和補體受體,這些蛋白共同組成的多分子系統被稱為補體系統。補體系統是先天性免疫系統的重要組分之一,是機體防御病原體的第一道防線[4]。補體系統是由30 余種蛋白組成的不耐熱蛋白水解級聯反應攻擊性系統,其成分復雜,包括直接參與補體激活的各種補體固有成分、調控補體激活的各種因子以及分布于細胞膜上的補體受體等[5]。補體系統一般具有宿主防御,清除細胞碎片和免疫復合物,以及通過過敏素和B、T淋巴細胞刺激來指導適應性免疫調節等作用。當宿主細胞識別到外源性細胞或修飾的自體細胞上存在有害結構模式時,補體系統即會被激活,從而導致炎癥反應,最終引起靶細胞裂解[6]。補體系統的激活可由經典途徑、替代途徑以及凝集素途徑任意一條途徑完成,再經一系列絲氨酸蛋白酶的級聯反應,形成MAC 以及趨化因子、促炎癥因子等介質[7],從而參與細胞增殖和凋亡的調控。
1.2 補體系統激活 補體系統主要包括補體固有成分、補體調控成分和補體受體三部分組成。參與補體激活的主要是補體固有成分,包括C1、C2、C3、C4、C5、C6、C7、C8、C9、B 因子、D 因子、P 因子、凝集素、絲氨酸蛋白酶。根據激活物和激活條件的不同,可將補體激活途徑分為經典途徑、替代途徑和凝集素途徑三種,這三種途徑產生共同的激活產物C3a、C5a 和C5b-9,見圖1。經典途徑是由特定的配體結合至由識別蛋白C1q 組成的C1 復合物和蛋白水解亞基C1s、C1r 觸發的[8]。補體經典途徑激活涉及的補體成分包括C1q、C1s、C4 和C2,其中C1q 是經典補體激活途徑中的起始環節,C1s 可提供蛋白酶活性,二者共同作用將C2、C4 裂解為C3 轉化酶,最終與C5轉化酶共同形成MAC[9]。與經典途徑相比,凝集素途徑則是發生在細菌上的,與經典途徑類似的一系列反應,是甘露糖結合凝集素與富含碳水化合物的結構結合時引起的,其生成的補體成分亦為C3 轉化酶[10]。有研究報道,C4d 是凝集素途徑和經典途徑激活后的共同產物[11]。替代途徑是由不穩定的補體成分C3 自身激活及其隨后在活化病原體表面沉積而啟動的,一直處于低水平持續激活狀態[12]。替代途徑由B 因子、D 因子和P 因子組成,其活化過程中主要沉積的補體復合物為C1q、C4b、C9 和C3b,這幾種因子能夠維持替代途徑的持續活化。補體系統在機體清除外來抗原和免疫復合物中具有至關重要的作用,但其過度激活可導致自身組織損傷。
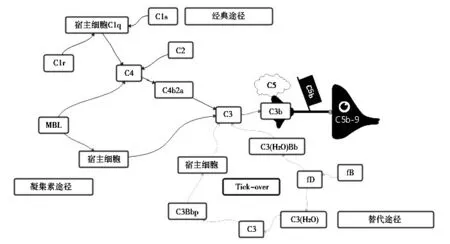
圖1 補體系統激活途徑概覽
2 補體系統與炎癥反應的關系
補體系統無論哪種途徑激活,最終都匯集于C3、C5 轉化酶形成,這兩種轉化酶會導致過敏毒素C3a、C5a 產生,這些過敏毒素會誘導免疫細胞產生炎癥因子,從而促進炎癥反應。而補體系統激活產生的MAC 會直接在細胞表面形成跨膜孔,導致細胞裂解,加速炎癥反應。MAC 與細胞表面結合時,還會激活促炎癥信號轉導通路,如MAPK、NF-κB 信號轉導通路,這些信號轉導通路激活亦能促進炎癥反應發生。有研究表明,補體系統的過度激活可能是炎癥反應發生的首要事件,也可能繼發于低度炎癥反應之后[13]。
3 補體系統在OA發生、發展中的作用機制
目前,關于OA 發生、發展的分子機制尚不完全清楚。近年研究認為,先天性免疫系統引起的低度炎癥反應可能在其發病過程中具有重要作用。
3.1 OA中由先天性免疫系統介導的炎癥信號轉導通路 有研究認為,OA不只是單純的關節退行性疾病,在OA 的發病機制中不僅涉及軟骨的破壞,還涉及軟骨異位骨形成、關節囊腫大、滑膜炎癥等。在排除外部機械性關節損傷后,結合OA 炎癥反應發生的時間、炎癥反應機制的合理性以及遺傳學上缺乏特定的炎癥分子動物模型等表明,OA的發生與先天性慢性炎癥反應密切相關[14]。OA 通常是在其他風險因素(如肥胖、高齡、代謝紊亂等)情況下觸發局部組織損傷,關節的慢性損傷或過度使用最終將轉化為炎癥反應過程[15]。WANG 等[13]通過蛋白質組學和轉錄組學分析OA 患者關節滑液發現,先天性免疫系統的主要細胞和因子,包括補體激活片段及其炎癥介質(如IL-1β、TNF-α),均在關節滑液中明顯升高。有研究還發現,OA患者血清中補體蛋白水平明顯升高,這是關節中存在炎癥反應的直接標志[16]。這些炎癥介質在一定程度上是由于組織損傷和關節破裂而合成的,它們會改變軟骨細胞的分化和功能,并誘導基質金屬蛋白酶和聚集蛋白聚糖酶的表達和活化,從而促進軟骨降解,加劇關節退化[17]。這些證據表明,炎癥反應在OA 的發生、發展過程中具有重要作用,靶向治療炎癥可能延緩OA的病情進展。
研究發現,OA 發病過程中的炎癥反應是慢性的、低度的,主要是由先天性免疫系統中補體激活所致,而且適應性較低,在OA 早期即開始發揮作用。另外,由于免疫系統、局部組織損傷和代謝功能失調等病理生理過程在體內相互作用,使得這種炎癥反應存在于各種原因引起的OA 中,并長期且慢性作用于關節組織,從而加速對關節軟骨的損傷[18]。最關鍵的是,這種炎癥反應可作用于整個關節,包括關節軟骨、滑膜、軟骨下骨、關節囊等。OA的炎癥病理狀態主要由先天性免疫系統介導,生成MAC 直接造成軟骨損傷,相應地軟骨受損又會引起新的炎癥反應,最終導致關節不可逆性損傷,長期如此將導致整個關節壞死。因此,進一步闡明炎癥反應在OA 發生、發展過程中的病理生理機制,有助于實現通過靶向控制炎癥反應來預防或控制疾病進展。
3.2 骨組織代謝與補體系統的關系 通常分解代謝和合成代謝不平衡而導致的體內平衡失調是由細胞因子級聯與炎癥介質共同驅動的。在骨骼重塑過程中,成骨細胞與破骨細胞存在動態平衡,這對于維持骨骼質量至關重要[19-20]。有研究表明,補體系統激活能夠調控關節中骨組織代謝,如C5a 通過其下游信號通路串擾調控骨組織代謝。MODINGER等[21]研究發現,成骨細胞在分化過程中C5a 受體1(C5aR1)過表達,而C5aR1能夠與成骨細胞中的Toll樣受體2 相互作用,從而激活p38 MAPK 信號通路,繼而誘導破骨細胞產生C-X-C基序趨化因子10。過敏毒素C5a與C-X-C基序趨化因子10相互作用可加重骨組織損傷[13]。該研究還發現,干擾素γ 信號傳導在C5a 調控的最主要途徑中發揮免疫調節作用,并能夠影響骨組織代謝[13],表明C5a 在干擾素信號傳導途徑中作為骨組織代謝和免疫系統的調節劑而發揮作用。總之,補體系統激活失調在OA 的發病機制中具有至關重要的作用,或可通過減少補體系統激活產物的生成來防止細胞裂解,從而減輕關節炎癥反應。
3.3 基于補體系統的OA 發病機制 OA 是由先天性免疫系統引起的,而補體系統是先天性免疫系統的核心組成部分。免疫系統通過特定的模式識別細胞表面或內部的受體和病原體,不僅可識別與病原體相關的分子模式,還可識別與損傷相關的分子模式(DAMPs)。有研究發現,至少有4 種DAMPs 與OA 有關,如炎癥部位的細胞外基質破壞產物、炎癥誘發或損傷誘發的血管滲漏、受損或壞死細胞釋放的細胞內警報蛋白以及由于損傷或磨損從軟骨釋放至關節腔的微觀晶體。產生的這些內源性損傷相關分子可以向先天性免疫系統發出信號,從而激活模式識別受體和補體[14]。補體激活后產生MAC,并誘導免疫細胞產生一系列炎癥介質,這些炎癥介質通常會逆向再次激活補體系統,再次激活對組織損傷具有一定修復作用[22]。這種炎癥—修復循環長期存在,可能對關節具有破壞性,導致關節內部產生低度慢性炎癥反應,這種炎癥反應又會加劇關節損傷,再次引起免疫激活反應,加重炎癥反應,最終導致OA的發生。在誘導炎癥反應過程中,與DAMPs結合的主要受體之一是Toll樣受體1~7和Toll樣受體9,這表明Toll樣受體的活化可能與OA病程中的滑膜炎、軟骨變性和疾病易感性有關[23]。在這一過程中,先天性免疫系統激活是OA 發生的關鍵,而補體系統是先天性免疫系統的核心組成部分,故補體系統激活的機制有可能是探索OA 發病機制的突破點。以往有研究報道,在OA 患者的軟骨和滑膜組織中檢測到補體成分和免疫球蛋白沉積,并且后續的研究證實補體成分是由軟骨細胞產生的[24],表明補體系統在OA 的發病機制中具有重要作用。因此,通過分析補體系統激活途徑中的相關因子,或許能夠阻止或減緩OA病情進展。
補體系統激活后,其產物受炎癥因子調控后生成C3、C5 轉化酶,C3、C5 轉化酶可誘導產生C3a、C5a 兩種過敏毒素,這兩種過敏毒素能夠誘導免疫細胞產生趨化因子,并通過激活MAPK 信號通路,最終導致OA 發生。補體系統激活后生成的產物MAC可插入軟骨細胞的表面,從而使軟骨細胞裂解,MAC 還可誘導NF-κB 信號轉導通路,最終導致OA發生[4,25]。見圖2。
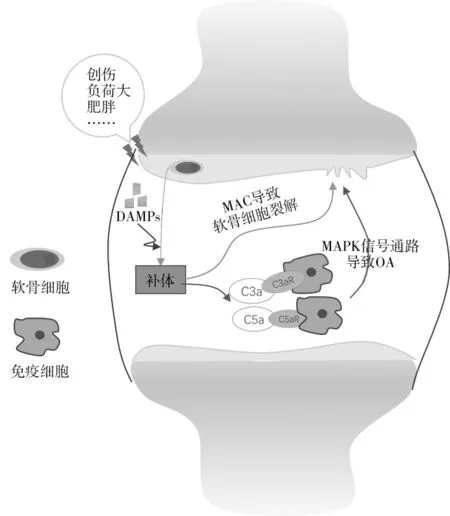
圖2 OA的發病機制示意圖
另外,補體系統還具有自反應性,可由機體自發激活,如細胞外基質中的纖維調節蛋白和骨黏附素可通過結合C1q 由經典途徑激活補體系統,從而誘發一些炎癥性疾病和自身免疫性疾病[4]。這種自反應性引起的炎癥反應也可能是OA 發病機制的重要組成部分[4]。
綜上所述,OA是由先天性免疫系統介導的低水平慢性炎癥性疾病,而補體系統是先天性免疫系統的核心組成部分,故補體系統激活介導的免疫應答反應可能是OA 發病的重要機制。因此,深入研究OA 發生、發展中的炎癥反應機制和補體激活途徑,將為我們提供更多的信息,從而為OA 的治療提供新的方法。但目前臨床尚無抑制補體激活的特異性藥物,還需要進一步研究。

