血清LXA4、γ-GGT、PLD 水平與2 型糖尿病周圍神經病變的關系
李書芳,吳莉明,范曉利
南京醫科大學附屬江寧醫院,南京211100
近年來,隨著居民生活方式轉變和人口老齡化加劇,我國糖尿病的患病率迅速上升[1-2]。糖尿病病程日久可出現各種急慢性并發癥。糖尿病周圍神經病變(DPN)是常見的累及全身多系統和器官的糖尿病慢性并發癥之一,也是糖尿病致殘和致死的主要原因[3]。有研究報道,DPN 的發生機制與氧化應激損傷、自身免疫功能紊亂、神經營養因子缺乏以及微循環功能異常等密切相關[4]。脂氧素A4(LXA4)是由花生四烯酸在脂氧合酶催化下生成的脂類介質,具有神經保護作用,可提高超氧化物歧化酶的活性,從而發揮抗氧化應激作用[5];γ-谷氨酰轉肽酶(γ-GGT)是主要在肝細胞膜及線粒體上表達的分泌酶,可通過激活氧化應激反應而參與細胞或組織損傷過程[6];脯氨酸肽酶(PLD)是一種蛋白水解酶,能夠通過影響氧化應激反應,介導膠原合成和基質重塑,進而參與糖尿病及其并發癥的發生[7]。本研究觀察了DPN 患者血清LXA4、γ-GGT、PLD 水平變化,并探討其與神經傳導功能損傷的關系。現報告如下。
1 資料與方法
1.1 臨床資料 選擇2018 年1 月—2020 年1 月南京醫科大學附屬江寧醫院收治的DPN 患者59 例(DPN 組),男31 例、女28 例,年齡46~79(68.32 ±5.61)歲。DPN 診斷標準[8]:①具有明確的糖尿病病史;②診斷糖尿病時或之后出現的神經病變;③有臨床癥狀者,如疼痛、麻木、感覺異常等,踝反射、針刺痛覺、震動覺、壓力覺、溫度覺五項檢查中任意一項異常;無臨床癥狀者,踝反射、針刺痛覺、震動覺、壓力覺、溫度覺五項檢查中任意兩項異常;④排除其他病因引起的神經病變。納入標準:①符合DPN診斷標準;②年齡>18歲,性別不限;③臨床資料完整;④自愿參與本研究。排除標準:①1 型糖尿病周圍神經病變者;②合并可能影響本研究結果的其他糖尿病并發癥者;③合并心、肝、腎等重要臟器嚴重功能不全者;④合并自身免疫性疾病、急慢性感染性疾病或惡性腫瘤者;⑤其他原因所致的神經功能損傷者;⑥入組前1 個月內服用過營養神經藥物者;⑦妊娠期或哺乳期婦女。同期選擇性別、年齡匹配的單純2 型糖尿病患者118例(糖尿病組),男67例、女51例,年齡43~75(66.54±6.73)歲。所有患者符合《中國2型糖尿病防治指南(2017 年版)》[8]中的診斷標準且未合并糖尿病并發癥。同期另選性別、年齡匹配的健康志愿者60 例(對照組),男34 例、女26 例,年齡40~77(65.93±6.25)歲。本研究經南京醫科大學附屬江寧醫院醫學倫理委員會審核批準,所有研究對象或其家屬知情同意并簽署知情同意書。
1.2 血清LXA4、γ-GGT、PLD 檢測 所有研究對象入組后,采集清晨空腹肘靜脈血6 mL,置于含EDTA的抗凝試管中,室溫靜置1 h,以3 000 r/min 離心5 min、離心半徑12 cm,取上層血清,-80 ℃冰箱保存。采用ELISA 法檢測血清LXA4、γ-GGT,試劑盒購自美國R&D 公司,檢測儀器為KHB-ST-360 酶標儀;采用克林納比色法檢測血清PLD,試劑盒購自上海羽朵生物科技有限公司,檢測儀器為H5PFX995光電比色儀。所有操作嚴格按照儀器操作規程或試劑盒說明進行。
1.3 神經傳導速度檢測 所有研究對象入組后,采用KEYPOINT4 肌電圖儀檢測正中神經、尺神經、橈神經、腓總神經、脛神經感覺支傳導速度。檢測環境溫度25 ℃,皮溫保持33~35 ℃。
1.4 資料收集與分析 收集DPN 組與糖尿病組臨床基本資料和實驗室檢查資料,臨床基本資料包括性別、年齡、BMI、糖尿病病程、吸煙史、收縮壓(SBP)、舒張壓(DBP)等,實驗室檢查資料包括FPG、HbA1c、TG、TC、HDL-C、LDL-C、LXA4、γ-GGT、PLD。采用多因素Logistic 回歸模型分析影響DPN 發生的危險因素。
1.5 統計學方法 采用SPSS19.0 統計軟件。計量資料以±s表示,多樣本均數比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。計數資料比較采用χ2檢驗。相關性分析采用Pearson 積矩相關分析法。危險因素分析采用多因素Logistic 回歸模型。P<0.05為差異有統計學意義。
2 結果
2.1 三組血清LXA4、γ-GGT、PLD水平比較 見表1。
表1 三組血清LXA4、γ-GGT、PLD水平比較(±s)
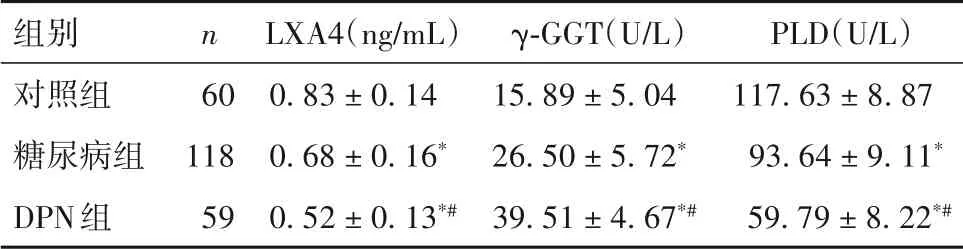
表1 三組血清LXA4、γ-GGT、PLD水平比較(±s)
注:與對照組比較,*P<0.05;與糖尿病組比較,#P<0.05。
組別對照組糖尿病組DPN組PLD(U/L)117.63±8.87 93.64±9.11*59.79±8.22*#n 60 118 59 LXA4(ng/mL)0.83±0.14 0.68±0.16*0.52±0.13*#γ-GGT(U/L)15.89±5.04 26.50±5.72*39.51±4.67*#
2.2 三組正中神經、尺神經、橈神經、腓總神經、脛神經感覺支傳導速度比較 見表2。
表2 三組正中神經、尺神經、橈神經、腓總神經、脛神經感覺支傳導速度比較(m/s,±s)

表2 三組正中神經、尺神經、橈神經、腓總神經、脛神經感覺支傳導速度比較(m/s,±s)
注:與對照組比較,*P<0.05;與糖尿病組比較,#P<0.05。
組別n 感覺支傳導速度對照組糖尿病組DPN組脛神經61.02±5.99 59.23±6.04 45.17±5.87*#60 118 59正中神經60.11±5.94 59.23±6.02 47.95±5.73*#尺神經60.97±6.56 60.38±6.34 49.22±6.51*#橈神經61.59±6.17 61.03±6.20 50.17±5.98*#腓總神經54.53±6.34 53.86±6.55 42.24±6.39*#
2.3 DPN 患者血清LXA4、γ-GGT、PLD 水平與神經傳導速度的關系 Pearson 積矩相關分析顯示,DPN患者血清LXA4 水平與正中神經、尺神經、橈神經、腓總神經、脛神經感覺支傳導速度均呈正相關關系(r分別為0.611、0.632、0.597、0.564、0.615,P均<0.05),血清γ-GGT水平與正中神經、尺神經、橈神經、腓總神經、脛神經感覺支傳導速度均呈負相關關系(r分別為-0.589、-0.602、-0.633、-0.591、-0.614,P均<0.05),血清PLD水平與正中神經、尺神經、橈神經、腓總神經、脛神經感覺支傳導速度均呈正相關關系(r分別為0.692、0.627、0.551、0.57、0.623,P均<0.05)。
2.4 影響DPN 發生的危險因素分析 在單因素分析中,臨床基本資料納入7個因素,實驗室檢查資料除血清LXA4、γ-GGT、PLD 水平外納入6 個因素。DPN組男31例、女28例,年齡(68.32±5.61)歲,BMI(23.76±2.25)kg/m2,糖尿病病程(11.24±3.78)年,有吸煙史26 例,SBP(121.51 ± 10.65)mmHg、DBP(81.19 ± 4.57)mmHg;糖尿病組男67 例、女51 例,年齡(66.54 ± 6.73)歲,BMI(23.40 ± 2.38)kg/m2,糖尿病病程(6.28 ± 4.11)年,有吸煙史38 例,SBP(118.96±11.34)mmHg、DBP(80.22±5.04)mmHg。DPN 組年齡、糖尿病病程均高于糖尿病組(P均<0.05),其他臨床基本資料比較差異均無統計學意義(P均>0.05)。兩組實驗室檢查資料比較見表3。
以是否發生DPN 為因變量,以兩組臨床基本資料和實驗室檢查資料中有統計學差異的因素為自變量,納入多因素Logistic回歸模型(α入=0.05,α出=0.10),結果發現,糖尿病病程、HbA1c、γ-GGT 是影響DPN 發生的危險因素,而LXA4、PLD 是影響DPN 發生的保護因素(P均<0.05)。見表4。
表3 兩組實驗室檢查資料比較(±s)

表3 兩組實驗室檢查資料比較(±s)
注:與糖尿病組比較,*P<0.05。
組別糖尿病組DPN組LDL-C(mmol/L)2.87±0.89 2.85±0.81 n 118 59 FPG(mmol/L)6.96±1.22 6.85±1.45 HbA1c(%)8.09±1.41 10.34±1.23*TG(mmol/L)2.21±0.65 2.13±0.57 TC(mmol/L)4.95±0.71 4.92±0.64 HDL-C(mmol/L)1.02±0.29 1.07±0.31
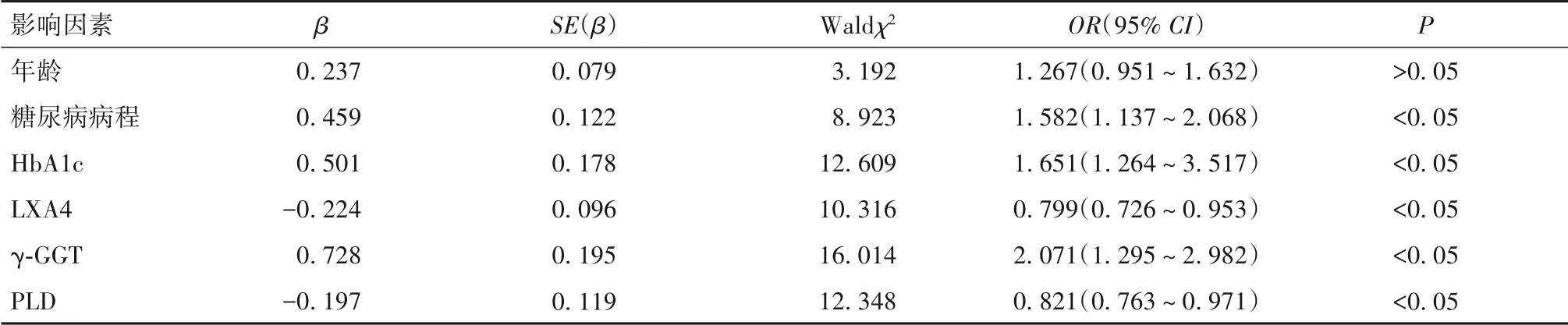
表4 影響DPN發生的多因素Logistic回歸分析結果
3 討論
隨著社會經濟水平提高及人們生活方式轉變,全球糖尿病的患病率逐年增加。我國是全球糖尿病患者例數最多的國家。有報道顯示,我國糖尿病的患病率高達11.6%,其中90%以上為2 型糖尿病患者[9]。機體長期處于高血糖狀態可引起心、肝、腎等重要器官結締組織結構改變,從而導致大血管和微血管并發癥。DPN 是常見的累及全身多系統和器官的糖尿病慢性并發癥之一,也是糖尿病致殘和致死的主要原因[3]。有研究報道,DPN 在2 型糖尿病患者中的發病率為30%~90%,如病情未得到有效控制,可累及全身神經系統并導致足部潰爛,嚴重者甚至截肢[10-11]。
DPN 的發病機制復雜,涉及炎癥反應激活、物質代謝紊亂及氧化應激反應激活等,其中氧化應激學說是目前研究的熱點。有研究認為,高血糖使機體產生超過自身抗氧化能力的活性自由基,從而激活氧化應激反應,并進一步引起神經細胞代謝異常和信號轉導障礙,導致神經細胞死亡,最終形成DPN[12]。LXA4 是花生四烯酸在脂氧合酶催化作用下生成的內源性抗炎介質,通過與受體ALX 結合,清除凋亡的中性粒細胞并抑制其聚集,從而發揮抑制炎癥反應和促進炎癥消退的作用[13]。劉云濤等[14]研究報道,LXA4 具有神經保護作用,可緩解神經炎和神經病理性疼痛,將LXA4 注射至腸缺血再灌注損傷大鼠尾靜脈發現,LXA4 可提高超氧化物歧化酶活性,從而發揮抗氧化應激作用。γ-GGT 是一類主要分布于肝細胞膜和線粒體上的分泌酶,屬于氧還原酶類。γ-GGT 中的谷胱甘肽(GSH)和谷氨酰轉肽酶(GGT)在氧化應激反應中發揮重要作用,GSH可發揮抗氧化作用,而GGT 能夠激活氧化應激反應[15]。有研究認為,γ-GGT 水平升高可提示機體存在較強的氧化應激反應狀態,而氧化應激反應又是胰島素抵抗的始動因素[16-17]。因此,γ-GGT 水平升高時,在胰島素抵抗狀態下由胰島素參與的神經組織對葡萄糖的利用率降低,同時γ-GGT 水平升高抑制胰島素所依賴的神經血管擴張,上述作用造成神經細胞供血和供氧長期不足,損傷神經組織,從而引起DPN。此外,γ-GGT 分解GSH 為半胱氨酰甘氨酸、谷氨酸殘基,半胱氨酰甘氨酸可產生超氧化物歧化酶從而分泌氧自由基,造成脂質過氧化及細胞凋亡,脂質過氧化產物有細胞毒性可消耗GSH,導致軸突信號轉導異常,最終引起神經細胞凋亡。PLD是由2 個相同亞基組成的二聚體,可催化帶有二肽羧基末端的脯氨酸或羥脯氨酸水解并釋放脯氨酸,從而參與膠原蛋白的生物合成。有研究發現,機體中富含脯氨酸及羥脯氨酸的膠原蛋白代謝障礙時,在負反饋調節機制下可降低PLD活性[18]。SABUNCU等[19]研究證實,氧化應激反應在DPN 中發揮重要作用,而氧化應激反應對膠原合成具有抑制作用,膠原又是細胞外基質成分。而DPN 患者存在不同程度的細胞外基質代謝障礙,膠原纖維、其他細胞外基質蓄積并引起血管內皮纖維化。由此可見,PLD 活性改變與DPN發生密切相關。
本研究結果顯示,DPN 患者血清γ-GGT 水平顯著升高,血清LXA4、PLD水平顯著降低,提示LXA4、γ-GGT、PLD 可能參與DPN 的發生、發展過程。有研究報道,在DPN 發生、發展過程中,氧化應激反應激活后機體會產生大量的活性氧,引起神經細胞病變、感覺神經功能異常并破壞神經纖維,從而使神經傳導速度減慢[20]。本研究結果顯示,DPN 患者存在不同程度神經傳導功能損傷,并且血清γ-GGT 水平與神經傳導速度呈不同程度負相關關系,血清LXA4、PLD 水平與神經傳導速度呈不同程度正相關關系,提示血清LXA4、γ-GGT、PLD水平可輔助評估DPN神經傳導障礙程度。本研究多因素Logistic回歸分析在校正混雜因素后發現,糖尿病病程、HbA1c、γ-GGT是影響DPN 發生的危險因素。糖尿病病程每增加1年,DPN 的發生風險增加1.582 倍,可能是因為機體長期慢性高血糖可改變神經細胞內外滲透壓,從而導致神經細胞腫脹,神經在肢體的解剖狹窄部位受到機械性卡壓,最終引起DPN。糖尿病病程越長,神經細胞腫脹越嚴重,越容易發生DPN。HbA1c 是血液中與葡萄糖結合的血紅蛋白,可反映糖尿病患者2~3 個月內血糖控制情況,且其水平穩定,不受運動、藥物、飲食等影響。本研究結果顯示,HbA1c每增加1%,DPN 的發生風險增加65.1%,提示HbA1c 可作為預測DPN 發生的重要指標。本研究發現,γ-GGT 每增加1 U/L,DPN 的發生風險增加2.071 倍,這與γ-GGT 在半胱氨酰甘氨酸的離子依賴途徑下合成并分泌大量活性氧,從而進一步引起氧化應激反應有關。本研究結果還發現,LXA4、PLD 是影響DPN 發生的保護因素,可能是因為LXA4 在氧化應激反應過程中發揮較強的抑制作用,能夠保護神經元細胞免受損傷,而PLD 則能夠通過維持機體結締組織的膠原表達并負反饋抑制氧化應激反應。
綜上所述,DPN 患者血清γ-GGT 水平升高,是影響DPN 發生的危險因素,而血清LXA4、PLD 水平降低,是影響DPN 發生的保護因素;血清LXA4、γ-GGT、PLD 水平變化均與DPN 患者神經傳導功能損傷密切相關。

