L-丙氨酸轉化菌發酵條件的優化
徐慧,崔穎,王珊珊,田延軍,賀強之,韓延雷,劉建軍*,朱坤福,祝蕾,姜國政
(1.齊魯工業大學(山東省科學院)山東省食品發酵工業研究設計院,山東濟南250013;2.山東朱氏藥業集團有限公司,山東菏澤274300;3.煙臺恒源生物股份有限公司,山東煙臺265709)
L-丙氨酸,又名L-2-氨基丙酸,是一種具有重要生理功能的非必需氨基酸,在食品、醫藥等領域具有廣泛的應用,并有日益增長的趨勢[1-2]。食品應用方面,L-丙氨酸具有甜味與鮮味,被用于食品添加劑,改善食品風味并強化營養,此外其還具有較強的防腐保鮮功能,被用作防腐劑[3-6]。醫藥應用方面,L-丙氨酸是復合氨基酸注射液的組成成分之一,是合成維生素B5、維生素B6、L-氨基丙醇(鹽酸左氧氟沙星)和抗癌藥4-羥基水楊醛丙氨酸合鋅的前體物質[7-8]。此外,L-丙氨酸可用于合成具有光學活性的聚合物,在生物醫學、液晶、手性催化等領域具有重要的價值[9]。
L-丙氨酸可以通過提取法、化學合成法和生物轉化法進行制備。其中,酶法轉化是目前工業上的主要生產方法,即利用L-天冬氨酸-β-脫羧酶(L-aspartate-β-decarboxylase,Asd)以L-天冬氨酸(L-aspartic acid,L-Asp)為原料經脫羧生成L-丙氨酸。1951 年,MEISTER 等[10]首次發現了韋爾奇梭菌(Clostridiumn welchii)能催化L-Asp 合成L-丙氨酸。隨后國內外很多研究人員對此法生產L-丙氨酸進行了深入的研究。SHIBATANI 等[11]以Pseudomonas dacunhae 為產酶菌株,研究不同氨基酸作為氮源對產酶的影響,結果發現L-谷氨酸誘導后產酶量是未添加L-谷氨酸的2 倍。徐虹等[12]通過誘變育種獲得一株高Asd 活性的菌株Pseudomonas NX-1,每升培養液可轉化L-Asp 達1.4 kg,L-丙氨酸含量可達到90%以上,摩爾轉化率接近100%。儲瑞藹等[13]對產酶菌株P.dacunhae CPU9001進行了固定化,并優化了其催化L-Asp 合成L-丙氨酸的發酵條件,每1 kg 固定化細胞可轉化2 kg 底物,轉化率大于98%,產物收率大于85%,固定化細胞酶活半衰期大于80 d,產品純度大于98.5%。周麗等[14]以大腸桿菌為出發菌株,敲除編碼乳酸、甲酸、乙酸、乙醇、琥珀酸和丙氨酸消旋酶的基因,導入嗜熱脂肪芽孢桿菌(Geobacillus stearothmophilus)來源的L-丙氨酸脫氫酶基因(alaD),構建的重組菌以初始濃度30 g/L 的葡萄糖作碳源,經補料發酵得到67.2 g/L L-丙氨酸。徐友強等[7]將來源于睪丸酮叢毛單胞菌的Asd 基因克隆至大腸埃希氏菌CICC11022S 中,構建了一株轉化富馬酸生產L-丙氨酸的重組工程菌,該菌9 h 轉化富馬酸生成112.7 g/L 產物,生產速率為12.5 g/(L·h),轉化率為93.8%。
Asd 是至今在自然界中唯一的氨基酸-β-脫羧酶,以5′-磷酸吡哆醛(pyridoxal 5′-phosphate,PLP)為輔酶因子,是L-丙氨酸合成的關鍵酶[15]。汪芳[16]實現了P. dacunhae 來源的Asd(aspD)基因在大腸桿菌中的異源表達,通過定點突變改善了該酶在酸性環境中的催化能力,獲得組合突變體酶N34D/L484M,酶比活力達116.27 U/mg,比原始酶提高了76.30%。于封印等[17]首次在大腸桿菌中異源表達不動桿菌來源Asd,對其酶學性質進行分析,為工業生產L-丙氨酸提供參考。Asd 在德阿昆哈假單胞菌(Pseudomonas dacunhae)[18]、產氣莢膜梭菌(Clostridium perfringens)[19]、糞產堿菌(Alcaligenes faecalis)[20]、糞腸球菌(Enterococcus faecalis)[21]、小球諾卡氏菌(Nocardia globerula)[22]等微生物中均有存在,但由于產酶菌株產酶量低、酶活性低,難以實現規模化生產,因此,選育Asd 高產菌株、優化發酵條件和提高酶活力是酶轉化生產L-丙氨酸的關鍵。
本研究在前期通過菌種誘變選育出一株高產Asd的L-丙氨酸轉化菌,本文對其產酶條件進行優化,旨在為生物合成L-丙氨酸的工業化生產研究提供科學依據和技術基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株及培養基
睪丸酮叢毛單胞菌株HY-08D (CGMCC No.6083):煙臺恒源生物股份有限公司。
1.1.2 培養基
斜面及平板培養基:蛋白胨1%,酵母膏0.5%,牛肉膏0.5%,氯化鈉0.5%,瓊脂2%,pH 7.0~7.2。
液體培養基:玉米漿干粉0.8%,蛋白胨0.8%,磷酸二氫鉀0.15%,氯化鈉0.5%,硫酸鎂0.1%,pH 7.0~7.2。
1.1.3 試劑
酵母膏、牛肉膏、玉米漿、蛋白胨:北京奧博星生物技術有限公司;玉米漿干粉(生化試劑):山東康源生物科技有限公司;富馬酸(分析純):煙臺恒源生物有限公司;氯化鈉、硫酸鎂、磷酸二氫鉀、葡萄糖(均為分析純):國藥集團化學試劑有限公司。
1.2 儀器與設備
XNP-9052BS-III 生化培養箱、XL-YC 恒溫搖床:上海馨朗電子科技有限公司;722 型分光光度計:上海天普分析儀器有限公司;LDZX-75KBS 立式壓力蒸汽滅菌鍋:上海申安醫療器械廠;PY-P10 pH 計、BSA124S-C 電子分析天平:德國賽多利斯公司。
1.3 試驗方法
1.3.1 種子培養及發酵培養
種子培養:接一環生長良好的斜面種子至500 mL(裝液量50 mL)錐形瓶中,180 r/min,30 ℃,培養12 h~24 h。
搖瓶培養:將種子液按2%(體積分數)接種量轉接至500 mL(裝液量50 mL)錐形瓶中,180 r/min,培養12 h~24 h。
發酵罐培養:將種子液按0.1%~10%(體積分數)接種量轉接至發酵罐(裝液量70%)中,150 r/min,培養12 h~24 h。
1.3.2 菌株生長情況測定
發酵液稀釋10 倍,在640 nm 測定吸光度值,以OD640代表菌株生長情況。
1.3.3 酶活的測定
取25 mL 發酵液,加入1 g L-Asp,用0.l mol/L HCl調節pH 5.0,在37 ℃水浴搖床中振蕩30 min,微波爐加熱1 min,終止反應,利用紙層析法分析反應液中L-丙氨酸的含量,計算酶活。每小時催化消耗l μmol LAsp 的酶量定義為一個酶活單位(U)。
1.3.4 培養基組分及培養條件優化
1.3.4.1 碳源優化
基礎發酵培養基其余組分和培養條件不變的情況下,以1%的比例,分別添加富馬酸、L-Asp、谷氨酸和葡萄糖作為發酵產酶的碳源,以原始培養基為對照考察其對菌株HY-08D 生長及產酶的影響。通過L9(34)正交試驗設計對以上4 種碳源添加量進行優化。正交試驗設計因素與水平如表1 所示。

表1 菌株HY-08D 碳源正交試驗因素與水平Table 1 Factors and levels in orthogonal experiment ofcarbon sources by HY-08D strain
1.3.4.2 氮源、氯化鈉和pH 值優化
在優化碳源基礎上,控制其它條件不變,以0.8%的比例,分別添加玉米漿干粉、酵母粉和蛋白胨作為發酵的氮源,考察其對菌株HY-08D 生長及產酶的影響。通過正交試驗對2 種氮源添加量、氯化鈉添加量和pH 值的水平進行優化。正交試驗設計因素與水平如表2 所示。
1.3.4.3 擴培級數和接種量優化
采用三級擴培,一級采用搖瓶培養,二級采用2 m3發酵罐,二級培養液分別按0.1%、1.0%、5.0%和10%(體積分數)接種量轉接至20 m3發酵罐(裝液量為70%)中,150 r/min,30 ℃,培養24 h,每2 h 取樣測定OD640和酶活。
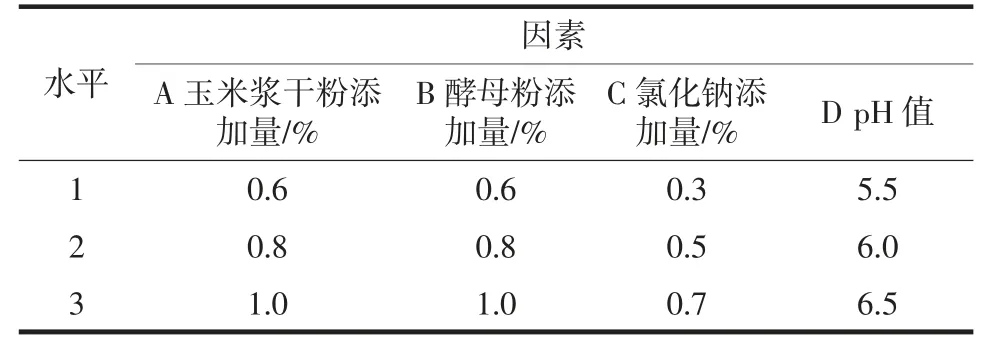
表2 菌株HY-08D 氮源、氯化鈉和pH 值正交試驗因素與水平Table 2 Factors and levels in orthogonal experiment of nitrogen sources,NaCl and pH by HY-08D strain
1.3.4.4 通氣量優化
按照優化后配方配制培養基,培養液按10%(體積分數)接種量轉接至50 L(裝液量42.5 L)發酵罐中培養,150 r/min,30 ℃,用氫氧化鈉調節初始pH 6.0,設置通氣量分別為6、8、10、12、14 L/min,考察其對菌株HY-08D 生長和產酶的影響。
1.4 統計學分析
正交試驗采用正交設計助手V3.1 軟件通過直觀分析對菌株HY-08D 培養基組分及培養條件進行優化,其它數據采用Origin8.1 軟件處理。
2 結果與分析
2.1 碳源優化
2.1.1 碳源種類對菌株HY-08D 生長及產酶的影響
碳源種類對菌株HY-08D 生長及產酶的影響見圖1。

圖1 碳源對菌株HY-08D 生長及產酶的影響Fig.1 Effect of carbon source on the growth and enzyme production by HY-08D strain
從圖1 可以看出,在添加量相同的條件下,選擇富馬酸、L-Asp、谷氨酸和葡萄糖作為碳源,OD640均有所增加,以谷氨酸為碳源時菌體生長最好,以L-Asp 為碳源時,酶活最高。
2.1.2 正交試驗結果
正交試驗結果見表3。

表3 菌株HY-08D 碳源添加正交試驗結果Table 3 Orthogonal test results of carbon sources addition by HY-08D strain
從表3 可以看出,影響菌株HY-08D 生長的因子順序為:谷氨酸添加量>L-Asp 添加量>葡萄糖添加量>富馬酸添加量,影響菌株HY-08 產酶的因子順序為:L-Asp 添加量>谷氨酸添加量>富馬酸添加量>葡萄糖添加量;結合k 值,適合菌株HY-08D 生長的最佳組合為A1B2C2D3;適合菌株HY-08D 產酶的最佳組合為A2B2C2D3。葡萄糖添加量對菌株產酶影響最小,不再考慮添加,而富馬酸添加量對菌株產酶的影響比其對生長的影響要大,綜合考慮,最佳碳源組合為A2B2C2,即富馬酸1%,L-Asp 1%,谷氨酸1%。在最佳碳源組合下進行驗證試驗,OD640達到0.536,酶活達到53 927 U/mL,均高于正交試驗中各試驗組,表明優化后碳源有利于菌株生長和產酶。
2.2 氮源、氯化鈉和pH 值優化結果
2.2.1 氮源種類對菌株HY-08D 生長及產酶的影響
氮源種類對菌株HY-08D 生長及產酶的影響見圖2。

圖2 氮源對菌株HY-08D 生長和產酶的影響Fig.2 Effect of nitrogen source on the growth and enzyme production by HY-08D strain
從圖2 可以看出,在添加量相同的條件下,單獨添加蛋白胨不利于菌株生長,酶活力較低;單獨添加玉米漿干粉和酵母粉,OD640和酶活相對較高,因此,針對兩者復合的添加量做了進一步分析以確定最佳配比。除了培養基組分外,適宜的初始pH 值也是十分重要的。Asd 進行脫羧反應時,酸性底物(如L-Asp)的加入會引起反應液pH 值升高,不利于菌株生長,導致酶活力下降甚至失活。
2.2.2 正交試驗結果
正交試驗結果見表4。
從表4 可以看出,影響菌株HY-08D 生長的因子順序為:pH 值>玉米漿干粉添加量>氯化鈉添加量>酵母粉添加量;影響菌株HY-08D 產酶的因子順序為:pH 值>氯化鈉添加量>酵母粉添加量>玉米漿干粉添加量。結合k 值,適合菌株HY-08D 生長的最佳組合為A1B1C1D2;適合菌株HY-08D 產酶的最佳組合為A3B2C3D2。玉米漿干粉添加量對菌株生長的影響比其對產酶的影響較大,而酵母粉和氯化鈉添加量對菌株產酶的影響比其對生長的影響較大,綜合考慮,最佳氮源、氯化鈉添加量及pH 值組合為A1B2C3D2,即玉米漿干粉0.6%,酵母粉0.8%,氯化鈉0.7%,pH 6.0。在最佳培養基組合下進行驗證試驗,OD640達到0.698,酶活達到54 837 U/mL,均高于正交試驗中各試驗組,表明優化后的培養基可以提高單位體積培養液中菌體濃度和酶活力。
2.3 擴培級數和接種量優化
不同接種量下菌株HY-08D 三級培養液的生長曲線和酶活曲線分別見圖3 和圖4。
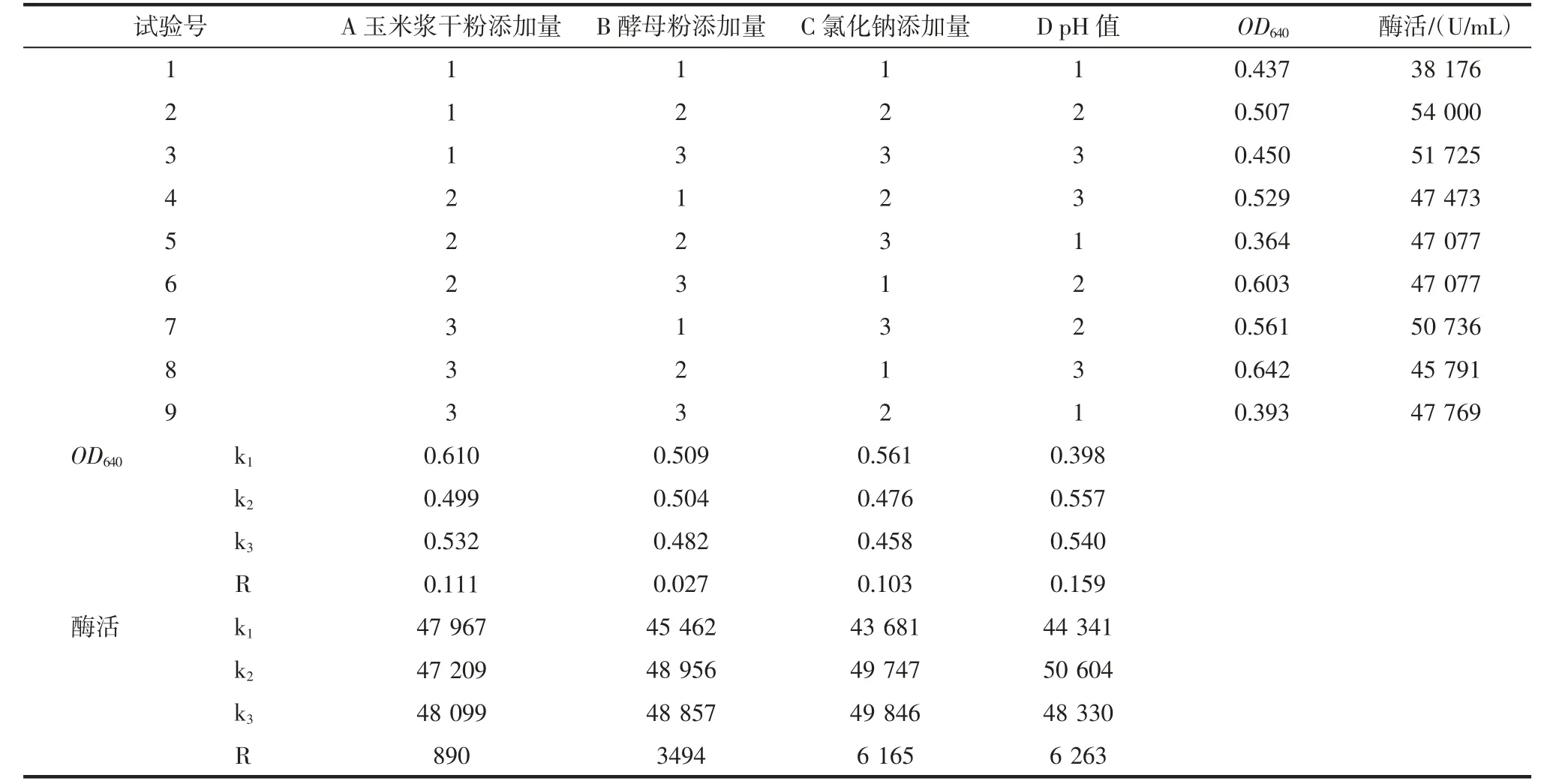
表4 菌株HY-08D 氮源、氯化鈉和pH 值的正交試驗結果Table 4 Orthogonal test results of nitrogen sources,NaCl and pH by HY-08D strain
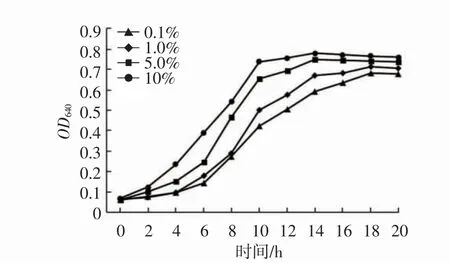
圖3 不同接種量下菌株HY-08D 三級培養液生長曲線Fig.3 The growth curve of the third stage culture solution by HY-08D strain
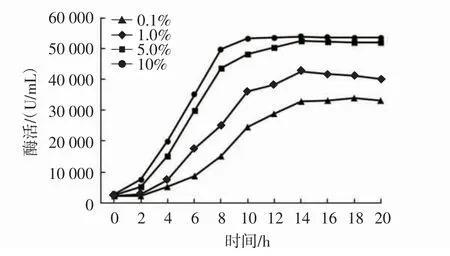
圖4 不同接種量下菌株HY-08D 三級培養液酶活曲線Fig.4 The enzyme activity curve of the third stage culture solution by HY-08D strain
微生物發酵種子培養通常采用逐級擴培的方式,但在實際生產中,為了降低接種過程染菌風險,通常采用二級或三級放大。目前,丙氨酸生產中,產酶菌株HY-08D 轉化用培養液采用二級培養,一級利用搖瓶培養,二級利用發酵罐培養,接種量只有0.1%,培養周期需要16 h~20 h。因此,本研究對擴培級數和接種量進行了優化,從圖3 和圖4 可以看出,增加接種量不僅可以縮短菌株生長周期,還可以提高單位發酵液中的Asd酶活。在整個培養階段,接種量為10%時,培養周期相較于二級擴培縮短了6 h~8 h,酶活提高了約1 倍。
2.4 通氣量優化
通氣量對菌株HY-08D 發酵過程的影響見表5。
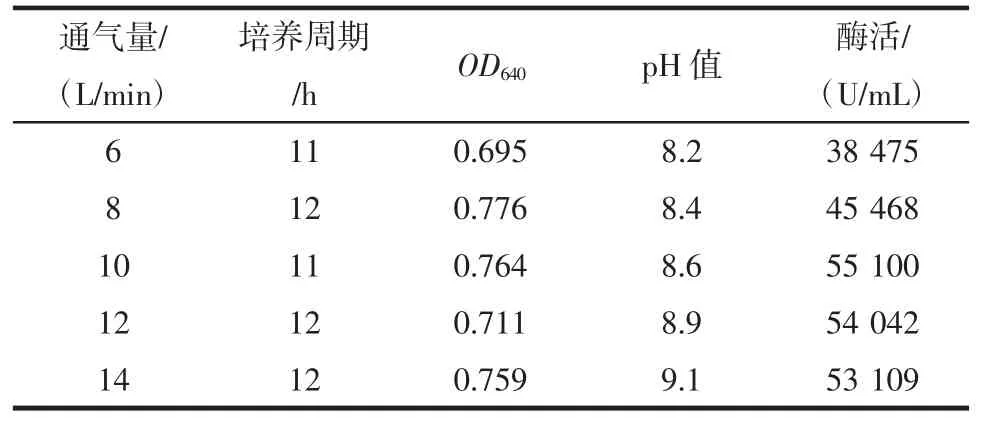
表5 通氣量對菌株HY-08D 發酵過程的影響Table 5 Effects of aeration on the fermentation of HY-08D strain
L-丙氨酸轉化菌是好氧菌,需通氣培養,通氣量主要影響培養液的溶氧,進而影響菌株生長代謝。從表5 可以看出,通氣量對菌株HY-08D 培養周期和OD 值影響不明顯,而對pH 值和酶活影響顯著。通氣量為10 L/min 時,酶活達到5.51×104U/mL,但繼續增加通氣量并不會提高酶活力。因此,菌株HY-08D 發酵過程中最適通氣量為10 L/min。
3 結論
本研究通過單因素及正交試驗對睪丸酮叢毛單胞菌HY-08D 培養基進行優化,獲得最佳培養基配方:富馬酸1.0%,L-Asp 1.0%,谷氨酸1.0%,玉米漿干粉0.6%,酵母粉0.8%,氯化鈉0.7%,磷酸二氫鉀0.15%,硫酸鎂0.1%,pH 6.0。通過轉接試驗,確定了菌株HY-08D 轉化液采用三級擴培,三級種子的最佳接種量為10%,發酵過程中最適通氣量為10 L/min。在上述最佳培養基及培養條件下,優化后培養液中HY-08D 菌體量和酶活較初始提高約1 倍,培養周期縮短6 h~8 h,為實現L-丙氨酸的高效轉化和產業化生產奠定了基礎。

