淋巴管平滑肌瘤病1例*
張 玉,李蘭雙,羅 梅
重慶市中醫院婦科,重慶 400021
淋巴管平滑肌瘤病(LAM)是一種由平滑肌細胞在淋巴系統、小血管或肺實質等部位病態增生引起的疾病,肺是LAM的主要受累器官,患者常因進行性呼吸困難、反復自發性氣胸、乳糜胸、咳嗽、胸痛等就醫被發現,肺外LAM主要發生在腎、肝、腹膜后、子宮、縱隔、頸部等。本病主要發生于育齡期女性,平均診斷年齡為35~40歲,偶發于男性和兒童。由于本病罕見且散發,漏診、誤診率高,確診時間周期長。現就1例淋巴管平滑肌瘤病報道如下。
1 臨床資料
患者,女,43歲,孕1產0,因“彩超發現右附件區囊腫6年,增大2年”于2018年12月10日入院。患者8年多前因“左卵巢漿液性乳頭狀囊腺瘤”于本院行經腹左側附件切除+大網膜部分切除術,術后建議化療,患者拒絕。之后間斷復查婦科彩超并隨訪,術后2年開始發現右側附件區囊腫,逐漸增大。隨訪期間患者無特殊不適,體質量無明顯變化,偶有咳嗽,無胸悶氣緊,無呼吸困難,無胸痛,既往有“慢性咽炎”病史10年,未予重視及處理。入院查體未見明顯異常。婦科檢查:右附件區捫及一直徑約10 cm大小囊性包塊,質軟,邊界清,位置固定,無壓痛,左附件區未捫及明顯異常。入院后查三大常規,肝、腎功能,甲狀腺功能,甲胎蛋白(AFP),癌胚抗原(CEA),糖類抗原(CA)199等未見明顯異常。CA125 142.8 U/mL。胸片顯示:雙肺野紋理增多(圖1)。盆腔磁共振成像(MRI)顯示:子宮右側單房囊性占位,囊腫可能,囊腺瘤不能除外(圖2)。婦科彩超顯示:右附件區有12.6 cm×11.30 cm×11.7 cm無回聲區,邊界清,形態規則,透聲好。
患者于12月13日在全身麻醉下行腹腔鏡探查術,術中見右側闊韌帶后葉與后腹膜移行處局部膨大約10 cm×7 cm×5 cm,呈囊性,質軟,張力小,位置固定。打開右側闊韌帶,分離腹膜后疏松結締組織,見囊腫壁與周圍結締組織界限欠清,剝離過程中囊壁破裂,流出乳白色囊液約600 mL,取少量囊壁送冰凍病理檢查,結果顯示上皮組織伴鈣化,局部增生活躍。剝離剩余囊腫過程中持續少量乳白色囊液產生,考慮可能的診斷為淋巴腫瘤或腹膜后腫瘤囊腫剝離困難,剝離大部分囊壁后結束手術,留置腹腔引流管。患者術后24 h開始感兩側胸脅疼痛,伴胸悶,血氧飽和度波動于80%~90%,血氣分析示動脈血二氧化碳分壓(PCO2)34 mm Hg,動脈血氧分壓(PO2)54 mm Hg,血氧飽和度89%。胸片提示雙肺少許感染灶,右側胸腔少量積液(圖3)。
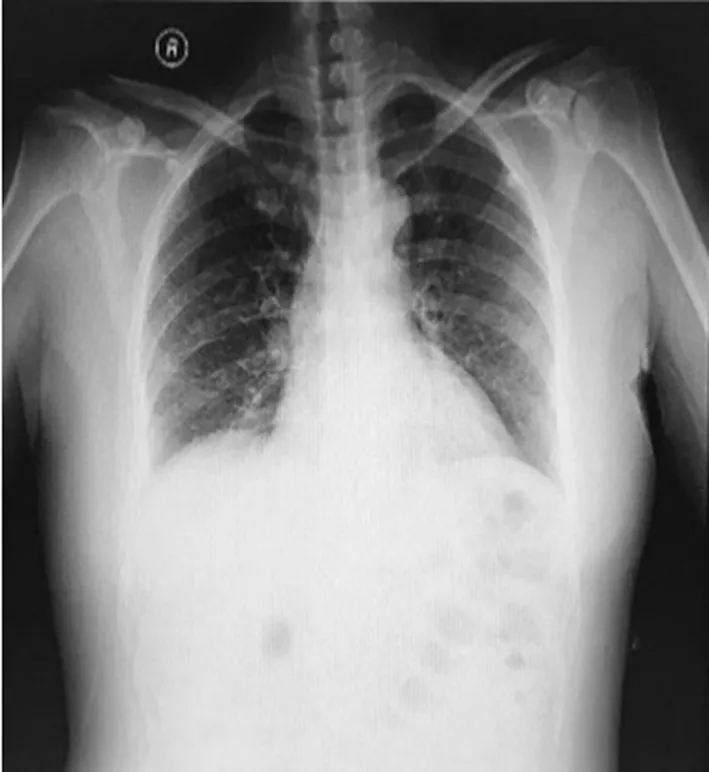
圖1 入院時胸片
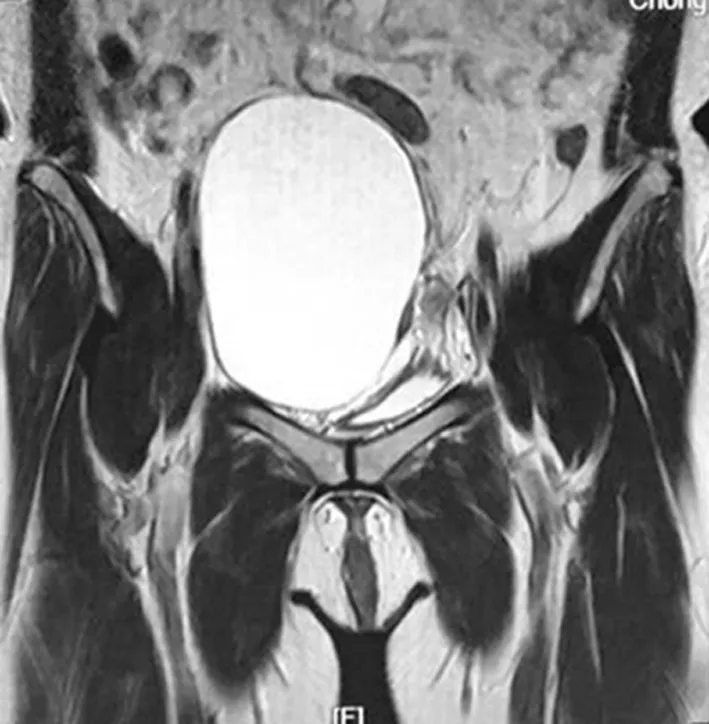
圖2 入院時盆腔MRI
考慮術后肺部感染、Ⅰ型呼吸衰竭,給予抗感染、吸氧等治療。術后4 d行胸部高分辨率CT(HRCT)提示:雙肺呈蜂窩狀改變,可見斑片狀密度增高影,增強掃描未見異常強化灶,雙側胸腔少量積液,考慮間質性肺炎(圖4)。繼續吸氧呼吸支持、抗感染治療,同時完善風濕免疫相關檢查[抗核抗體(ANA)、抗可溶性抗原(ENA)、補體C3/C4、抗雙鏈DNA(抗dsDNA)、紅細胞沉降率、風濕譜等]未見異常。術后每天引流出乳糜狀腹水600~1 200 mL,蛋白定性試驗陽性,考慮乳糜腹水,給予無脂飲食。術后10 d開始腹腔引流液逐漸減少(<500 mL/d),術后14 d拔除腹腔引流管。術后14 d石蠟病檢回示盆腔淋巴管平滑肌瘤伴苗勒氏上皮增生及鈣化。免疫組織化學示:人類黑色素瘤相關抗原(HMB45)陽性、α-平滑肌肌動蛋白(α-SMA)陽性、雌激素受體(ER)陽性、孕激素受體(PR)陽性、Wilms′腫瘤蛋白1(WT-1)陽性、波形蛋白(Vimentin)陽性、配對盒基因8(PAX-8)陽性、CA125陽性、D2-4陽性、CD31陽性。術后15 d復查胸部HRCT示:雙肺彌漫分布薄壁透光區,雙肺間質性改變,右側胸腔積液,右肺下葉輕度肺不張,結合臨床考慮肺淋巴管平滑肌瘤(圖5)。術后17 d行胸腔穿刺,抽出乳糜樣胸腔積液約450 mL。復查腹水彩超未見明顯積液。患者要求上級醫院就診,術后20 d出院。出院后隨訪,患者術后2個月于他院行腹膜后淋巴管橫斷結扎術+胸導管末端粘連松解術+左頸部淋巴管平滑肌瘤切除術,術后服用雷帕霉素1 mg/d。
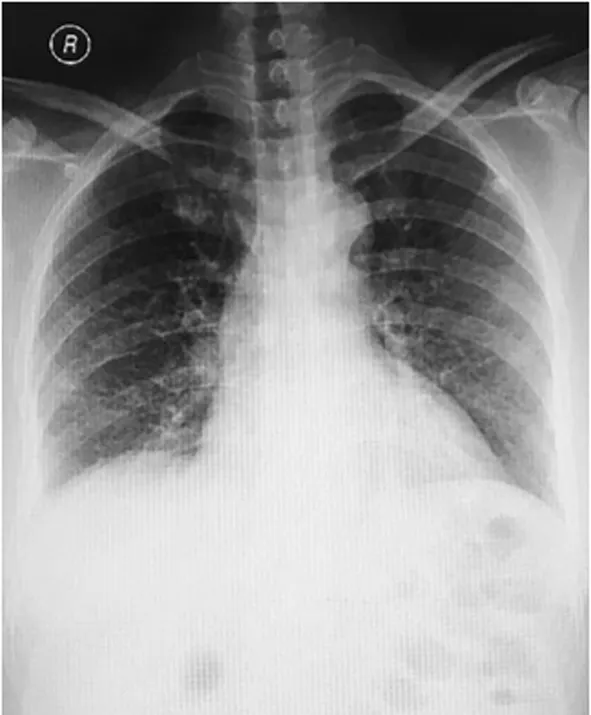
圖3 術后1 d胸片

圖4 術后4 d胸部HRCT
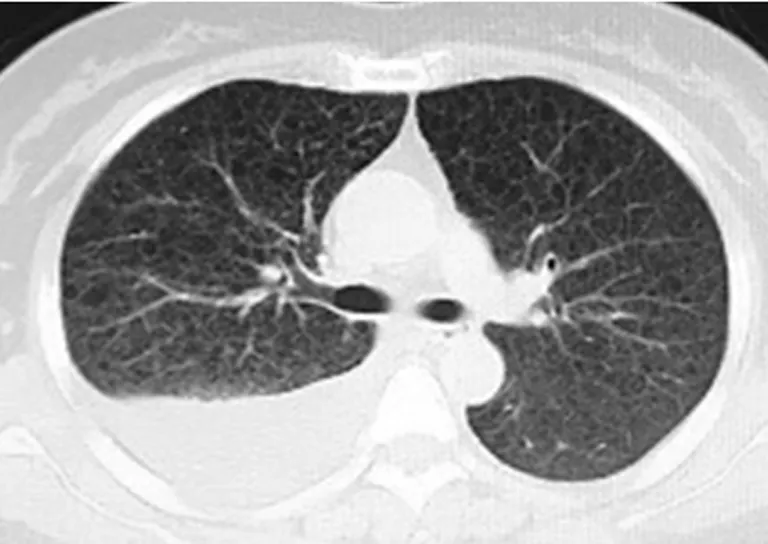
圖5 術后15 d胸部HRCT
2 討 論
LAM是與肺囊性病變、乳糜積液、腹部腫瘤相關的一種罕見的系統性、低度惡性腫瘤疾病,臨床分為散發性LAM(S-LAM)和結節硬化性LAM(TSC-LAM)。S-LAM指沒有結節性硬化病的LAM患者,在育齡期婦女中發病率為0.001‰~0.007‰,醫學界稱之為“孤兒肺病”,TSC-LAM指與結節性硬化病相關的LAM,約30%的TSC患者會出現LAM。LAM起病隱匿,早期可有活動耐力下降,但癥狀較輕、無特異性,隨著病情進展,逐漸出現反復自發性氣胸和(或)進行性呼吸困難,可伴咯血、乳糜性滲出及腎血管平滑肌脂瘤。肺LAM患者預后較差,自然病程8~10年,最終死于呼吸衰竭或頑固性乳糜積水引起的全身臟器衰竭。肺外LAM行局部切除后一般預后較好,但也有學者指出部分肺外LAM在發病1~2年后可發展為肺LAM。本例患者腹膜后LAM切除術后,肺LAM急性進展,考慮患者術前應同時存在肺部及腹膜后LAM,因術前未行胸部HRCT,未能發現肺部病變,手術創傷及應激可能加速肺LAM進展。
LAM的發病機制尚不完全明確,目前研究發現主要由TSC1/TSC2基因突變導致LAM細胞過度增殖所致。TSC1/TSC2復合體具有抑制哺乳類雷帕霉素靶蛋白(mTOR)的作用[1],如TSC1/TSC2復合體功能缺失,mTOR通路持續活化,則LAM細胞異常增生。如肺間質的LAM細胞不典型增生,則堵塞遠端小氣道及破壞肺泡結構,形成多發囊腔;如果LAM細胞堵塞或壓迫淋巴管,則形成乳糜性胸腔積液、腹水。本例患者腹膜后巨大乳糜囊腫切除術后出現乳糜性胸腔積液及肺不張,可能因全身麻醉氣管插管及術后肺部感染,肺間質水腫,加重LAM細胞對淋巴管的壓迫,導致乳糜性胸腔積液的快速形成,壓迫肺葉,形成肺不張。LAM幾乎只累及育齡期女性,在妊娠期、月經周期或應用外源性雌激素時病情進展加速,而絕經后病情進展變緩,考慮雌激素在LAM細胞的增生和轉移中可能也發揮作用。
LAM的診斷依靠病灶部位組織活檢、病史及胸部HRCT,胸片多無明顯異常,肺功能以阻塞性通氣功能障礙和彌散功能障礙常見。LAM患者HRCT的特征性改變為雙肺彌漫、大小不等的薄壁含氣囊腔,直徑為2~30 mm,大部分直徑<10 mm,囊壁厚度<2 mm,隨病情進展,部分囊腔可融合成肺大皰[2]。但需要與其他肺部多發囊性病變相鑒別(如肺氣腫、肺組織細胞增生癥、肺間質纖維化、囊狀支氣管擴張肺泡蛋白沉積癥等)。組織學診斷是LAM診斷的金標準,病理表現為不成熟的LAM細胞圍繞支氣管、血管、淋巴管廣泛增生,導致肺泡間距增寬、氣管狹窄或阻塞,肺泡破裂形成肺的囊性改變。免疫組織化學檢查可見α-SMA陽性、HMB45陽性、ER陽性及PR陽性。2010年歐洲呼吸學會(ERS)制定全球首個LAM診療指南[3],對LAM的診斷提出了統一標準,2016年美國胸科協會和日本呼吸學會(ATS/JRS)指南將血管內皮生長因子D(VEGF-D)納入診斷標準[4],血漿中VEGF-D水平>800 pg/mL對診斷肺LAM具有較高的靈敏度和特異度,可作為肺LAM的無創診斷手段[5]。
目前LAM尚缺乏有效的治療方法。因此鼓勵所有LAM患者保持正常體質量,避免吸煙,接種流感或肺炎疫苗,適度運動,避免外源性雌激素,謹慎妊娠。雷帕霉素為mTOR的特異性抑制劑,已被證實能夠穩定LAM患者肺功能,改善有癥狀的腹膜后淋巴管肌瘤及乳糜性積液。2015年美國食品藥品監督管理局(FDA)批準雷帕霉素用于治療LAM,我國推薦劑量1~2 mg/d,有效血藥濃度5~10 ng/mL[6]。亦有學者發現雷帕霉素濃度<5 ng/mL也可改善患者肺功能和乳糜胸[7]。目前有學者用抗細胞死亡蛋白1(PD-1)抗體治療TSC-LAM動物模型,取得了顯著療效[8],抗PD-1抗體有望成為治療LAM的潛在藥物。對于抗雌激素或孕激素治療LAM,國際報道效果不一,故目前指南不推薦使用。由于中醫藥在治療咳嗽、氣喘、胸腔積液等方面有一定的療效,可以在臨床中根據患者的個體因素辨證施治,如三子養親湯、二陳湯、葶藶大棗瀉肺湯等。在LAM患者首次發生氣胸時,推薦行胸膜固定術,可大大降低氣胸復發率[9]。對于終末期患者,肺移植是唯一有效手段。近年來國內外開展了較多肺LAM患者的肺移植手術,發現同時行雙肺移植的效果更好[10]。據美國心肺移植登記中心資料統計,肺移植后1年的生存率86%,3年生存率為76%,5年生存率為65%。
LAM雖為良性形態,但臨床進程呈惡性,可同時或先后累及全身多個器官,遠期預后極差,嚴重威脅年輕女性的生命健康,需要多學科醫生加強對這一罕見病的認識,以提高臨床確診率。

