慢性腎病患者血清Klotho,HE4,UMOD表達水平與疾病預后的相關性研究
趙智凝,武 易,劉 芳,何 瑩,楊 榮,景 濤(第四軍醫大學西京醫院檢驗病理科,西安 710054)
慢性腎病(chronic kidney disease,CKD)以腎臟結構、功能改變為主要特征,導致腎功能損害,全球發病率為8%~16%[1-2]。目前常采用腎小球濾過率(glomerular filtration rate,GFR)、尿清蛋白、肌酐作為評估腎功能的指標或者腎損傷標志物,但一些干擾因素會影響結果的穩定性和可靠性[1-3],如MISCHAK 等[4]研究發現采用血清肌酐水平評估患者腎功能狀態,超過50%患者肌酐水平處于正常狀態,因此仍需要尋找可靠、有效的腎損傷標志物來評估CKD患者疾病的發生發展情況。雖然有很多血清指標可反映CKD的腎損傷程度,但其臨床價值仍未得到充分確證,如Klotho 蛋白主要在腎臟生成和代謝,腎臟結構功能的改變均可影響Klotho的表達[5,6],人附睪蛋白4(human epididymis protein,HE4)可在人腎臟纖維化狀態中高表達,通過抑制蛋白酶而調節腎纖維化組織重塑過程[7],尿調節素(uromodulin,UMOD)作為T-H 糖蛋白,其水平變化與CKD 有關[8]。目前關于血清Klotho,HE4,UMOD表達水平與CKD的預后關系報道尚不多見,因此本文將通過實例進行探討,從而為臨床診治提供參考價值。
1 材料和方法
1.1 研究對象 選取我院2017年4月~2019年4月期間收治的120例CKD患者,CKD患者病程4~15年,其中男性72例,女性48例,年齡57.24±2.34歲,體質指數(BMI)22.05±2.27 kg/m2。選取同時段于我院體檢中心檢查健康者100例作為對照組,其中男性65例,女性35例,年齡56.81±2.27歲,體質指數(BMI)22.47±2.34 kg/m2,兩組患者入組前的性別、年齡、BMI比較差異均無統計學意義(χ2=0.580,P=0.446;t=1.376,P=0.170;t=1.347,P=0.179)。患者入組前均簽署知情同意書,且該研究已獲得倫理委員會批準。
納入標準:①腎小球濾過率(GFR)<60 ml/min,CKD 病史不低于6個月;②具備認知、讀寫能力,病歷資料完整,依從研究方案。
排除標準:①有免疫、血液、神經系統疾病;②急性腎損傷、腫瘤;③每日糖皮質激素用量超過10mg;④GFR<60 ml/min;⑤胃腸道、肺部、其他軟組織感染。
1.2 儀器與試劑 Klotho,HE4,UMOD檢測試劑盒購自美國默沙克生物;酶標儀采用賽默飛Varioskan LUX;電化學發光儀采用Roche E601。
1.3 方法 患者入組后,于隨訪前以及隨訪結束后清晨空腹抽取外周肘靜脈血約5 ml,3 000r/min 離心10min,取上層血清于-80℃凍存待用。采用賽默飛Varioskan LUX 酶標儀測定血清Klotho,HE4水平,采用羅氏E601 電化學發光儀檢測血清UMOD水平。所有步驟嚴格按照試劑盒操作說明書進行。以患者隨訪前血清水平均值為臨界值,分為高水平組、低水平組,比較不同組患者預后情況。
兩組患者均隨訪12個月,隨訪過程中均行常規排毒、降壓等對癥治療,隨訪前、結束后計算GFR值,計算所有患者GFR 下降幅度的均值,若超過均值則判為腎功能惡化,若低于均值則判為腎功能穩定[9]。若隨訪12個月內患者死亡,則提前終止隨訪,以死亡前的隨訪結果為最終結果,并判定為惡化。隨訪結束共有45例患者死亡,11例患者出現GFR 下降幅度超過均值。
1.4 統計學分析 采用SPSS 19.0 軟件分析所有數據,其中獨立樣本計量資料以均數±標準差(±s)表示,采用t檢驗,計數資料以[n(%)]表示,采用χ2檢驗。指標間相關性評估采用Pearson 相關性分析,用KaplanMeier 生存分析血清因子與預后的關系,以P<0.05為差異有統計學意義。
2 結果
2.1 研究組和對照組血清Klotho,HE4,UMOD以及GFR水平 見表1。研究組血清Klotho,GFR和UMOD 顯著低于對照組,HE4水平顯著高于對照組,差異均有統計學意義(P<0.001)。
表1 研究組和對照組血清Klotho,HE4,UMOD 以及GFR水平比較(±s)
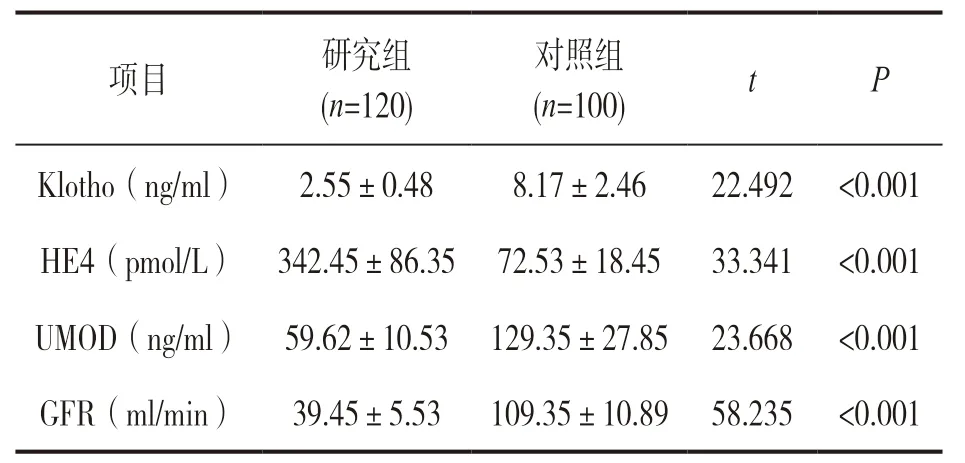
表1 研究組和對照組血清Klotho,HE4,UMOD 以及GFR水平比較(±s)
項目 研究組(n=120)對照組(n=100) t P Klotho(ng/ml) 2.55±0.48 8.17±2.46 22.492 <0.001 HE4(pmol/L) 342.45±86.35 72.53±18.45 33.341 <0.001 UMOD(ng/ml) 59.62±10.53 129.35±27.85 23.668 <0.001 GFR(ml/min) 39.45±5.53 109.35±10.89 58.235 <0.001
2.2 血清Klotho,HE4,UMOD 與GFR的關系 對患者血清Klotho,HE4,UMOD 與GFR 進行Pearson 相關性分析,結果顯示Klotho,UMOD 與GFR呈正相關性,r=0.682,0.582,HE4與GFR呈負相關性,r=0.627,均P<0.001。
2.3 惡性組、穩定組患者血清Klotho,HE4,UMOD變化程度 見表2。隨訪結束時血清Klotho,UMOD水平明顯低于隨訪前,HE4水平明顯高于隨訪前,惡性組患者的變化幅度均明顯高于穩定組患者,差異均有統計學意義(均P<0.001)。
2.4 不同血清水平患者的預后情況比較 見表3。隨訪12個月死亡45例(37.50%),不同血清因子水平組患者死亡率統計學差異顯著。Kaplan-Meier曲線發現高Klotho,UMOD水平組不良腎臟預后風險低于低Klotho,UMOD水平組,高HE4水平組不良腎臟預后風險高于低HE4水平組,見圖1~3。
表2 惡性組、穩定組患者血清Klotho,HE4,UMOD 變化程度比較(±s)
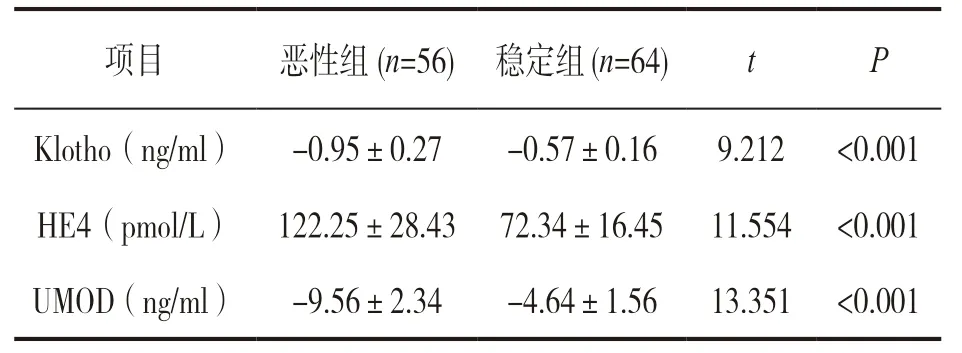
表2 惡性組、穩定組患者血清Klotho,HE4,UMOD 變化程度比較(±s)
項目 惡性組(n=56) 穩定組(n=64) t P Klotho(ng/ml)-0.95±0.27-0.57±0.16 9.212 <0.001 HE4(pmol/L) 122.25±28.43 72.34±16.45 11.554 <0.001 UMOD(ng/ml)-9.56±2.34-4.64±1.56 13.351 <0.001
表3 血清Klotho,HE4,UMOD水平與患者預后情況比較(±s)

表3 血清Klotho,HE4,UMOD水平與患者預后情況比較(±s)
血清因子組別 n 生存 死亡 χ2 P Klotho 高水平 63 45 18 4.511 0.034低水平 57 30 27 HE4 高水平 66 36 30 3.960 0.047低水平 54 39 15 UMOD 高水平 62 46 16 7.484 0.006低水平 58 29 29

圖1 Kaplan-Meiser曲線分析不同Klotho表達水平與患者預后的關系

圖2 Kaplan-Meiser曲線分析不同HE4表達水平與患者預后的關系
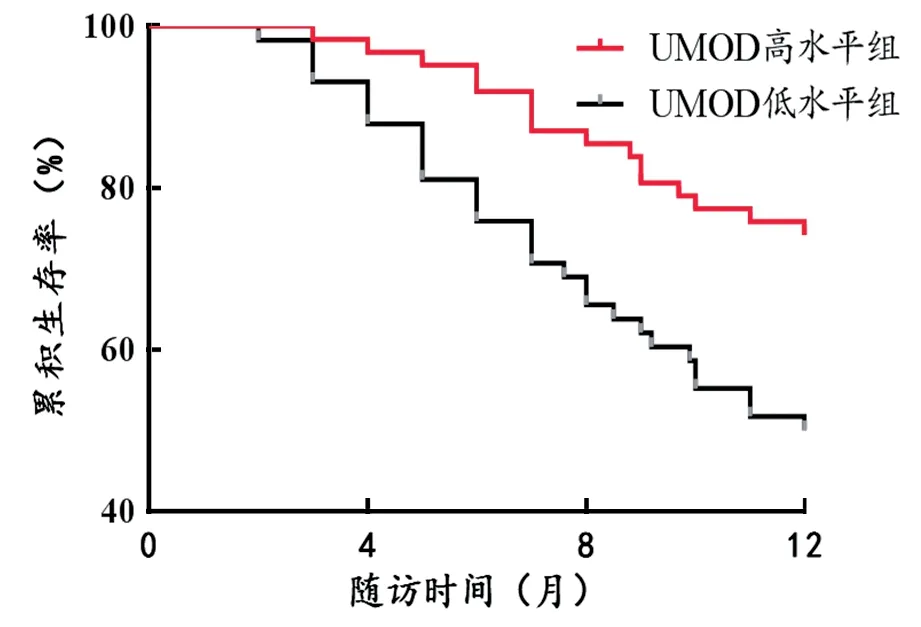
圖3 Kaplan-Meiser曲線分析不同UMOD表達水平與患者預后的關系
3 討論
隨著人口老齡化以及生活習慣的改變,CKD 已成為臨床常見病、多發病,我國CKD患病率約為10.8%,其中64歲以上人群發病率23.4%~35.8%[3]。目前尚無有效的防治手段,因此早發現、早干預以及預后評估對于提高CKD的存活率至關重要,同時開展針對預后的生物標志物研究尤為迫切。2012年全球改善腎臟病預后組織指南推薦通過計算GFR評估腎功能,但越來越多研究發現脂質代謝異常、貧血、腦卒中、冠心病、衰老等均可降低GFR,從而影響評估準確性,造成假陽性結果[10-11]。Klotho是近年來發現的腎臟保護因子,其血清水平的降低與腎臟損傷的程度密切關聯。此外,分子遺傳學檢查發現UMOD 基因突變可導致合成后的尿調節素多肽鏈失去正確的折疊能力,沉積在內質網,無法合成具有調節功能的尿調節素,同時尿調節素異常沉積可加速腎小管細胞凋亡,導致腎單位喪失和引起腎衰竭[12]。HE4是WAP-4 二硫化物核心結構域2 基因編碼的產物,可通過編碼絲氨酸蛋白激酶抑制劑而抑制腎臟纖維化,延緩CKD 進展[13]。本次研究發現研究組患者血清Klotho,GFR,UMOD顯著低于對照組,且通過Pearson 相關性分析顯示Klotho,UMOD 與GFR 呈正相關性,HE4 與GFR呈負相關性,表明Klotho,GFR,UMOD 均可評估CKD患者腎功能狀態。楊曉霞等[14]研究發現外周血中HE4水平可隨著CKD患者腎功能的下降而上升,且與GFR 呈負相關性,與本次研究結果相近,表明HE4 可能作為CKD 進展的血清生物學標志物,用于預測CKD患者的預后情況。QIAN 等[15]研究發現CKD患者的血清Klotho 下降幅度越大,患者腎功能狀態越差,則隨訪期間腎臟替代治療風險越高,這與本研究結果一致。Klotho的降低可導致氧化應激、炎性反應以及凋亡等因素損傷腎臟功能,加重疾病進展[16],血清Klotho水平降低幅度與腎功能的惡化程度相關,故而惡化組患者下降幅度明顯高于穩定組患者。
本研究中120例受試者隨訪12個月后死亡45例(37.50%),且通過Kaplan-Meier曲線分析發現低Klotho,UMOD水平或者高HE4水平患者的預后較差,死亡風險較高,正如李莎莎等[16]報道認為血清Klotho的降低不僅僅與腎臟損傷程度關聯,同時通過長時間隨訪發現其可增加CKD患者進展至終末期腎臟病風險和死亡風險。Klotho 功能多樣,可通過自分泌或旁分泌的方式作用于腎臟,從而發揮抗炎、抗氧化以及抑制腎臟器官纖維化的作用,如Klotho 可抑制腎臟上皮細胞-間充質細胞轉分化引起的腎間質纖維化,以及抑制組織內質網應激介導的遠端小管上皮細胞凋亡。LIU 等[17]研究發現Klotho 通過調控核因子κB 通路抑制炎性反應,從而干擾轉化生長因子β1,Wnt 信號通路,抑制腎間質纖維化,發揮腎臟保護作用。UMOD 廣泛存在于尿液中,具有抗菌作用[18]。高UMOD 排泄導致機體血清水平較低,可激活機體免疫功能,或者大量進入組織間質后,特別是受損傷的腎小管,與嗜中性白細胞結合而促進IL-8的合成,可誘導單核細胞分泌IL-1β,TNF-α,可增加淋巴細胞表面IL-2 受體與HLA Ⅱ類分子的表達等,從而導致炎癥反應,引起慢性腎病的惡化,影響CKD患者的預后[19]。楊麗霞等[14,20]認為HE4是α 平滑肌動蛋白的靶點,可在腎臟肌肉成纖維細胞中大量表達,在各種CKD患者血清中處于高表達狀態,且與腎間質纖維化正相關。HE4 可抑制金屬基質蛋白酶、絲氨酸蛋白酶等激酶活性,從而抑制膠原蛋白I的降解,使得I型膠原蛋白大量沉積于腎臟,從而引起腎臟纖維化,加速CKD 進展和腎功能的惡化,故而本次研究發現血清低HE4水平患者死亡風險更高。血清學標志物應用于臨床仍存在一定局限性,容易受到多種因素的干擾(炎癥、氧化應激、高磷血癥等),同時腎臟以外的其他器官也可分泌血清因子,如血管、腦組織、甲狀旁腺等組織器官可分泌Klotho,因此在實際腎臟功能以及預后評估過程中需結合多種指標共同檢測,從而提高評估效能。
綜上所述,Klotho,HE4,UMOD 均在慢性腎病患者血清中異常表達,其中血清Klotho,UMOD水平降低以及HE4水平增加可增加腎功能惡化風險,三種血清因子可為預后評估提供參考價值。

