血小板在抵御細菌感染和增強免疫中的地位
易觀群 綜述,謝雙鋒,馬麗萍 審校
(中山大學孫逸仙紀念醫院血液內科,廣東 廣州 510120)
很多無脊柱動物和早期脊柱動物有一種血細胞同時具有止血和免疫防御功能。在哺乳動物的進化過程中,細胞類型及其功能變得更加特異,如血小板、白細胞、淋巴細胞分別執行止血、炎癥、免疫調節功能[1]。作為止血細胞的血小板,長期以來人們關注更多的是其與出血、血栓性疾病的關系,在其他領域的研究進展不多。盡管在1901年Levaditi就發現霍亂弧菌引起血小板聚集的現象,并提出血小板與細菌直接接觸的相關觀點[2],但一直以來的研究似乎更多集中在細菌如何激活血小板并誘發血栓。直到1997年,Yeaman 等[3]再次提出和證實血小板仍保留免疫效應細胞的關鍵結構和免疫防御功能,有關血小板作為細菌感染的“第一哨兵”理論才再次受到重視。隨之,使用富血小板血漿(platelet-rich plasma,PRP)或血小板衍生物抗細菌感染開始成為近些年新興的研究方向。體外研究證實,PRP對金黃色葡萄球菌、耐甲氧西林金黃色葡萄球菌、耐萬古霉素腸球菌以及肺炎克雷伯菌和銅綠假單胞菌的生長均有明顯的抑制作用[4-5],提示PRP逐漸成為預防術后切口感染、治療慢性傷口或骨感染的有效補充治療。PRP與抗菌藥物具有協同作用,尤其在抗菌藥物耐藥時具有獨特優勢[6-7]。復發性細菌膀胱炎患者膀胱內灌注PRP,能明顯降低1年內膀胱炎復發率[8]。可見血小板抵御細菌的地位逐漸得到認可,本文就血小板如何有效抵御細菌的研究進行綜述。
1 血小板的特點
血小板是由巨核細胞產生的無核細胞,在外周循環中壽命約為10 d,在此期間大部分以靜息的狀態存在[1]。雖然血小板無核,但具有巨核細胞殘余mRNA,可獨立合成蛋白質[9]。血小板還包含許多獨特的結構元素,如細胞質膜及其表面的各種分子受體,膜內陷形成的開放微管系統(open canalicular system,OCS)以及細胞顆粒,包括致密顆粒、α顆粒和溶酶體顆粒等[10-11],其中血小板受體和儲存在血小板顆粒中的分子很大程度控制著血小板的功能。
血小板表面含有大量的糖蛋白,這些糖蛋白不僅參與血栓的形成和止血,還參與機體的炎癥反應。當血小板被激活,部分受體通過脫落、質膜與顆粒的融合表達下調或上調[12-13]。血小板胞內儲存三種顆粒,分別為α顆粒、致密顆粒和溶酶體顆粒[14](見表1),有學者提出還有一種潛在的T顆粒[15]。 α顆粒的數量最多(80個/血小板),體積最大(直徑200~500 nm),包含約有300種活性蛋白,包括殺微生物蛋白(platelet microbicidal protein,PMP),大量趨化因子如CXCL4、CXCL7及衍生物、RANTES(CCL5)等,在血小板黏附、凝血、止血、卒中后血栓炎癥、創面愈合、腫瘤生長、血管生成和抗微生物宿主防御等不同過程發揮作用[16]。相對于α顆粒,致密顆粒的數量和體積都較少/小(3~9個/血小板,直徑250 nm),貯存二磷酸腺苷(ADP)、三磷酸腺苷(ATP)、無機磷酸鹽、磷酸鹽、組胺、血清素、鈣離子等。ADP是一種較弱的血小板激動劑,可引起血小板形狀改變、顆粒釋放和聚集[17]。溶酶體顆粒含有蛋白酶、糖苷酶和具有殺菌活性的陽離子蛋白,協助降解細菌蛋白[18]。
2 血小板抵御細菌感染的機制
組織、黏膜受損或靜脈導管置入,是引起病原菌入侵血流最常見的途徑。血小板是血流中數量最多的細胞之一,細胞表面具有多種病原體識別受體,能快速識別病原菌[1]。細菌與血小板的直接結合,血小板與受損處內皮下膠原的結合,還有受損內皮啟動凝血途徑生成的凝血酶,均能活化血小板,進一步引起血小板變形和脫顆粒,發揮抵御細菌感染的功能。
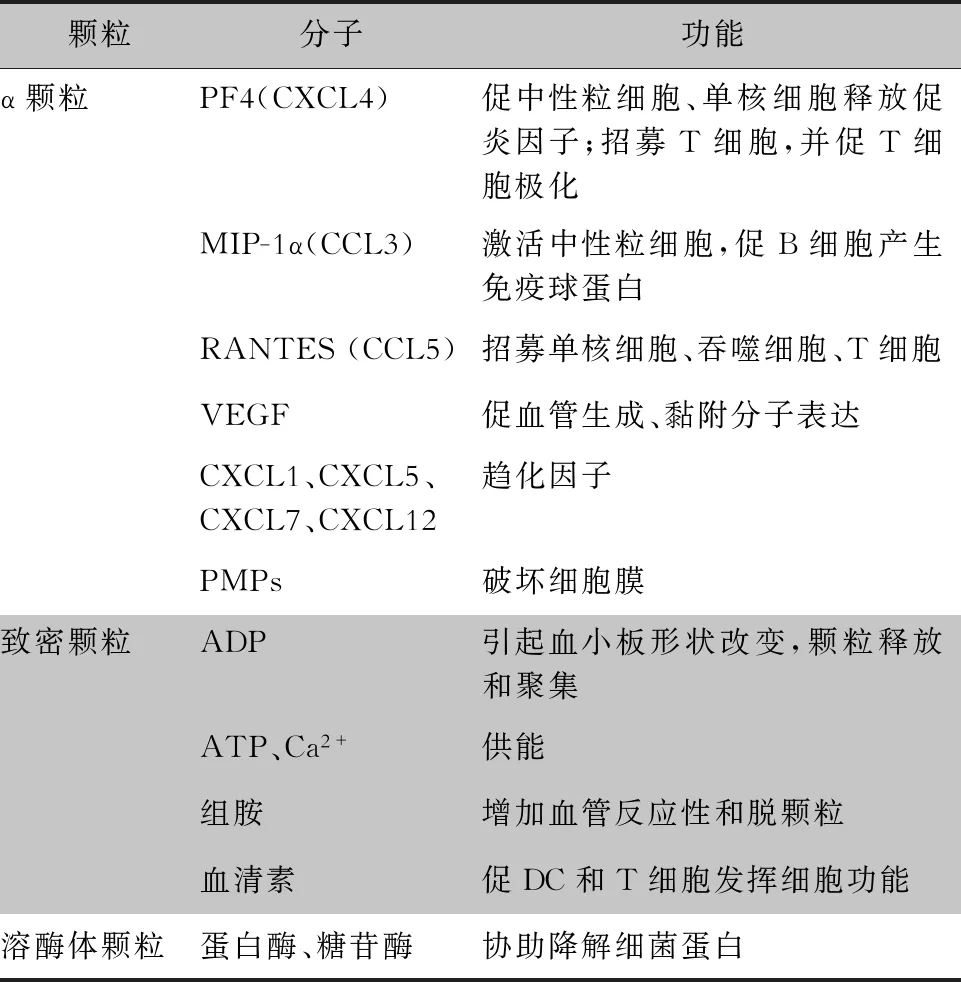
表1 血小板來源的分子及其免疫功能
2.1 血小板識別并結合細菌 血小板與細菌一旦結合,最終都引起血小板活化,部分引起血小板聚集,從而使血小板表面的病原體模式相關受體表達增多和親和力增強,正反饋刺激血小板迅速識別并結合更多的細菌。血小板與細菌的結合有以下三種形式[19]:①細菌釋放產物接觸或結合到血小板。感染的細菌釋放一系列細菌毒素等產物,通過直接接觸或改變血小板膜結構,活化血小板。如金黃色葡萄球菌釋放的α毒素可結合到血小板的磷脂雙分子層,擴大和形成跨膜孔,使大量Ca2+內流,引起血小板活化[20];牙齦卟啉單胞菌產生的半胱氨酸蛋白可引起血小板胞內Ca2+增多,促使血小板迅速聚集[21]。②細菌直接與血小板的受體結合。血小板表面與細菌識別相關的受體有GPIb、GPIIb/IIIa、TLR2、TLR4、gC1qR、FcγRIIa等。部分細菌蛋白可以識別或直接結合到血小板膜上的上述受體,如血液中鏈球菌富絲氨酸蛋白A(SrpA)可結合血小板GPIb,表皮葡萄球菌SdrG可結合GPIIb/IIIa,肺炎鏈球菌脂肽與B族鏈球菌可結合TLR2,大腸埃希菌的脂多糖(LPS)可結合TLR4等[13, 22-24]。 ③血漿蛋白作為血小板和細菌結合的橋梁。作為血小板與細菌結合的連接橋梁, 研究最多的是vWF和纖維蛋白原。如葡萄球菌通過vWF結合血小板GPIb,葡萄球菌凝聚因子A(ClfA)通過纖維蛋白原結合血小板GPIIb/IIIa[23]。見圖1。
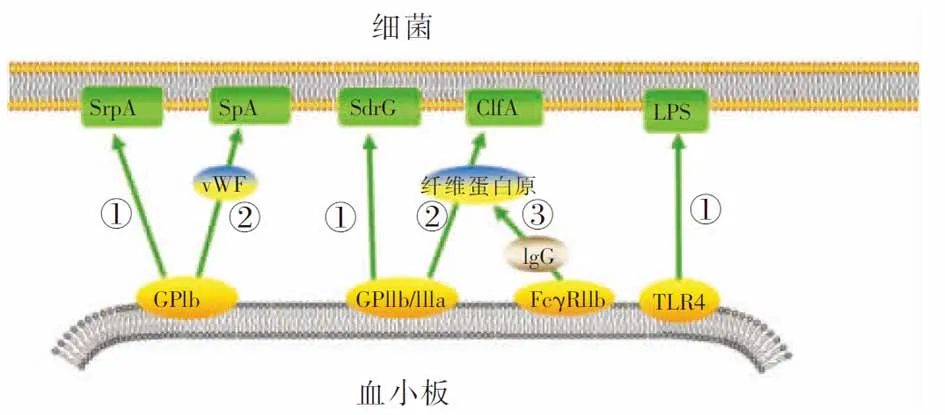
注:①血小板與細菌直接結合;②血小板通過vWF或纖維蛋白原與細菌間接結合;③血小板的FcγRIIa首先與IgG的Fc段結合,再通過纖維蛋白原與細菌間接結合。圖1 血小板糖蛋白與細菌表面蛋白相互作用示意圖
2.2 血小板內吞細菌 血小板一旦與細菌結合,就會發生一系列自身結構和功能變化,包括變形、捆綁、內吞、吞噬,最后殺滅細菌。早在1980年Clawson等[25]發現血小板可以內吞金黃色葡萄球菌到OCS。Youssefian等[26]進一步研究并證實內吞細菌過程:首先是血小板伸出偽足將細菌包圍,隨后血小板質膜內陷,形成內吞泡。內吞泡可與OCS膜融合,使包含細菌的內吞泡位于OCS中。然而內吞泡中的細菌能否被殺滅,并不是很清楚。White等[27]研究認為,血小板能內吞金黃色葡萄球菌到OCS,但不能殺滅細菌,因為血小板不具有髓過氧化物酶等吞噬酶。也有學者認為血小板α顆粒能與內吞泡融合,并釋放顆粒內容物如PMPs,可與內吞泡中的細菌相互作用[26],有可能殺滅內吞泡中的細菌。Trier等在體外對血小板和細菌進行混合培養,發現血小板的數目決定了其自身的殺菌能力,當血小板數目遠高于金黃色葡萄球菌數量時(1 000倍),可殺滅95%的胞外細菌[28],而單個血小板是無法殺滅細菌的。如果不能有效殺菌,那內化到血小板OCS的金黃色葡萄球菌是否會成為病原體逃逸免疫系統的一種方式,甚至成為細菌的“庇護所”值得進一步研究。
然而,并非所有細菌和血小板都存在上述內化作用。已有研究證明血小板可捆綁大腸埃希菌(包括結合及不結合IgG),但只能內吞并殺滅已與IgG結合的大腸埃希菌,機制是血小板FcγRIIa(即IgG受體)和肌動蛋白重排介導血小板對已結合IgG的大腸埃希菌進行吞噬和殺滅,該殺滅機制與活性氧代謝產物無關[29],說明血小板FcγRIIa在殺滅內吞泡細菌機制中起著關鍵作用。
2.3 血小板釋放PMPs直接殺滅細菌 當血小板被入侵的細菌激活后,血小板即脫顆粒,釋放出PMPs、趨化因子、活性氧和過氧化氫等直接殺滅細菌。PMPs是一種小的陽離子多肽,通過電壓依賴性通道直接破壞病原體的細胞膜,導致細胞膜的動能障礙、滲透性改變[30],從而殺滅細菌。體外研究[31]證明,PMPs的C端(即羧基端)螺旋結構域具有殺菌活性,而N端具有趨化基序(趨化性);正是這種結構允許這些蛋白的修飾和改變,因此也確保了PMPs蛋白水解后仍具有殺菌活性。
3 血小板增強固有免疫
機體感染時,血小板最先到感染前線,一旦識別并與細菌結合,除內吞作用,血小板由光滑圓盤狀變成多刺的球形,細胞表面伸出指狀、絲狀偽足,能有效捆綁細菌并提呈給中性粒細胞和其他吞噬細胞[32](見圖3),使上述細胞趨化到感染灶。同時也激活補體系統發揮固有免疫作用。
3.1 血小板協同中性粒細胞抗菌 血小板通過表面受體和釋放趨化因子,趨化并募集中性粒細胞到感染灶。同時,活化的血小板還可促進中性粒細胞釋放活性氧和形成胞外誘捕網(neutrophil extracellular trap,NET),不僅高效誘捕細菌,增強吞噬功能,還能引起“細胞呼吸爆發”殺滅細菌。
3.1.1 血小板激活并招募中性粒細胞 ① 血小板主要通過表面受體和分子與中性粒細胞相互作用(見圖2),包括血小板CD62P可結合中性粒細胞P選擇素糖蛋白配體1(PSGL-1),血小板GPIb可結合中性粒細胞的整合素αMβ2,以及血小板GPIIb/IIIa通過纖維蛋白原間接結合整合素αMβ2[33-34]。② 活化血小板釋放CD40L可上調中性粒細胞整合素的表達,釋放血清素趨化中性粒細胞募集到炎癥處[35-36]。 ③ 當血管損傷時,因無完整的內皮常導致中性粒細胞募集所需的黏附分子缺失。此種情況下,血小板GPIb-IX-V復合體和GPVI通過血漿蛋白vWF黏附到內皮下的膠原;一旦黏附,血小板表達大量P選擇素,為中性粒細胞PSGL-1提供結合位點[37],此時中性粒細胞的其他分子也可以結合到血小板的其他受體或分子,從而使中性粒細胞有效募集到血管損傷處。因此,在缺乏或僅有少量黏附分子情況下,血小板可充當中性粒細胞募集的“著陸點”,甚至擴大中性粒細胞趨化的信號。
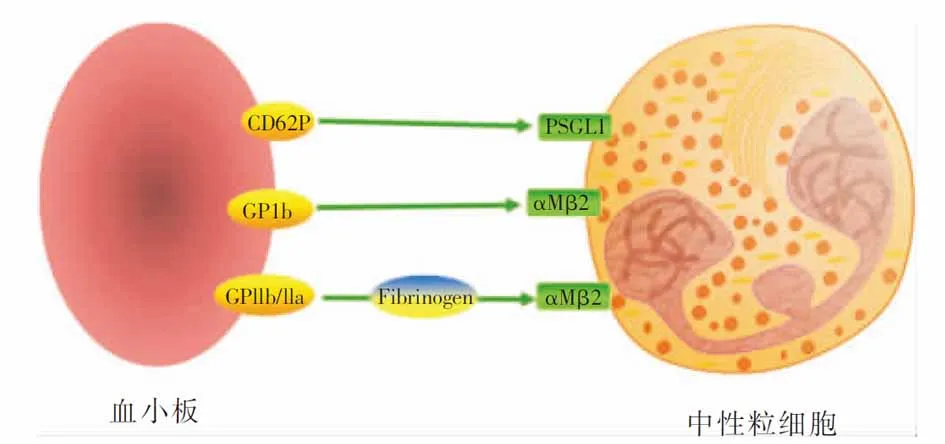
圖2 中性粒細胞黏附分子與血小板黏附分子間相互作用示意圖
3.1.2 血小板在中性粒細胞抗菌活性中的作用 ①釋放活性氧。中性粒細胞的主要功能是產生和釋放活性氧(reactive oxygen species,ROS),ROS對細胞毒性較大,能殺滅病原體[38]。血小板與中性粒細胞的結合能大大增加ROS的生成效率,由于過程的耗氧量激增,因此該過程又稱為細胞呼吸爆發[39]。②吞噬作用。在中性粒細胞吞噬牙周病原體(放線菌、牙齦卟啉單胞菌)的研究中發現,中性粒細胞的吞噬效率依賴于血小板與中性粒細胞復合物的形成; 20 min內,活化的血小板介導中性粒細胞的吞噬細菌效率約增加20%[40]。因此,血小板可大大增強中性粒細胞的吞噬功能。 ③NETs的形成。NETs由中性粒細胞釋放的染色質、蛋白水解酶和其他抗菌分子組成,可以誘捕并直接殺滅細菌[41-42]。盡管這個誘捕網的產生使中性粒細胞失去細胞核,但細胞仍具有血管內爬行和轉位等功能[43];正是保留了這些細胞運動功能,更利于NETs對細菌的捕獲和清除。體外研究表明,在血小板激動劑(ADP、膠原、凝血酶、花生四烯酸、TLR配體)存在時,可觀察到血小板驅動NETs的形成(見圖3);缺乏這些血小板激動劑時,NETs則不能形成[44],因此,激活的血小板是體外NETs形成的必要條件。但體內血小板的活化是否也是NETs形成的先決條件,尚不清楚。
3.2 血小板協同庫普弗細胞吞噬細菌 血小板作為免疫哨兵巡邏于血管中[45]。肝活體成像顯示:無菌狀態時,在肝血管竇內的血小板GPIb與庫普弗細胞表面vWF短暫結合,在循環中形成短暫的 “接觸-移動”交替(短于1 s);當細菌侵入肝血管時,庫普弗細胞就會迅速捕獲細菌,并迅速觸發血小板由“接觸-移動”的短暫黏附狀態轉換為血小板GPIIb/IIIa與庫普弗細胞表面vWF結合的持續牢固黏附狀態,從而使大量血小板迅速將這些細菌包圍起來,形成血小板聚集圈[46](見圖3)。這種血小板聚集圈,既可直接中和細菌[45],也可防止細菌逃離庫普弗細胞,進一步增強巨噬細胞的吞噬作用。此似乎是肝臟的一種監視機制,即血小板通過“接觸-移動”交替監視血管內巨噬細胞的活動,因在不含巨噬細胞的大腦、肌肉、皮膚、耳等組織內很少看到血小板的這種短暫交替活動[46]。CD40L是吞噬細胞的一種重要激活劑,能增強吞噬細胞的吞噬功能;而循環中大部分的CD40L由活化的血小板分泌[47],因此,活化的血小板可增強吞噬細胞吞噬細菌,協同發揮機體的固有免疫。
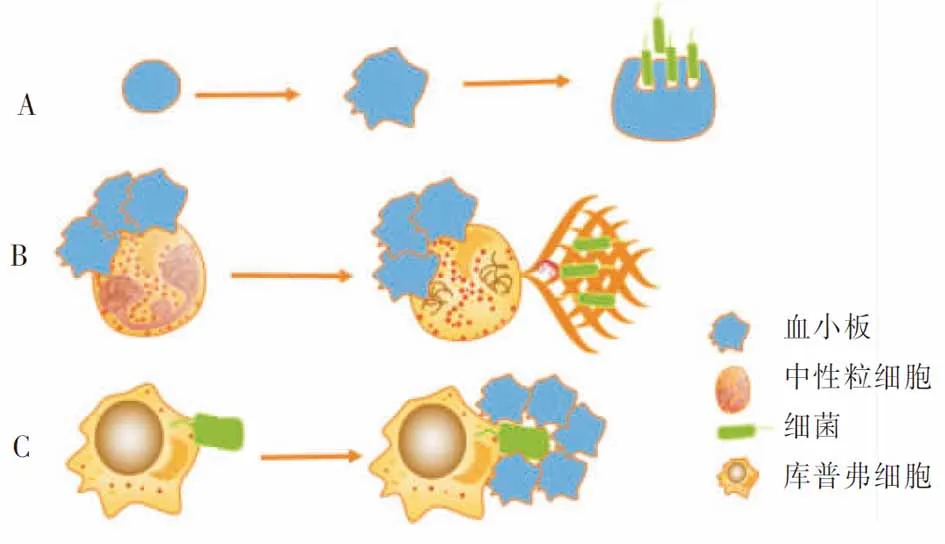
注:A為血小板活化后,血小板變形伸出偽足,捆綁細菌,并將細菌提呈中性粒細胞或吞噬細胞進行吞噬;B為活化的血小板與中性粒細胞結合后,促NETs的形成,NETs有效地誘捕細菌,并殺滅細菌;C為細菌侵入血流后,庫普弗細胞捕獲細菌,隨后血小板迅速在庫普弗細胞的周圍將細菌包圍起來。
3.3 血小板增強補體的免疫效應 補體(complement,C)是固有免疫系統的重要組成部分,血漿中的補體多以非活化形式存在,只有在被激活后才有生物學功能。活化的血小板表達部分補體受體及其他分子,結合補體,并可通過啟動經典途徑或旁路途徑激活補體,促補體發揮抗菌作用。
3.3.1 血小板通過經典途徑激活補體 補體C1通常以C1q(C1r)2(C1s)2復合大分子形式存在血漿中。研究表明,活化血小板表達的補體受體gC1qR可結合并激活C1q,進而激活補體C4(即啟動經典途徑激活補體)。另外血小板分泌的硫酸軟骨素,通過結合C1q,同樣也啟動經典途徑活化補體[48]。見圖4。
3.3.2 血小板通過旁路途徑激活補體 旁路途徑是從補體C3開始,C3可被C3轉化酶裂解為C3a和C3b。來源活化血小板的P選擇素是C3b的受體;P選擇素與C3b結合,可刺激旁路途徑的級聯酶促反應激活補體[49]。活化的血小板α顆粒分泌因子D,因子D能激活并裂解因子B為Ba和Bb[50],促補體轉化酶形成;同時補體C3轉化酶能正反饋裂解更多補體C3,加強旁路途徑激活補體。見圖4。
3.3.3 膜攻擊復合物的形成 經典途徑和旁路途徑最后均能形成C5轉化酶,將C5裂解成C5a和C5b。試驗證明洗滌、活化的血小板可釋放C8、C9,小劑量的C5、C6、C7。C5b與C6、C7、C8、C9結合,形成C5b-9復合物,又稱膜攻擊復合物(membrane attack complex, MAC)[50](見圖4)。MAC通過跨膜通道的形成使細胞裂解,從而裂解細菌;MAC也可使內皮釋放TF、vWF啟動凝血途徑,誘發凝血酶和微血栓的形成,最終激活血小板并促血小板脫顆粒[51]。因此,活化的血小板增強補體系統裂解細菌,反過來激活后的補體也增強血小板的活化和脫顆粒,這種正反饋效應最終增強整體殺菌作用。
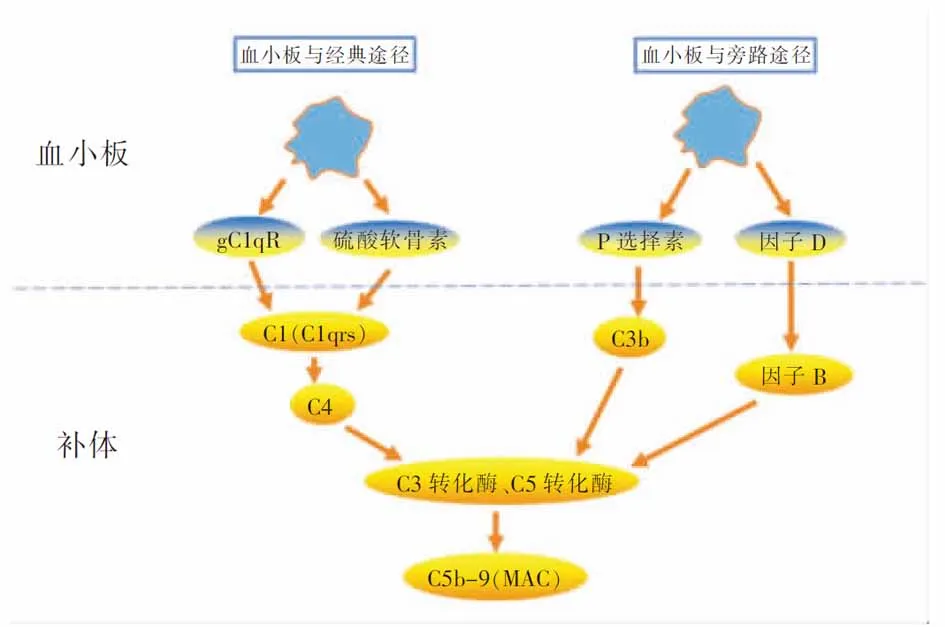
圖4 活化的血小板與補體間的相互作用示意圖
4 血小板增強適應性免疫
適應性免疫(包括體液免疫和細胞免疫)是體內T、B淋巴細胞接受外源物質的刺激后,自身活化、增殖、分化為效應細胞,發揮清除病原體等生物學效應。活化的血小板可直接或間接作用于T、B淋巴細胞,啟動和增強適應性免疫反應。
4.1 血小板與T淋巴細胞 一方面血小板可以識別和結合細菌,將其傳送至脾。如補體C3修飾的李斯特菌可以與血小板上GPIb結合,結合細菌的血小板在脾被CD8α+樹突狀細胞識別,將該信號(抗原)提呈給T細胞,啟動細胞免疫;另一方面,血小板本身的CD40L能促進樹突狀細胞成熟和啟動T淋巴細胞的免疫反應[52];同時,血小板釋放的血清素和RANTES(CCL5),也能介導T細胞的激活和分化[53]。
4.2 血小板與B淋巴細胞 體外血小板與B淋巴細胞混合培養3 d后發現,B淋巴細胞產生的免疫球蛋白(IgG1、IgG2、IgG3)增多[53],表明血小板能激活外周血B淋巴細胞和促免疫球蛋白的產生;同時提示血小板可能有促機體產生體液免疫的潛在作用。另外,血小板表達抗體Fcγ受體,能結合IgG抗體[54],協助啟動適應性免疫反應并殺滅細菌。
4.3 血小板與淋巴結 淋巴結是T、B淋巴細胞定居的場所。活化的血小板表達C型凝集素樣2受體(CLEC-2),可結合淋巴內皮細胞的平足蛋白,以維持淋巴結、淋巴管的完整性[55-56],有助適應性免疫應答的發生。
5 總結
血小板雖是無核的細胞碎片,但在細菌感染發揮關鍵的免疫防御作用。隨著對“血小板作為機體監測細菌的第一哨兵”的理解和研究的深入,將為臨床抗感染提供新的思路。

