慢性腎臟病患者亞臨床甲狀腺功能減退癥的研究進展
譚 妮 石 磊
1.湖北民族大學醫學部,湖北恩施 445000;2.湖北民族大學附屬民大醫院腎病內科,湖北恩施 445000
慢性腎臟病(chronic kidney disease,CKD)患者表現出多種內分泌和代謝紊亂,其中最常見的是在骨代謝上,引起慢性腎病礦物質代謝紊亂和骨異常及繼發性甲狀旁腺功能亢進;而另一種重要的內分泌紊亂為甲狀腺功能減退癥(簡稱“甲減”)。腎臟參與甲狀腺素的生成、分泌及降解過程。因此,CKD 將可能影響下丘腦-垂體-甲狀腺軸的任一水平,從而導致甲狀腺功能異常。甲狀腺素在腎臟生長、發育及維持其生理功能中發揮重要作用,甲狀腺功能異常亦可影響腎功能。目前關于CKD 與低T3 綜合征(low T3 syndrome,LT3S)之間的研究已被廣泛關注。亞臨床甲狀腺功能減退癥(subclinical hypothyroidism,SCH)在CKD 及終末期腎病(end-stage renal disease,ESRD)患者中亦較為普遍[1-3],但關于兩者之間的研究相對較少,故本文擬就CKD 與SCH 之間的聯系進行簡要闡述。
1 CKD患者SCH的患病率調查
SCH 為CKD患者中較為常見的甲狀腺功能紊亂,其特征是促甲狀腺激素(thyroid-stimulating hor mone,TSH)水平升高,游離三碘甲狀腺原氨酸(free triiodothyronine,FT3)和游離甲狀腺素(free thyroxine,FT4)水平基本正常,在普通人群中,SCH 患病率為5%~10%[4]。流行病學調查研究表明,非透析CKD、血液透析(hemodialysis,HD)和腹膜透析(peritoneal dialysis,PD)患者中SCH的患病率較其他非CKD患者顯著升高[1,5-7],但甲狀腺功能亢進癥的患病率與普通人群相似[8]。
在第三次全國健康與營養檢查調查的14 623名參與者中發現,隨著估算腎小球濾過率(estimatedglomerular filtration rate,eGFR)下降程度的增加,甲減的患病率逐漸升高:eGFR≥90、45~59 和<30 mL/(min·1.73 m2)的甲減患病率分別為5%、20%和23%[8]。即使考慮年齡、性別和種族/民族的差異之后,與eGFR≥90 mL/(min·1.73 m2)的患者相比,eGFR<30 mL/(min·1.73 m2)的患者患甲減的風險也要高出兩倍。在最近一項關于461 607例處于CKD 3~5期的美國退伍軍人的研究中發現,23%的患者患有甲減,且eGFR 每降低10 mL/(min·1.73 m2),甲減的風險增加18%[9]。而在這些研究中,很大一部分病例為SCH。在對意大利3089名成年人的研究中也發現,腎功能水平越低,SCH的患病率越高:eGFR≥90 mL/(min·1.73 m2)和<60 mL/(min·1.73 m2) 的SCH 患病率分別為7%和18%[10]。雖然在CKD患者中有關SCH的研究相對較少,但也有類似的高發病率報道,故將近年來有關CKD患者SCH的患病率做一總結(表1),以了解CKD患者SCH的患病情況。
2 甲狀腺功能障礙和腎臟疾病之間的潛在雙向聯系
2.1 CKD導致甲狀腺功能紊亂
CKD導致甲狀腺功能紊亂的機制目前尚未完全明確,可能與以下改變有關:①腎臟通過T4-5′-脫碘酶亞型D1 的局部脫碘作用參與T3 的產生[16],腎功能不全時,T4-5′-脫碘酶活性降低,T4 經外環脫碘向T3轉化的途徑減弱。SCH的患病率隨CKD 加重而增加,可能是由于T4-5′-脫碘酶活性降低所致[10]。②腎功能不全時,腎臟排泄能力降低引起的碘清除和滯留障礙,通過Wolff-Chaikoff 效應導致甲減。③CKD患者體內蓄積的肌酐、尿素氮、酚類等物質可抑制T4 與蛋白相結合,從而引起T4 下降,導致甲減[17]。④由于循環中的甲狀腺素絕大多數與蛋白質結合,有研究認為CKD患者大量蛋白的丟失可能導致全身甲狀腺素的耗竭。如腎病綜合征患者[18]及PD患者[5]大量蛋白的丟失都可能導致甲狀腺功能障礙。⑤硒可通過控制甲狀腺素脫碘酶活性調節外周T4 轉化為T3,而透析患者常發生硒缺乏,可能導致自身免疫性甲狀腺疾病加重[19]。⑥在晚期CKD 尿毒癥環境中發生的代謝性酸中毒也可能導致甲狀腺功能紊亂[20]。
2.2 甲減影響腎功能
甲減亦可影響CKD患者的腎功能,導致CKD患者腎功能進一步受損及腎臟結構改變,其機制尚未完全明確,但可能與以下幾點有關:①在CKD患者中,甲減可通過改變血流動力學,直接加重腎功能損傷。甲減可導致心輸出量減少,外周血管阻力增加,腎內血管收縮可導致腎血流減少,易造成腎前損傷。②甲減直接影響(如腎素基因表達降低)和間接影響(如平均動脈壓升高)導致腎素-血管緊張素-醛固酮活性降低,從而導致腎功能進一步受損[21]。③甲減也可能對腎臟結構產生不良影響。動物實驗表明,甲減與腎體重比、腎小管質量減少以及腎小球結構的不良改變有關(如腎小球體積和面積減少,腎小球基底膜增厚,腎小球系膜基質擴張)[22]。④甲減可導致eGFR 下降從而加速CKD 進展。在動物研究中發現,甲減可降低eGFR、腎血漿流量和腎小球經乳頭靜水壓力[4]。臨床病例亦可觀察到,嚴重甲狀腺功能低下的患者腎血漿流量和eGFR 均有所減少[23]。
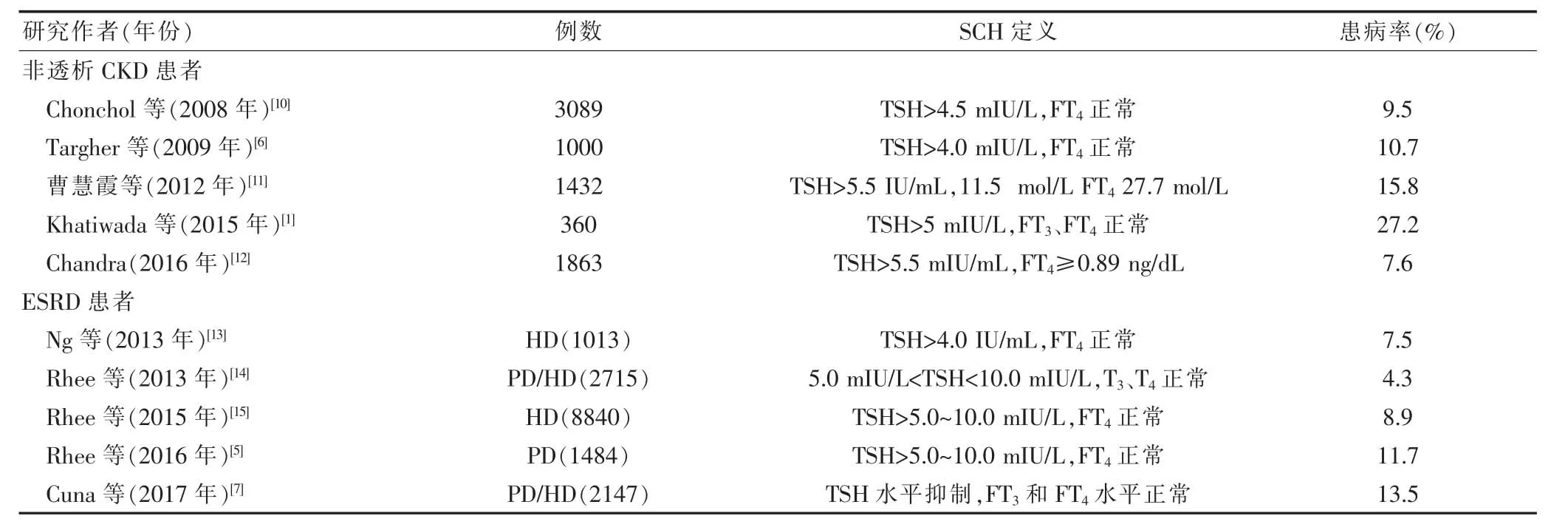
表1 CKD患者中SCH 患病率的調查
3 CKD患者甲狀腺功能障礙的治療
心血管疾病是CKD 最常見的并發癥,也是CKD患者不良預后的主要原因[24]。考慮CKD 和ESRD患者過度的冠心病、心力衰竭和心血管死亡率,可以合理地認為SCH的心血管后遺癥可能被放大。越來越多的證據表明,在CKD 人群中,甲減和SCH 與較高的死亡風險[15]、心血管疾病相關[5,25-26]。有研究指出,CKD患者中SCH 與血脂代謝、心功能不全及內皮功能紊亂等相關[27-28],而這些因素均可導致心血管疾病,故SCH 也可能成為CKD 及ESRD患者心血管疾病的危險因素。
引起ESRD患者死亡的主要原因為心血管疾病,人們越來越關注甲減作為心血管疾病中一個未被充分認識的危險因素,對于其治療也成為關注的重點。甲狀腺素是非透析CKD 及ESRD患者最常用的處方藥之一,但甲狀腺素替代治療對于CKD患者甲狀腺功能障礙的相關研究有限,治療效果尚不清楚。
Shin 等[29]對180例SCH 合并CKD 2~4期患者進行甲狀腺素治療的研究中發現,在平均(34.8±24.3)個月的隨訪期間,沒有接受甲狀腺素替代治療的患者eGFR 總體下降率明顯高于治療組,且甲狀腺素替代治療是腎臟預后的獨立預測因子,表明甲狀腺素治療不僅能更好地保留腎功能,也是CKD患者腎臟轉歸的獨立預測因子。Bajaj 等[30]對CKD(糖尿病和非糖尿病)患者進行甲狀腺功能篩查,對甲狀腺功能低下者行甲狀腺素替代治療3~6個月后發現eGFR 顯著增加,值得注意的是經6個月治療后,非糖尿病性CKD患者eGFR 增加量明顯高于糖尿病性CKD患者,而3個月時兩者無顯著差異,表明甲狀腺素替代治療可改善CKD患者的腎功能。Tang 等[31]在左甲狀腺素對CKD 3~4期患者營養狀況的影響研究中表明,左甲狀腺素治療可以延緩腎臟疾病的進展,對CKD 3期患者具有更高的療效。Deng 等[32]在分析156例CKD 3~4期患者合并甲減的營養不良情況時,發現經甲狀腺素治療后CKD患者的營養不良情況 (血清白蛋白水平、血紅蛋白水平、左手握力)可得到部分改善。
盡管這些有限的數據表明甲狀腺素替代治療有益,但需要指出的是,甲狀腺素補充有一個潛在的狹窄的治療-毒性窗口,理論上存在蛋白質能量消耗、心血管事件和骨丟失的風險[33]。因此,關于外源性甲狀腺素補充在CKD患者甲狀腺功能障礙中的安全性和有效性,需要嚴格的縱向研究、未來更大樣本量和延長隨訪期的隨機對照試驗來提供的更為明確的信息。
4 總結
CKD患者常伴隨甲狀腺功能紊亂,以SCH 和LT3S常見,其中SCH 患病率為7.6%~27.2%。關于腎臟疾病與甲狀腺功能之間的相互關系,仍有許多知識空白,需進一步的研究以了解CKD患者甲狀腺功能障礙的發病機制。目前現有的臨床實踐指南缺乏對CKD患者甲狀腺功能障礙的篩查建議,但考慮到CKD患者SCH 可通過影響血脂代謝、心功能障礙等引起不良心血管疾病,并導致更高的死亡風險,故建議臨床醫師對于CKD患者,尤其老年患者進行定期的甲狀腺功能篩查,早期識別甲狀腺功能紊亂。

