若爾蓋高原泥炭沼澤濕地土壤細菌群落空間分布及其驅動機制
王好才,夏 敏,劉圣恩,王 燚,展鵬飛,王 行,*
1 西南林業(yè)大學國家高原濕地研究中心/濕地學院, 昆明 650224
2 中國科學院沈陽應用生態(tài)研究所, 沈陽 110016
3 云南農業(yè)大學農學與生物技術學院, 昆明 650201
4 福建師范大學地理科學學院, 福州 350007
濕地生態(tài)系統是地球上最重要的生態(tài)系統之一,在物質循環(huán)、能量流動、維持生態(tài)平衡等方面發(fā)揮著重要的生態(tài)價值和環(huán)境功能[1-3]。微生物是濕地生態(tài)系統的重要組成部分,是土壤有機質與土壤養(yǎng)分轉化與循環(huán)的動力,開展?jié)竦赝寥牢⑸锵嚓P研究對于認識和了解濕地生態(tài)系統生境狀況與演化具有重要意義[4-6]。我國的高原濕地主要分布在海拔3000m以上的高原區(qū)域,是一類特殊的濕地類型。受氣候變化及人為活動干擾,高原濕地生物組成及區(qū)系特征對環(huán)境變化異常敏感,其土壤微生物群落多樣性和分布狀況受土壤質地、植被類型、土壤pH及水分狀況等因素影響[7]。因此,在全球氣候變化背景下,開展高原濕地土壤微生物多樣性及其空間分布研究,對進一步辨析濕地關鍵生態(tài)特征及其演化過程具有重要意義[8]。
土壤微生物具有明顯的地域性特征,表現出一定的空間分布關系[9]。當前,土壤微生物群落結構相似性和地理空間距離的響應關系在草地、農田、森林等生境中已被證實[10-12]。在濕地生態(tài)系統中,有關土壤微生物空間分布特征的研究主要集中在人工濕地。如有研究表明,在受人類干擾較大的人工濕地類型(如庫塘、水稻田等)中存在微生物群落相似性隨地理距離增加而衰減的一般規(guī)律[13-14]。在自然濕地生態(tài)系統中,尤其是原始生境保存較好的高原泥炭沼澤濕地,土壤微生物群落相似性對地理距離的響應關系仍然未知。環(huán)境因素顯著影響微生物群落組成和分布,微生物—環(huán)境之間存在密切的相互作用關系[15-17]。空間尺度大小對土壤微生物不同成員在群落構建方面的潛在驅動因素還尚不明確。在土壤微生物群落中,稀有種被定義為在不同樣品間占據率較低的微生物,而豐富種是指在大量樣品中普遍存在且豐度較高的類群[18]。在氣候變化、群落組裝過程及環(huán)境適應方面,稀有種和豐富種的響應機制表現出明顯的差異[19-21],而在以往的微生物地理學研究中,往往會把所有微生物群落作為一個整體來探究其生物地理分布模式,少有將群落按照豐度高低劃分為稀有種和豐富種,并分別加以研究。由此我們提出假設:在自然濕地生態(tài)系統中,微生物群落不同成員的生物地理分布模式可能存在明顯的差異。
由于若爾蓋高原泥炭沼澤濕地在碳存儲方面的重要性,人們在全球變暖、水文波動環(huán)境下的土壤微生物活性及多樣性變化方面開展了大量研究工作[22-23]。目前,對若爾蓋高原濕地土壤微生物的研究側重于生境退化和擾動對微生物多樣性及結構的影響,以及泥炭層中有機物的微生物利用特征等方面,而土壤微生物生物地理分布模式尚不明確[24-26]。空間距離和環(huán)境異質性被認為是形成遺傳變異和種群多樣性的主要因素,然而在高原原生濕地土壤中,它們的相對重要性仍未得到充分認識。鑒于此,該研究以若爾蓋高原泥炭沼澤濕地土壤細菌群落為研究對象,采用16S rDNA基因測序分析技術,探究高原泥炭沼澤濕地土壤細菌群落的生物地理分布模式,同時依據微生物群落在土壤樣本中出現的豐度高低劃分為稀有種和豐富種,研究群落內不同成員對地理分布模式的響應關系,以及影響群落多樣性的環(huán)境驅動因素。該項研究工作的開展,有助于從微生物生物地理學的角度解釋若爾蓋高原泥炭沼澤濕地土壤細菌群落結構及多樣性的分布規(guī)律和響應機制,為進一步研究若爾蓋濕地土壤微生物地球化學循環(huán)過程,揭示微生物多樣性對高原濕地生態(tài)系統功能的影響提供科學依據和理論基礎。
1 材料與方法
1.1 研究地概況
若爾蓋高原泥炭沼澤濕地位于青藏高原東北部,川甘兩省交界處(33°25′—34°00′N, 102°29′—102°59′E),為黃河源區(qū)的重要組成部分,具有豐富的動植物資源和生物多樣性。氣候寒冷濕潤,年均溫在0.6—1.1℃之間,根據第二次全國濕地資源調查結果,研究區(qū)的濕地類型為草本沼澤,主要優(yōu)勢植物為木里苔草(Carexmuliensis)。若爾蓋大沼澤原始生境保存較好,是我國第一大高原沼澤濕地,也是世界上面積最大、保存最完好的高原泥炭沼澤,是青藏高原高寒濕地生態(tài)系統的典型代表。作為重要的生態(tài)敏感區(qū)、高山生物多樣性豐富帶,若爾蓋高原沼澤泥炭地在全球生態(tài)系統保護中具有重要地位,在全球碳儲量、土壤水分涵養(yǎng)等方面發(fā)揮重要作用[27]。
1.2 實驗設計與樣品采集
由于若爾蓋泥炭沼澤濕地呈斑塊狀分布,結合保護區(qū)濕地生境特征,于2018年8月挑選了原始生境保存較好的一塊典型泥炭沼澤濕地作為研究對象,從局域尺度(local scale)開展微生物地理學研究工作。研究區(qū)沼澤水深在0.3—0.5m左右,為原生生境,在保護區(qū)內部不存在放牧干擾。深入原生沼澤濕地內部進行樣品采集,結合前人采樣策略[28]及前期研究基礎[29],擬采用嵌套采樣方案(圖1)。分別設計3個100m2的樣方,第1個樣方與第2個樣方之間的間隔為100m,第1個樣方和第3個樣方之間的間隔為1000m。每個100m2的樣方內分別嵌套一個10m2和1m2兩種尺度的小樣方。在每個100m2的樣方內,共取10個土壤芯(0—10cm),3個樣方一共采集30個土壤芯(圖1,見紅色圓點所示)。該采樣策略可以對土壤微生物β多樣性的變化和更替進行有效評估[28]。在每個采樣點設置0.5m×0.5m樣方,將樣方內部的植物地上部分收割后帶回實驗室,清洗干凈并放入65℃烤箱中烘至恒重,用四分位電子天平進行稱重得到地上生物量。隨后利用荷蘭Eijkelkamp定深泥炭鉆采集0—10cm濕地表層土壤樣品,使用環(huán)刀(7.5cm直徑,5cm高)和自封袋分裝。用鑷子將環(huán)刀中的根系挑選出來,用淘洗法對地下根系沖洗干凈后,放入65℃烤箱中烘至恒重,稱重得到地下生物量。采集的土壤樣品一部分放入凍存管后在便攜式液氮罐中迅速冷凍,帶回實驗室后放入-80℃冰箱保存,用于土壤微生物分析。
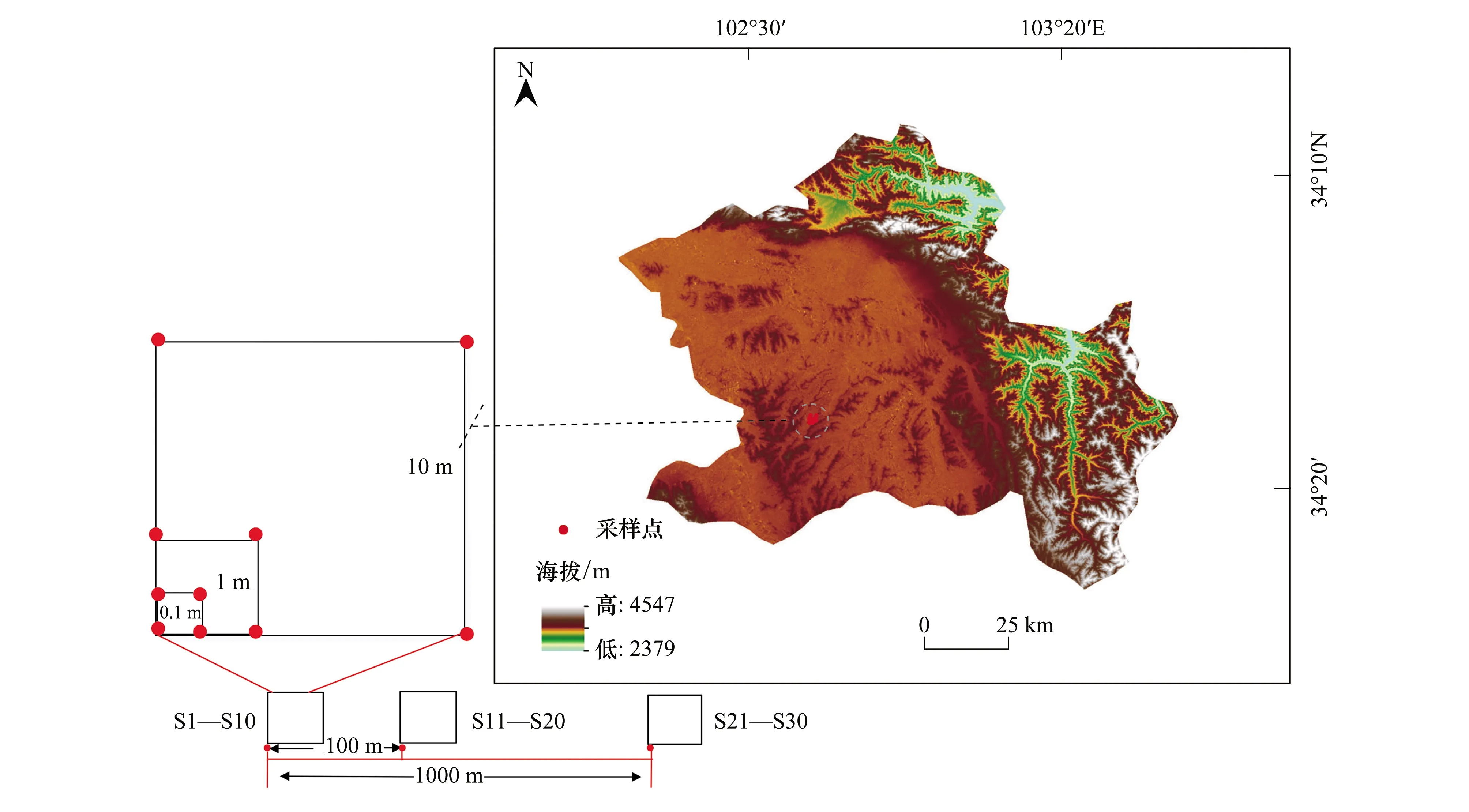
圖1 研究區(qū)域位置及采樣點示意圖
1.3 土壤理化性質的測定
土壤容重、土壤孔隙度、含水量等指標的測定使用環(huán)刀里的土樣。泥炭土壤自然儲水量以及最大儲水量分別由自然含水率、飽和含水率換算得到。土壤總氮總磷采用濃硫酸消煮法,之后采用流動分析儀(AA3,Bran+LuebbeCrop,德國)測定;土壤硝態(tài)氮、土壤銨態(tài)氮采用氯化鉀浸提法,之后采用流動分析儀測定;土壤pH采用玻璃電極法(MP511 pH計)按土水比1:2.5測定;土壤活性磷采用碳酸氫鈉—鉬銻抗比色法;土壤活性碳采用高錳酸鉀氧化法;土壤陽離子交換量采用三氯化六氨合鈷浸提—分光光度法。同時,使用TOC總有機碳分析儀(德國元素Vario)測定土壤溶解性有機碳;使用馬弗爐儀器測定土壤灰分;用氫氟酸-高氯酸-硝酸消解法測定土壤K、Ca、Mg、S、Fe以及Mn 6種元素(微波消解儀,全譜直讀電感耦合等離子體發(fā)射光譜儀(ICPE—9820));利用電感耦合等離子體發(fā)射光譜法同時測定土壤中可交換態(tài)鉀、鈣、鎂。土壤基本理化指標測定結果見表1。

表1 研究區(qū)域土壤理化指標統計表
1.4 土壤DNA提取和16S rDNA擴增子測序
土壤微生物DNA提取使用Ezup柱式土壤基因組DNA抽提試劑盒,按試劑盒操作說明書提取,并采用0.8%瓊脂糖凝膠電泳檢測DNA。16S保守序列片段的擴增引物使用515F(5′—GTGCCAGCMGCCGCGGTAA—3′)和806R(5′—GGACTACHVGGGTWTCTAAT—3′)[30]。以10倍稀釋后的基因組DNA為模板,根據測序區(qū)域的選擇,使用帶Barcode的特異性引物進行PCR擴增,每個樣本進行三個PCR技術重復。PCR產物與1/6體積的6X loading buffer混合,使用2%瓊脂糖凝膠進行電泳檢測。對目的條帶進行割膠回收,使用QIAquick Gel Extraction Kit(QIAGEN)試劑盒,回收后的PCR純化產物使用Qubit@2.0 Fluorometer(Thermo Scientific)進行定量,最后等摩爾量混合。建庫使用TruSeq DNA PCR—Free Sample Prep Kit試劑盒,構建好的文庫經過定量和文庫檢測合格后,使用羅寧生物的Hiseq 2500平臺PE250模式測序。
1.5 采樣點的地理距離獲取
每個采樣點的空間地理坐標由手持GPS(eTrex enture, Garmin, Olathe, KS, USA)進行記錄,之后采用平面直角坐標系來計算每個采樣點的相對距離(以第一個采樣點為原點,圖1)。使用R語言中的Vegan包計算采樣點之間的兩兩地理距離,從而創(chuàng)建采樣點之間的地理距離矩陣。
1.6 數據分析與處理
1.6.1群落組成及Alpha多樣性分析
使用R語言中的Vegan包進行數據預處理與alpha多樣性和相對豐度的計算,將在所有樣品中出現且豐度大于2的OTU定義為核心微生物(core microbiome),使用grid包和ggplot2包將數據進行可視化處理。
1.6.2土壤微生物群落相似性與地理距離的相關性分析
通過將全部OTU分類單元重新劃分為稀有種(Endemic taxa)(在所有樣品中出現的頻率低于25%的OTU)和豐富種(Ubiquitous taxa)(在所有樣品中出現的頻率高于75%的OTU),分別產生4057個和716個OTU分類單元。隨后,通過非度量多維標度(Bray—Curtis)距離[31],采用非參數多變量統計檢驗和相似性分析(999個排列),測定細菌總群落、稀有種群落、豐富種群落在局域空間尺度上不同樣本之間的群落結構相似性[32]。細菌群落的周轉速率用衰減率表示,該指標為地理距離(ln對數轉換)與群落相似性(ln對數轉換)關系的普通最小二乘回歸(Ordinary Least Squares Regression)的斜率。斜率的計算公式如下:
ln(S)= ln(a)+zln(G)
式中,S為微生物群落相似性,G為地理距離,a為截距參數,z為衰減曲線的斜率,反映細菌群落的周轉速率[33]。
1.6.3Mantel檢驗、方差分解分析
為了分析環(huán)境變量以及地理距離對微生物群落組成的影響,使用R語言中的ggcor包進行Mantel檢驗分析,檢驗不同群落組成和環(huán)境變量之間的Spearman相關性。同時,使用vegan包進行基于距離的冗余分析(Distance—based redundancy analysis,db—RDA)。
鄰體矩陣主坐標(principal coordinates of neighbor matrices,PCNM)分析能夠獲得樣本間空間關系的分解向量,顯著的PCNM變量能直接解釋空間尺度對物種的貢獻[34]。PCNM分析通過對研究尺度范圍內的空間距離建立截尾矩陣,通過主軸分析法進行處理,得到PCNM1、…、PCNMn,PCNM1表示整個研究尺度內的空間信息,屬大尺度;PCNM2、…、PCNMn代表的尺度信息依次減少。得到空間因子數據后,結合土壤理化數據,采用方差分解分析(Variance Partitioning Analysis,VPA)來評估空間因子、土壤因子對細菌總群落、稀有種群落、豐富種群落多樣性組成和結構變化的相對貢獻。PCNM分析以及VPA分析均使用R語言中的vegan包進行。
2 結果與分析
2.1 土壤細菌群落豐度及多樣性分析
2.1.1群落組成
在所有的土壤樣本中,一共獲得986532條高質量的細菌序列,在97%的相似水平下進行OTU聚類分析后,共得到6456個分類單元。通過將全部OTU分類單元重新劃分為稀有種和豐富種,分別產生4057和716個OTU。我們比較了稀有種、豐富種和總細菌群落在門水平和屬水平上相對豐度在前10的物種組成特征(圖2)。

圖2 稀有種、豐富種和總細菌群落在門水平和屬水平上的相對豐度(前10)圖
經微生物16S rDNA基因測序,共檢測到54個菌門和934個菌屬。其中,19個菌門和121個菌屬的平均豐度高于1%。綠彎菌門(Chloroflexi)是顯著的優(yōu)勢菌門,在稀有種群、豐富種群和總細菌群落中其所占豐度分別達21.88%、26.45%和26.25%,其他優(yōu)勢菌落分別為變形菌門(Proteobacteria)、厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)、酸桿菌門(Acidobacteria)、廣古菌門(Euryarchaeota)、疣微菌門(Verrucomicrobia)、浮霉菌門(Planctomycetes)、Latescibacteria和Rokubacteria。在屬水平上,乳桿菌屬(Lactobacillus)是明顯的優(yōu)勢菌屬,在稀有種群、豐富種群和總細菌群落中其所占豐度分別達0.7%、11%和3%。在稀有種中,RuminococcaceaeUCG—014是優(yōu)勢菌屬。
此外,通過30個土壤微生物樣本信息,構建了基于泥炭土壤微生物的核心微生物群(core microbiome),共計278個OTU分類單元,分屬于17個門水平和84個屬水平。圖3列舉了核心微生物在門水平和屬水平劃分上相對豐度前10的核心微生物。其中,在門水平上豐度前三的細菌分別是綠彎菌門(Chloroflexi)、變形菌門(Proteobacteria)和厚壁菌門(Firmicutes),這些微生物在核心微生物群中所占豐度高達69%;在屬水平上,豐度排前三的微生物分別是擬桿菌屬(Bacteroides)、球菌科UCG.014(RuminococcaceaeUCG—014)和甲烷桿菌屬(Methanobacterium),其所占豐度為18.04%。
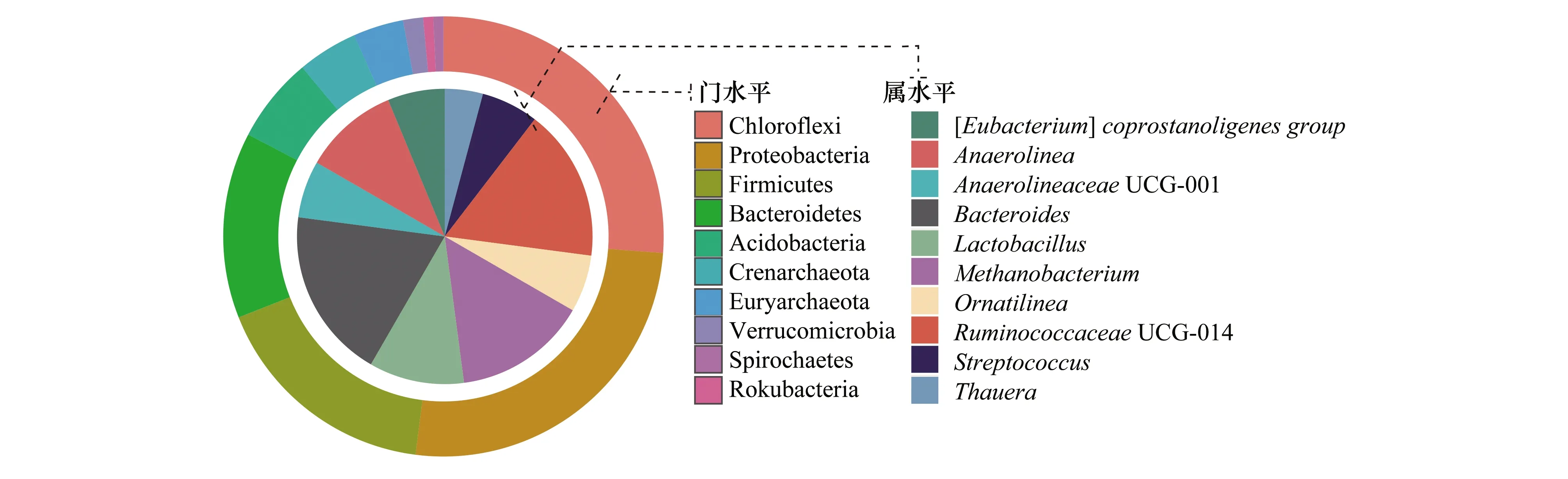
圖3 基于30個土壤樣本構建的門水平和屬水平上相對豐度前10的核心微生物
2.1.2Alpha多樣性
對研究區(qū)域所有采樣點土壤細菌群落的Alpha多樣性指數分析顯示(圖4),Chao1指數、Shannon指數和Simpson指數分別介于1663—3571、3.21—6.49和0.98—0.99之間,若爾蓋高原濕地土壤樣品具有較高的微生物多樣性。同時發(fā)現,Chao1指數的變異系數(14.71%)大于Shannon指數(3.21%)和Simpson指數(0.32%)。
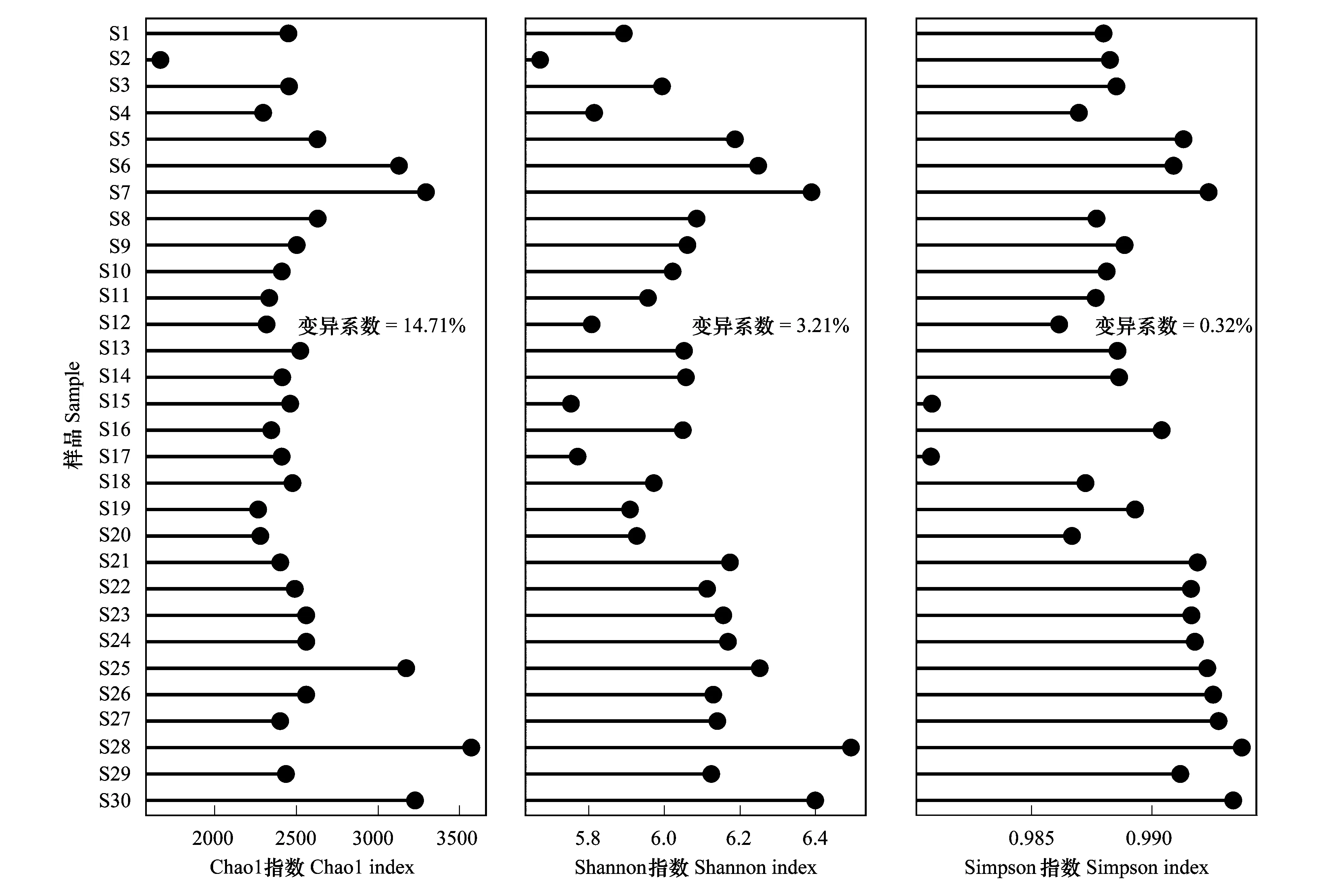
圖4 細菌群落Alpha多樣性指數變化Cleveland點圖
2.2 細菌群落相似性的距離衰減特征分析
為探索高原泥炭原生沼澤濕地土壤中的微生物群落是否存在生物地理分布模式,對微生物群落相似性和地理距離之間的關系進行分析,并獲得群落相似性隨地理距離變化的衰減率特征。結果表明,稀有種、豐富種和總細菌群落的相似性均隨著地理距離的增加而衰減(圖5),表明高原泥炭濕地土壤微生物的空間分布特征符合生物地理分布的一般模式。通過比較,發(fā)現細菌群落的周轉速率(圖5,斜率Slope)在不同群落中存在差異。總體上,總細菌群落的距離衰減斜率(Slope=-0.026;P<0.001;R2=0.139)高于稀有種(Slope=-0.006;P=0.004;R2=0.056)和豐富種(Slope=-0.025;P<0.001;R2=0.112)。3個細菌群落對空間尺度的依賴性由大到小分別是總細菌群落、豐富種和稀有種。由此我們可以得出,在原始生境保存較好的若爾蓋泥炭沼澤高原濕地生境中,土壤微生物群落的相似性隨地理距離的增加而衰減,稀有種的周轉速率則低于豐富種。
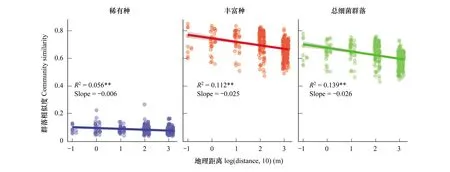
圖5 群落相似性的地理距離衰減圖
2.3 稀有種、豐富種和總細菌群落對環(huán)境因子的響應
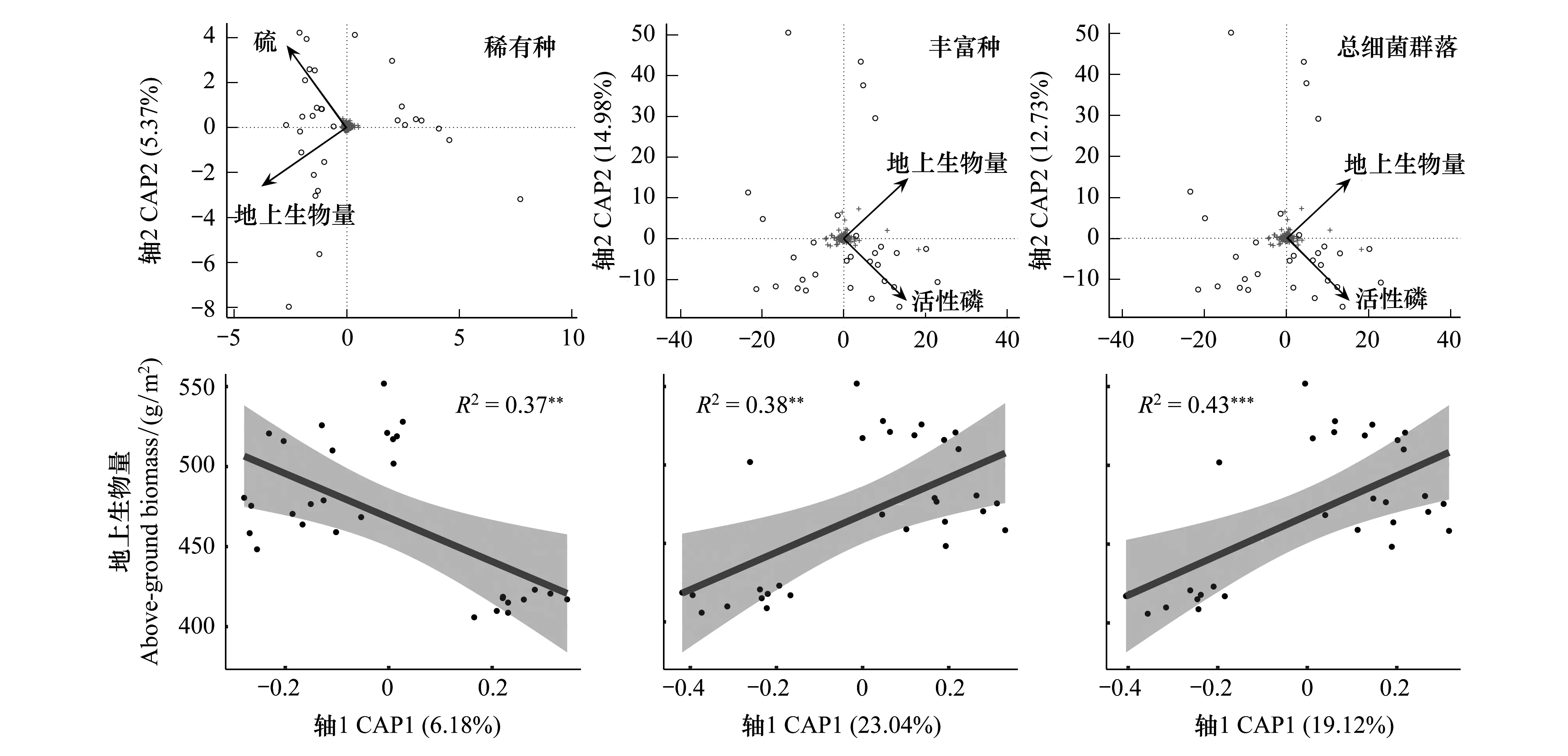
對3種細菌群落和環(huán)境因子進行Mantel檢驗分析。結果顯示(圖6),地上生物量與3種微生物群落之間表現出極顯著相關性(0.001 圖6 環(huán)境因子和3類細菌群落的Mantel檢驗 為了進一步明確驅動微生物群落多樣性在局域尺度上造成差異的關鍵環(huán)境因子,基于Bray—Curtis距離的約束主坐標分析表明(圖7),稀有種、豐富種和總細菌群落多樣性變異的11.54%、38.20%和31.85%可以用前兩個主成分(CAP1和CAP2)來解釋。按環(huán)境因子對3種細菌群落組成差異性影響的遞減順序(前向選擇),這些顯著因子分別為地上生物量、活性磷(豐富種、總細菌群落)和硫含量(稀有種),地上生物量是影響3種細菌群落組成多樣性的關鍵環(huán)境因子;在稀有種群落中,CAP1與地上生物量呈顯著負相關(R2=0.37,P<0.001),而在豐富種群落(R2=0.38,P<0.001)和總細菌群落(R2=0.43,P<0.001)中則為顯著正相關。該分析結果進一步驗證了Mantel分析檢驗結果。 圖7 3種細菌群落和環(huán)境變量的冗余分析(db—RDA) 采用VPA方法分析環(huán)境因子(土壤環(huán)境因子)和空間因子(PCNM)對稀有種群、豐富種群和整體細菌群落組裝的相對貢獻。圖8顯示在3個細菌群落中,環(huán)境因子和空間因子對群落結構貢獻的總解釋量分別為4.93%、27.84%和26.63%,其中,空間因子在3種細菌群落的單獨解釋量分別為1.39%、3.59%和3.85%;環(huán)境因子在3個群落中的單獨解釋量分別為1.57%、7.27%和6.98%;空間因子、環(huán)境因子在3個細菌群落中的共同解釋量分別為1.96%、16.98%和15.80%。總體上,在局域尺度上,環(huán)境因子對3種細菌群落組成差異性的貢獻度要高于空間因子;稀有種群的VPA分析結果解釋度明顯低于整體細菌群落和豐富種群,可能是因為稀有種群落的產生具有較大的隨機性,主要由隨機作用(非決定作用)調控其群落構建(圖5)。 通過對解釋變量做前向選擇分析(表2),發(fā)現空間因子PCNM1、PCNM2為主要解釋變量(P<0.05),說明覆蓋整個采樣點的空間特征對樣點之間微生物群落結構的差異具有顯著影響;地上生物量和活性磷為豐富種和總細菌群落的主要解釋因子,而在稀有種群中則為土壤硫含量和地上生物量。 前人針對若爾蓋高原濕地土壤微生物開展了大量研究工作。如Zhong等[24]發(fā)現地下水位下降降低了原核生物群落的alpha多樣性,微生物群落的垂向分布特征主要受地下水位波動影響。Tang等[6]研究表明在若爾蓋地區(qū),土壤類型對細菌群落的影響大于土壤深度對細菌群落的影響。Gu等[26]發(fā)現土壤退化導致若爾蓋細菌和古菌群落的網絡關聯模式發(fā)生變化。Yang等[25]研究發(fā)現泥炭地退化減少了表層和深層土壤中的產甲烷菌的數量,甲烷排放下降。Cui等[22]研究表明溫度增加了高寒濕地甲烷排放,而植被對甲烷菌群落組成有顯著貢獻,并與甲烷排放密切相關。目前,在若爾蓋開展的研究工作主要集中在生境變化及擾動對微生物的影響,這些研究工作為我們進一步揭示若爾蓋土壤微生物的地理分布格局打下了基礎。 通過對比發(fā)現,不同區(qū)域的泥炭土壤細菌群落組成具有相似性。研究者[13]在對我國東北泥炭土壤細菌群落的研究中發(fā)現,酸桿菌門(Acidobacteria)、放線菌門(Actinobacteria)、變形菌門(Proteobacteria)、擬桿菌門(Bacteroidetes)、綠彎菌門(Chloroflexi)等為土壤中的優(yōu)勢細菌群落。而在本研究中,若爾蓋泥炭土壤的優(yōu)勢細菌群落為綠彎菌門(Chloroflexi)、變形菌門(Proteobacteria)、厚壁菌門(Firmicutes)、擬桿菌門(Bacteroidetes)、酸桿菌門(Acidobacteria)等組成,在群落組成結構上與其他區(qū)域的泥炭土壤微生物組成具有相似性。基于前人的研究結果,我們認為若爾蓋高原泥炭沼澤濕地中的這些土壤細菌群落是驅動若爾蓋泥炭土壤生物地球化學循環(huán)的主要參與者,并同時參與了該區(qū)域濕地生境的形成與演化。然而,有關細菌群落在高原濕地生境中所發(fā)揮的具體功能仍需要進一步探索和研究。 雖然已有大量研究報道了不同生境中土壤微生物的生物地理模式,但少有研究關注人類活動干擾較少的高原濕地生境中的微生物生物地理模式,也少有研究闡明了微生物群落中不同類群群落相似度隨地理距離的變化情況[10-13]。在本研究中,稀有種、豐富種和總細菌群落的相似度隨地理距離的增加而衰減,證實了在高原泥炭沼澤濕地中土壤微生物也存在生物地理分布模式;3種細菌群落的距離衰減斜率在局域尺度上存在差異,且稀有種群落的相似度距離衰減斜率低于豐富種群,這與其他研究者在水稻土壤細菌群落中的發(fā)現有所不同[18]。在本研究中,稀有種群在30個土壤樣品中的群落相似度低于20%,豐富種群的相似度則高于70%(圖5)。稀有種在不同樣品之間的差異主要由群落的演替、變更導致,而豐富種在不同樣品之間的差異主要由群落的豐度高低導致。結合他們各自的距離衰減斜率規(guī)律(稀有種群落的相似度距離衰減斜率低于豐富種群),我們認為若爾蓋高原泥炭土壤微生物相似性的地理衰減主要由高豐度的優(yōu)勢群落調控,物種豐度的變化是導致微生物群落地理距離衰減的主要因素。 環(huán)境因子是影響微生物群落結構的重要因素[11,17]。在本研究中,通過Mantel檢驗和冗余分析得出,地上生物量與3種微生物群落之間表現出極顯著相關性(0.001 Jennifer等[33]通過比較鹽沼沉積物中氨氧化細菌群落的組成,發(fā)現地理距離對局部尺度的微生物群落結構相似性影響顯著,并認為距離效應的產生與生態(tài)漂移有關。然而,隨著地理距離增加,微生物群落的地理衰減模式發(fā)生變化。Gao等[18]研究了水稻土細菌群落組裝的空間尺度依賴性,發(fā)現稀有種群、豐富種群和總細菌群落在局域尺度(1—113m)、中觀尺度(3.4—39km)和區(qū)域尺度(103—668km)內的空間依賴性存在差異。因此,采樣尺度的大小是我們在研究微生物群落組成和微生物地理模式時不可忽略的重要因素[36]。在本研究中,我們在局域尺度上對不同細菌群落的空間尺度依賴性進行了研究,發(fā)現不同細菌群落的空間依賴性存在差異,從而進一步論證了前人的研究結果。此外,有研究者運用VPA分析揭示中國東部沿海地區(qū)水稻土壤和玉米土壤中影響古生菌群落構建的空間因素和環(huán)境因素,定量分析空間因子、土壤因子和氣候因素對微生物群落構建的相對貢獻[14]。研究發(fā)現,影響玉米和水稻土古生菌群落構建的相對貢獻由大到小依次為土壤理化因子、空間因子和氣候因子,該結果與本研究中得到的結果具有相似性(圖8、表2),表明在我們所調查的局域尺度上,若爾蓋泥炭濕地土壤微生物群落對環(huán)境異質性的響應較為強烈,是群落微生物構建的主要影響因素。 1)若爾蓋高原泥炭沼澤濕地中土壤細菌多樣性較高,共包括54個菌門和934個菌屬。其中,19個菌門和121個菌屬的平均豐度高于1%。在門水平上,綠彎菌門(Chloroflexi)、變形菌門(Proteobacteria)和擬桿菌門(Bacteroidetes)構成泥炭土壤核心微生物;在屬水平上則為擬桿菌屬(Bacteroides)、球菌科UCG.014(RuminococcaceaeUCG-014)和甲烷桿菌屬(Methanobacterium)。 2)若爾蓋高原泥炭沼澤濕地土壤細菌群落在局域尺度上存在較為明顯的生物地理分布模式,即細菌群落相似性隨地理距離的增加而衰減。在3種細菌群落中,群落的周轉速率由大到小分別為總細菌群落、豐富種和稀有種。 3)地上生物量是影響高原泥炭沼澤濕地土壤細菌群落空間分布特征的關鍵環(huán)境因子;影響稀有種群落空間特征的環(huán)境因子還包括土壤硫含量、活性磷、Mn和土壤pH值。在局域尺度上,土壤理化因子對高原泥炭沼澤濕地土壤細菌群落構建的相對貢獻大于空間因子。
2.4 環(huán)境因子與空間因子對微生物群落構建的相對貢獻
3 討論
3.1 若爾蓋高原濕地土壤微生物群落結構特征
3.2 若爾蓋高原濕地土壤微生物地理模式
3.3 環(huán)境因子對土壤微生物群落的影響
3.4 環(huán)境因子和空間距離對土壤微生物群落構建的相對貢獻
4 結論

