PLGA靜電紡絲納米纖維結合誘導培養基和BMP4誘導鼠胚胎干細胞向牙上皮分化
張彥聰 竇林波 張風河
參與牙胚發育的細胞因子數量非常多,其中以BMP家族,FGF家族與牙胚發育的關系最為密切[1-2]。研究表明,PAX9是牙間充質早期標志物[3-4],并受上皮BMP4和FGF8(fibroblast growth factor,成纖維細胞生長因子)信號的調控, FGF8與BMP4互相拮抗定點了口腔外胚層上皮的成牙位點,并具有時空依賴性,表達FGF8但不表達BMP4的區域表達PAX9。在牙胚發育的前期,口腔上皮首先表達FGF8,成為牙胚將要發生的標志[5]。同時,FGF8刺激間充質在蕾狀期表達PAX9,而BMP4抑制PAX9的表達,因此,來自上皮的FGF8與BMP4信號互相拮抗,共同決定了間充質表達PAX9的區域,從而確定了未來牙發生的位點[6]。反過來,間充質內被誘導產生的轉錄因子也反饋調節上皮內的信號。最典型的是BMP4循環反饋。在鼠胚胎E 11.5 d,牙胚上皮蕾狀期,BMP4表達由上皮轉移至間充質,成牙潛能也由上皮轉移至間充質。上皮和間充質分泌的BMP4均能激活上皮和間充質的WNT通路和BMP通路,使信號循環反饋,不斷放大[7]。可見BMP4在牙胚發育過程中起到核心作用,BMP4在合適的時間表達增強或減弱,進而影響其它信號的變化最終決定了上皮向牙胚發育。因此在微環境材料中引入BMP4多肽可激活BMP-WNT 反饋循環,從而啟動牙上皮分化。
納米纖維與細胞外基質的纖維環境相似,由于其高表面積和體積比,合成或天然生物聚合物納米纖維已被應用于支持多能干細胞的長期培養。這種納米結構有可能準確地模擬自然的細胞外基質,并為干細胞的附著和增殖提供亞細胞尺度上的最佳空間[8-10]。合成聚合物,如PLGA(poly(lactic-co-glycolic acid)、PCL、PHA具有良好的機械、生物降解性和穩定體內,容易加工和修飾[11-13]。
本課題擬使用PLGA作為基底材料,通過靜電紡絲技術構建納米纖維支架材料,結合不同時間點BMP4的干預,將鼠胚胎干細胞(mouse embryonic stem cells, mES cells)向牙上皮細胞誘導,為全牙再生的研究提供一定的研究思路和實驗基礎。
1 材料與方法
1.1 納米纖維的制備
35%的PLGA (v/v)溶于55%N, N -二甲基甲酰胺另加10%乙醇,置于靜電紡絲機的針形注射器內,在12 kV電壓,調節參數,制備取向及非取向納米纖維。將納米纖維剪成六孔板孔徑大小備用。掃描電鏡表征納米纖維形貌,接觸角檢測納米纖維親水性。
1.2 鼠胚胎干細胞培養
將凍存的鼠胚胎干細胞自液氮灌中取出,立即放入37 ℃水槽中并快速搖晃進行解凍至米粒大小冰球,快速移入15 mL離心管,逐滴加入5 mL DMEM(基礎培養基),離心(1 200 r, 5 min),去上清。加入1 mL誘導培養基(Ko-DMEM+15%FBS+1% penicillin/streptomycin+ 1% l-glutamic acid+1 000 U/mL leukemia inhibitory factor (LIF)+1% 2-mercaptoethanol+1%非必需氨基酸),輕輕吹打。然后移入事先鋪過明膠并加有1 mL培養基的六孔板內,用培養基清洗凍存管,清洗液也移入孔板中。輕輕搖勻,放入37 ℃ 5% CO2培養箱中培養,次日換液。倒置相差顯微鏡觀察細胞形貌。
1.3 鼠胚胎干細胞向口腔上皮誘導培養
將事先準備好的置入納米纖維的六孔板用75%酒精浸泡消毒30 min后,于超凈臺中晾干10 min,用前在生物安全柜內紫外消毒30 min,之后F12溶液沖洗3 次后開始細胞培養。0.05%胰酶-EDTA將mES細胞消化,誘導培養基重懸,吹打成單細胞懸液,調整細胞濃度為1×105mL,接種于6 孔培養板,每孔2 mL,并在不同的時間加入LDN193189(簡稱LDN)和BMP4,培養14 d。誘導方案分為4 組:(第1 組)對照組,普通六孔板鋪明膠,加誘導培養基;(第2 組)支架材料+誘導培養基+LDN(第2~4 天)即在48 h加入LDN,持續作用48 h;(第3 組)支架材料+誘導培養基+LDN(第2~4 天)+BMP4(第2~4 天),即48 h加LND,持續作用48 h后,加入BMP4,繼續作用48 h;(第4 組)支架材料+誘導培養基+LDN(第2~4 天)+持續加BMP4(第2 天),即48 h加LND,持續作用48 h后,加入BMP4直到培養結束。 24 h后掃描電鏡觀察細胞貼壁情況。 14 d取各組樣本免疫熒光檢測成牙相關蛋白PAX9、PITX2表達。
1.4 鼠胚胎干細胞向牙上皮誘導培養
48 h后,向培養基內加入30 pmol的BMP4,誘導方案分為4 組: (1)空白對照組:明膠表面+誘導培養基;(2)材料對照組:誘導培養基+LDN(第2~4 天) +BMP4(第2~4 天);(3)取向支架材料+誘導培養基+LDN(第2~4 天)+BMP4(第2~4 天); (4)非取向支架材料+誘導培養基+LDN(第2~4 天) +BMP4(第2~4 天)。以上方案均誘導14 d。免疫熒光檢測成釉細胞特異性蛋白AMBN表達。
2 結 果
2.1 納米纖維形貌及鼠胚胎干細胞形貌
納米纖維材料成白色薄膜狀,掃描電鏡下顯示納米纖維分為非取向性(圖 1A)平均接觸角約53.5度和取向性(圖 1B),平均接觸角約56.6°。鼠胚胎干細胞復蘇2 h后貼壁,細胞呈集落生長,第2 天開始集落趨于緊密,邊緣清晰明亮、鏡下觀察稍稍隆起,細胞小且排列緊密,細胞間沒有明顯的界限, 細胞核大,可見多個核仁(圖 2A)。 3 d后集落互相融合達到 60%以上,5 d可傳代(圖 2B)。
2.2 胚胎干細胞向牙上皮分化

A: 非取向; B: 取向
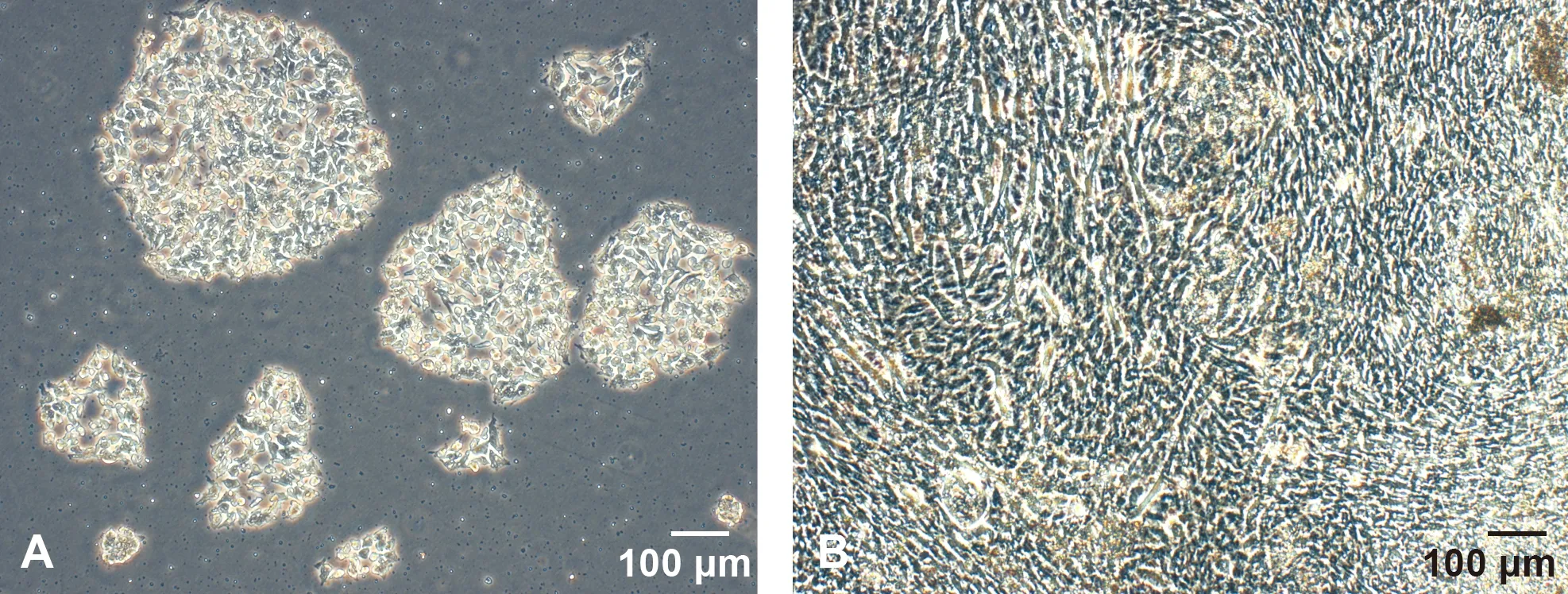
圖 2 培養中的mES細胞(倒置顯微鏡, ×100)
2.2.1 鼠胚胎干細胞向口腔外胚層分化 以每孔1×105個細胞接種于培養板, 1 d后支架材料組全部貼壁,掃描電鏡下細胞成團狀生長。第2 天有大量細胞呈放射狀從細胞團內爬出。第3 天有大量上皮樣細胞爬出。此后上皮樣細胞不斷增多(圖 3)。
2.2.2 外胚層相關基因的表達 誘導7 d后,PCR檢測干性基因及外胚層相關基因的表達水平,發現Oct4表達下降,細胞干性水平逐漸降低,表皮特異性基因K14在第3 天表達上調, 早期外胚層特異性基因K18表達在第3 天相對較低,第5 天表達上調。在第3天FGF8表達上調,并伴隨著BMP4高表達(圖 4)。
2.2.3 抑制BMP4的功能可誘導mES細胞向口腔外胚層分化 在第3 天向培養基內加入BMP4的抑制劑LDN193189(LDN),分別抑制不同的時長(24、 48 h),免疫熒光檢測口腔外胚層上皮特異性基因Pitx2的表達情況, 48 h組可見細胞團內出現了不同數量的Pitx2+細胞(圖 5),因此得出結論,抑制BMP4 48 h最有利于mES細胞向口腔外胚層分化。
2.2.4 短暫的外源性BMP4刺激可進一步誘導口腔外胚層細胞向牙上皮細胞分化 48 h后加入30 pmol外源性BMP4刺激,可見第1 組只能見到少量熒光,其余組均有一定的AMBN熒光出現(圖 6)。每組隨機選取35 個點進行熒光強度分析,結果顯示,第3 組AMBN表達明顯高于其它組(圖 6)。表明短暫的外源性BMP4刺激可促進mES細胞向牙上皮細胞分化。取向納米纖維支架材料較非取向納米纖維支架材料更有利于mES細胞向牙上皮細胞分化。
圖 3 胚胎干細胞分化過程中形態變化(倒置顯微鏡)
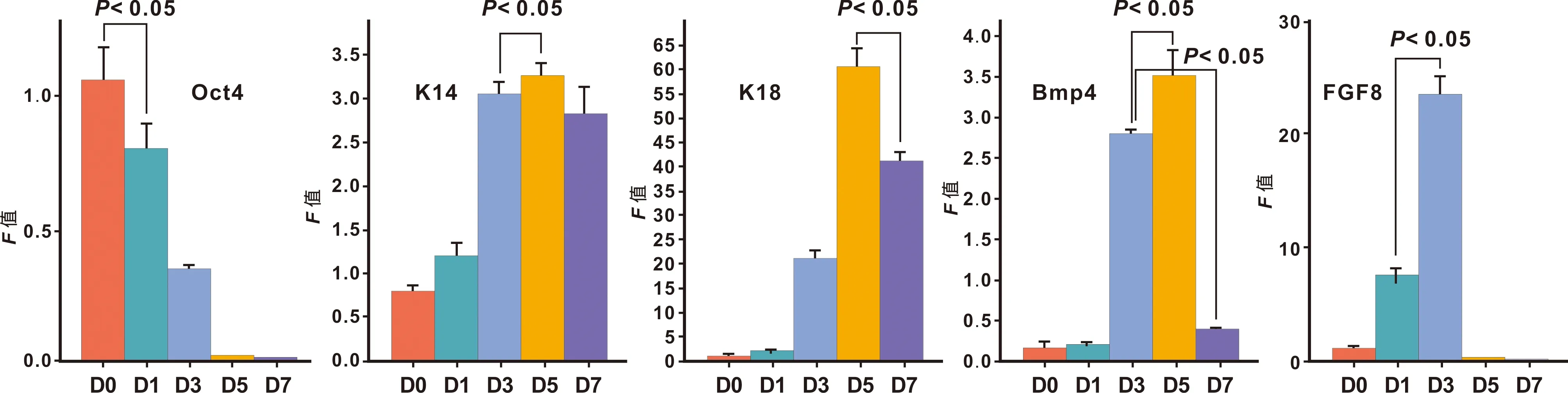
圖 4 外胚層相關基因的表達變化
3 討 論
本研究經過反復實驗,采用多種方式對鼠胚胎干細胞進行體外誘導,通過檢測早期外胚層特異性基因及表皮特異性基因,最終摸索出了一套能將鼠胚胎干細胞向牙上皮誘導的方案。用該方案誘導鼠胚胎干細胞,發現表皮特異性基因K14在第3 天表達上調,而早期外胚層特異性基因K18表達在第3 天相對較低,第5 天表達上調。同時在第3 天FGF8表達上調,并伴隨著BMP4高表達。這些現象表明第3 天mES開始向K14陽性的角化上皮分化,而第3 天FGF8表達很高,其基因的轉錄水平與鼠胚胎E 10.5 d的口腔上皮相似。然而不同的是此時BMP4表達亦很高,因此我們向培養基內加入LDN193189,抑制BMP4的功能,從而使FGF8相對處于優勢,有利于mES細胞向口腔外胚層分化,口腔外胚層細胞最終分化為成釉細胞。在牙齒發育過程中,牙釉質基質蛋白(Ameloblastin,AMBN),在維持成釉細胞的分化狀態中起著至關重要的作用。研究表明在Ameloblastin突變的小鼠中,成釉細胞很快失去極性,增殖,并形成了多個細胞層,最終導致牙釉質發育不全[14]。因此AMBN一直以來被作為成釉細胞分化的特異性標志物。當口腔外胚層細胞成功表達Pitx2后向培養基內加入外源性的BMP4,檢測成釉細胞標志性蛋白顯示有AMBN表達,表明在合適的時間點先抑制BMP4的功能, 繼而在合適的時間點加入外源性BMP4可誘導mES細胞向牙上皮方向分化。
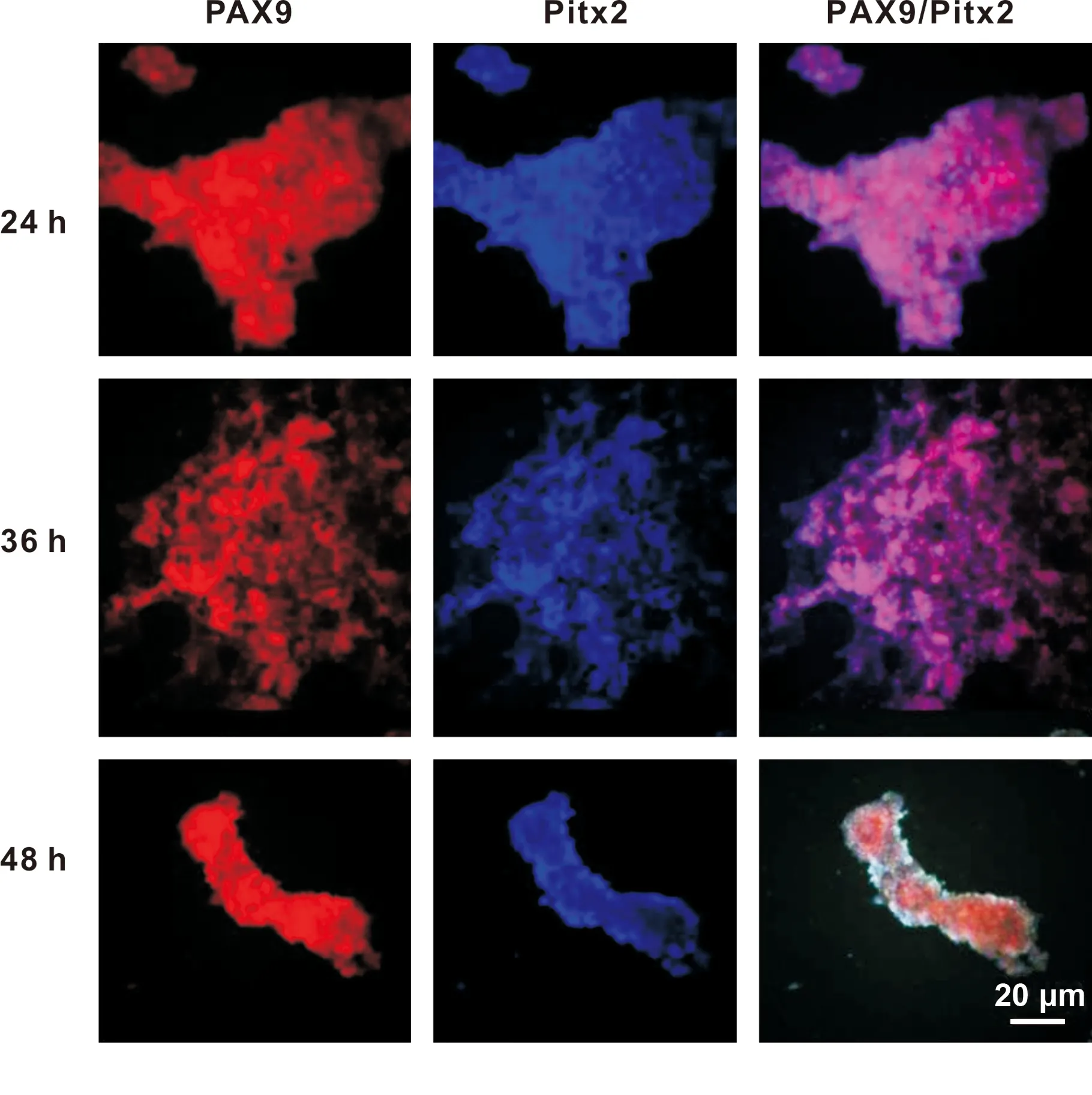
圖 5 Pitx2的表達
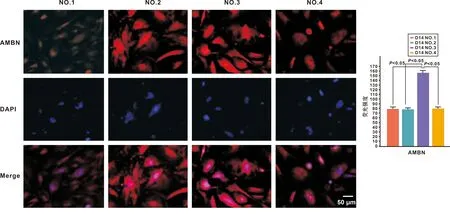
圖 6 AMBN免疫熒光圖
可見BMP4在鼠胚胎干細胞向牙上皮細胞分化過程中發揮了重要的作用。經典的Wnt/β-catenin信號途徑被認為在牙胚發育過程中發揮著重要作用。當Wnt信號被激活后,可抑制β-catenin的磷酸化,非磷酸化的β-catenin不會被水解并能進入細胞核內,啟動相關基因的轉錄[15-16]。BMP4是影響牙胚發生和發育最關鍵的因子, BMP4和Wnt信號通路在mES細胞向牙上皮細胞分化過程中參與方式有待于進一步研究。
該培養體系內引入了PLGA納米纖維,實驗結果表明取向性納米纖維更有利于鼠胚胎干細胞向牙上皮分化,推測可能是取向性納米纖維更類似于牙胚細胞外基質纖維排列。

