晚期上皮性卵巢癌、輸卵管癌、原發性腹膜癌患者新輔助化療后Ki-67表達與預后的相關性分析*
劉玥曦,令狐華
重慶醫科大學附屬第一醫院婦科,重慶 400016
卵巢癌病死率居婦科惡性腫瘤首位[1],其發病隱匿,大多數患者就診時已存在盆腔和腹腔的廣泛轉移[2],而輸卵管癌和原發性腹膜癌的臨床特點及診療方式均與卵巢癌相似,故通常將其共同研究[3]。晚期卵巢癌的標準治療方式為初始腫瘤細胞減滅術,術后輔以化療[4],對于手術風險高或難以獲得滿意減瘤效果的患者,新輔助化療后行間期腫瘤細胞減滅術具有與初始手術相似的療效,且術后并發癥發生率更低[5-6]。疾病分期、腫瘤組織學特點及手術結局是目前公認的與上皮性卵巢癌患者預后相關的重要影響因素[7-8],此外,Ki-67基因編碼的腫瘤增殖抗原作為一種增殖標志物,被認為是多種惡性腫瘤分類、治療反應和預后預測的臨床標志物[9-10]。近年來,越來越多試驗致力于研究Ki-67在卵巢癌患者預后中的作用,但只有很少的研究報道了新輔助化療后腫瘤組織Ki-67表達對卵巢癌患者預后的影響[9,11-13]。本研究通過回顧性分析本院新輔助化療聯合間期腫瘤細胞減滅術患者的臨床病理資料,探討Ki-67表達水平與晚期上皮性卵巢癌、輸卵管癌及原發性腹膜癌患者臨床病理特點及預后之間的關系,分析其評估接受新輔助化療的患者預后情況的價值,以期為患者的個體化診治提供參考。
1 資料與方法
1.1一般資料 選取2017年1月至2019年6月于本院就診,并首次經探查手術或腹腔穿刺獲得組織學或細胞學病理依據確診為國際婦產科聯合會(FIGO)Ⅲ/Ⅳ期惡性腫瘤患者,接受以紫杉醇聯合鉑類為基礎化療后完成間期腫瘤細胞減滅術,經術后病理學確診為上皮性卵巢癌、輸卵管癌或原發性腹膜癌,術后接受相同方案輔助化療,并在初始治療完成后通過門診、住院或電話規律隨訪的患者作為研究對象。排除標準:(1)治療過程中因個人因素放棄后續治療,或因疾病進展未行間期腫瘤細胞減滅術;(2)術后病理檢查提示為交界性或非上皮性腫瘤;(3)術后病理檢查提示為其他部位來源惡性腫瘤;(4)病歷資料不完善,缺乏研究所需的重要指標。共納入132例患者作為研究對象。年齡29~73歲,中位年齡53歲;95例為FIGO分期Ⅲ期;隨訪時間4.0~39.3個月,中位隨訪時間15.0個月;91例患者在隨訪中出現復發,4例在隨訪過程中失訪,失訪率為3.0%。患者的臨床病理資料見表1。本研究獲得重慶醫科大學生物醫學倫理委員會批準(NO.2020-674)。
1.2方法
1.2.1治療方法 自2017年1月起于本院首次經病理學確診的上皮性卵巢癌、輸卵管癌或原發性腹膜癌患者,經2位及以上婦科主任醫師綜合評估后無初始手術機會,接受紫杉醇聯合鉑類為基礎的新輔助化療。具體給藥方式:紫衫醇注射液175 mg/m2+順鉑90 mg/m2靜脈滴注或紫衫醇注射液175 mg/m2+卡鉑[劑量根據Calvet公式進行計算,其中曲線下面積(AUC)為5~6]靜脈滴注,每周期的第1天給藥,每21 d為1個周期。經臨床醫師綜合評估,術前接受1~6個周期新輔助化療。每周期新輔助化療后,結合臨床查體評估患者對化療藥物反應性及手術機會,有手術機會的患者在末次化療后3~6周內接受間期腫瘤細胞減滅術。手術由工作10年以上或有婦科四級腹腔鏡手術經驗的婦科腫瘤醫生參照美國國立綜合癌癥網絡(NCCN)指南進行。術后予以原方案補充化療至少3個周期,共化療至少6個周期。初治結束后每2~4個月對患者進行隨訪,包括癌譜、胸部、腹部、盆腔影像學檢查等,評估復發或轉移情況。在最后一次隨訪時確認患者的存活及疾病進展情況,包括癌癥進展或任何原因造成的死亡。

表1 患者的臨床病理信息
1.2.2Ki-67檢測方法 腫瘤細胞減滅術完成后采集標本,離體后30 min內采用甲醇固定,并送重慶醫科大學臨床病理部,HE染色后采用免疫組化S-P法檢測Ki-67表達情況。根據美國臨床腫瘤學會/美國病理學家學院(ASCO/CAP)指南,Ki-67定位于癌細胞核,陽性表達即細胞核有淡黃、棕黃或者棕褐色顆粒,Ki-67評分定義為惡性細胞總數中陽性染色細胞的百分比。
1.2.3臨床資料收集及相關定義 通過本院病歷系統回顧性收集患者的年齡、確診及首次治療日期、確診病理學依據、FIGO分期、新輔助化療方案及周期、間期腫瘤細胞減滅術記錄(手術方式、手術結局)、術后病檢報告等資料。通過門診、住院資料及電話隨訪患者生存情況。滿意的腫瘤細胞減滅術:術后殘瘤最大徑≤1 cm。疾病進展定義為任何影像學上出現的新發病灶或血清CA125水平持續上升至超過正常上限2倍。無進展生存期定義為初次接受治療到出現疾病進展或者發生任何原因的死亡之間的時間,若隨訪截止時患者仍未出現結局,則無進展生存期定義為首次治療到最后一次隨訪的日期。
1.3統計學處理 采用SPSS24.0和R-4.0.3統計軟件進行數據分析。偏態分布的計量資料采用M(P25,P75)表示,組間比較采用秩和檢驗。計數資料采用百分數表示,組間比較采用χ2檢驗或Fisher精確檢驗。繪制時間依賴的受試者工作特征曲線(ROC曲線),選取靈敏度和特異度相加最大時Ki-67值為判斷患者預后的最佳臨界值(cut-off值)。Kaplan-Meier法繪制生存曲線,對可能影響預后的臨床病理因素進行單因素COX回歸分析,有統計學意義的變量以及具有重要臨床意義的變量(如分期、腫瘤分級等)進入多因素COX回歸分析,得到與復發相關的獨立危險因素。以P<0.05為差異有統計學意義。
2 結 果
2.1Ki-67界值確定 時間依賴的ROC曲線分析結果顯示,判斷患者預后情況的Ki-67 cut-off值為20%(n=132,AUC=0.657,靈敏度=58.33%,特異度=70.83%,P=0.005)。
2.2Ki67與患者病理特征的關系 根據cut-off值將患者分為Ki-67<20%組和Ki-67≥20%組,患者年齡、原發部位、分期、病理學類型及手術結局在兩組中的分布差異無統計學意義(P>0.05)。而病理分級不同的患者腫瘤組織Ki-67水平差異有統計學意義(P=0.003)。Bonferroni法對檢驗水準進行校正后提示病理分級為3級的Ki-67≥20%患者比例高于病理分級為1/2級患者,差異有統計學意義(P<0.05)。見表2。

表2 Ki-67與患者臨床病理特征的關系[n(%)]
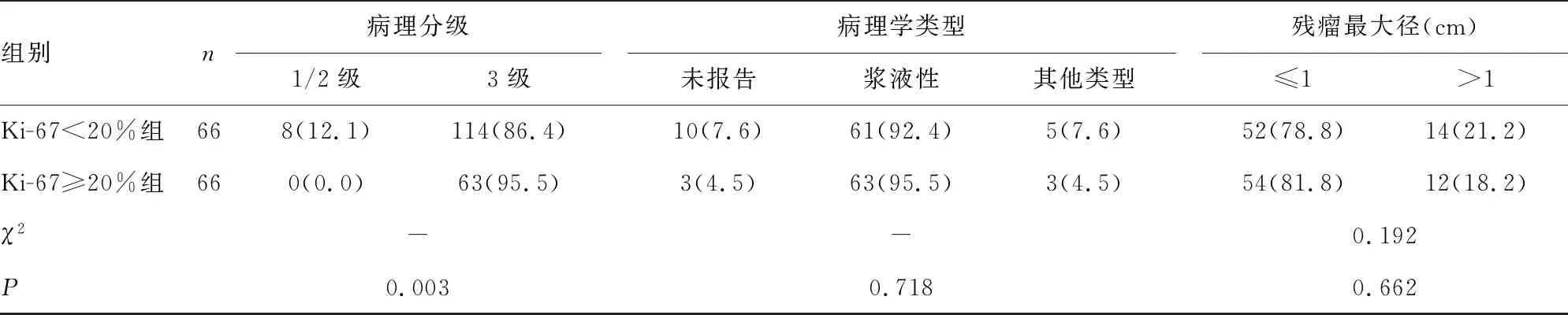
組別n病理分級1/2級3級病理學類型未報告漿液性其他類型殘瘤最大徑(cm)≤1>1Ki-67<20%組668(12.1)114(86.4)10(7.6)61(92.4)5(7.6)52(78.8)14(21.2)Ki-67≥20%組660(0.0)63(95.5)3(4.5)63(95.5)3(4.5)54(81.8)12(18.2)χ2--0.192P0.0030.7180.662
2.3Ki-67與患者預后之間的關系 Kaplan-Meier曲線,顯示Ki-67≥20%組和Ki-67<20%組中位無進展生存期分別為13.5個月和22.0個月。單因素COX分析顯示,兩組患者的無進展生存期比較,差異有統計學意義(P=0.002),且化療后Ki-67≥20%組無進展生存期較短。見圖1。此外,對患者其余臨床病理因素進行單因素分析,結果顯示原發部位、手術方式和手術結局與無進展生存期相關,見表3,進一步多因素COX回歸分析提示,在排除分期、腫瘤分級、原發部位、手術方式及手術結局等因素后,Ki-67水平為患者無進展生存期的獨立影響因素(P=0.004)。原發部位(P=0.006)和手術方式(P=0.012)也為影響患者預后的獨立危險因素。見表4。

表3 臨床病理因素與患者無進展生存關系的單因素回歸分析

續表3 臨床病理因素與患者無進展生存關系的單因素回歸分析
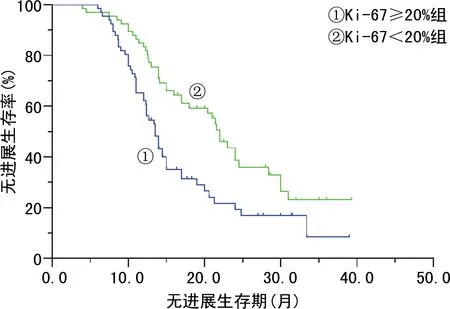
圖1 新輔助化療后不同Ki-67水平患者無進展生存期的Kaplan-Meier曲線分析

表4 臨床病理因素與患者無進展生存關系的多因素COX回歸分析
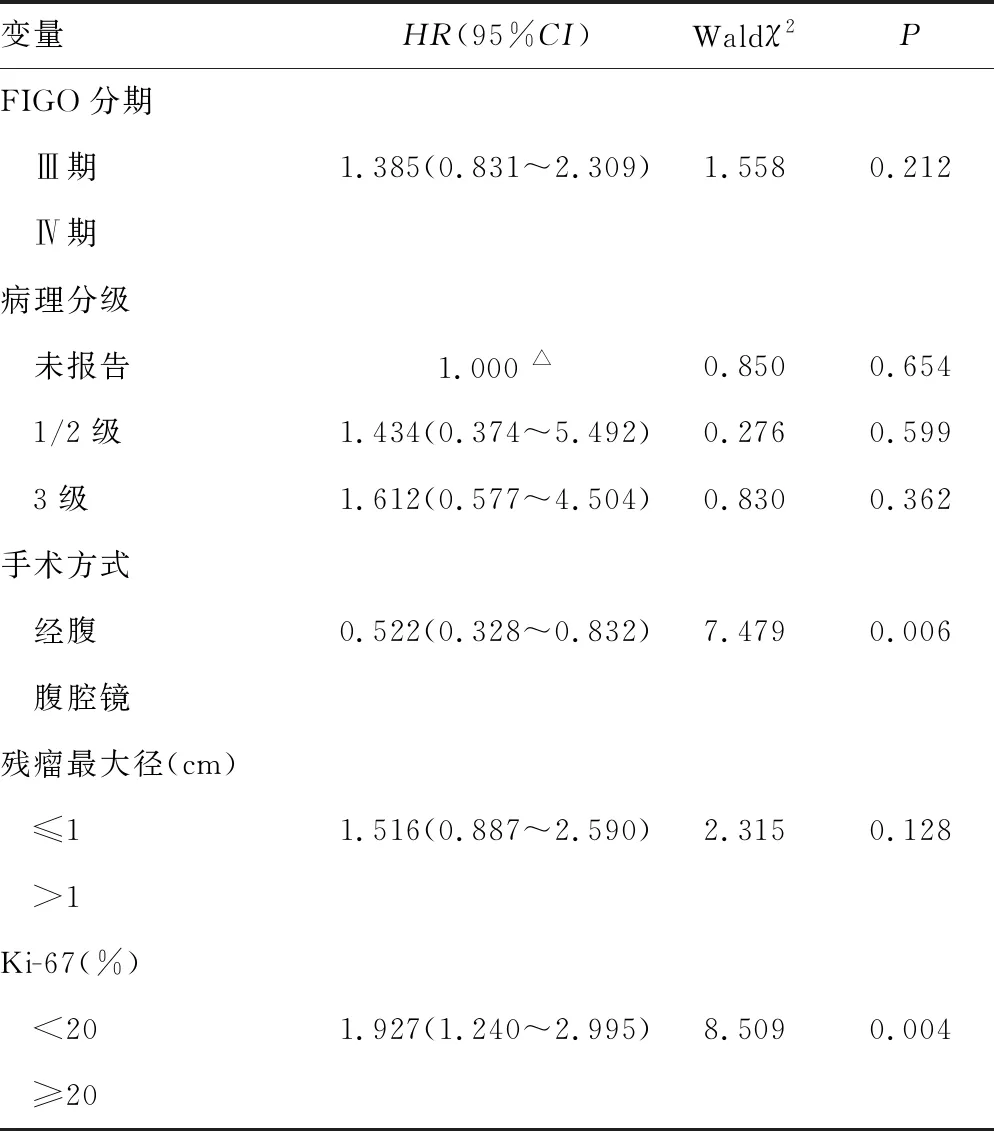
續表4 臨床病理因素與患者無進展生存關系的多因素COX回歸分析
3 討 論
卵巢癌發病隱匿,大多數患者在就診時已處于疾病晚期,預后差[14]。對于因合并癥風險高,或評估初次減瘤可能不滿意而不適宜立即手術的卵巢癌患者,新輔助化療后行間期腫瘤細胞減滅術不僅同樣有效[15],而且更為安全[16-21]。盡管大部分患者對初始治療反應良好,但只有10%~30%的患者可獲得長期生存,多數患者會在兩年內出現復發[22]。因此,對復發危險因素進行研究對評估疾病預后具有重要意義。
Ki-67是一種核蛋白,表達于所有活躍的細胞周期階段。Ki-67表達水平在G1期及S期早期較低,S期及G2期表達急劇增加,M期達到峰值,隨后在細胞分裂后期和末期表達量迅速下降,且Ki-67半衰期短,細胞脫離增殖周期后迅速降解。上述特點使Ki-67成為良好的細胞增殖標志物,針對腫瘤組織Ki-67進行免疫組織化學檢測是一項簡單可行的輔助檢查,可以增加重要的預后價值,目前廣泛應用于評估腫瘤的惡性程度及其治療及預后效果的判斷[23]。
然而,有研究表明高水平Ki-67與患者不良預后相關[11],也有研究提示Ki-67升高的患者預后更好[12]。在不同研究中這些矛盾的結論阻礙了Ki-67表達在卵巢癌患者預后中的臨床應用。有學者認為具有較高增殖能力的腫瘤預后往往也較差,然而,腫瘤的增殖指數越高,對大多數化療藥物的敏感性就越高[24]。此外,腫瘤的治療是一個動態的過程,不同患者的腫瘤增殖水平及對化療的敏感性等都可能在治療過程中動態改變,這可能導致了不同試驗結果的差異。VON MINCKWITZ等[25]進行的一項試驗提示,相較使用于治療前Ki-67水平或輔助化療引起Ki-67水平變化對患者預后進行評估,Ki-67在化療后的水平更能反映患者預后。
目前,部分研究報道了新輔助化療后Ki-67水平對卵巢癌患者預后的影響,結果均提示化療后高水平Ki-67與不良預后顯著相關[26-27]。并且由于評估方法的差異,Ki-67臨界值在不同試驗中各不相同,本研究分析了新輔助化療后Ki-67水平與患者臨床病理因素及預后的關系,發現Ki-67≥20%組患者中腫瘤病理分級為3級者的比例明顯較高,而患者年齡、原發部位、FIGO分期、病理學類型及殘瘤最大徑在不同Ki-67表達水平的兩組患者中差異無統計學意義(P>0.05)。單因素分析顯示,Ki-67≥20%的患者,其無進展生存期也短于Ki-67<20%患者(P=0.002)。此外,多因素COX回歸分析進一步表明Ki-67水平是影響患者無進展生存期的獨立影響因素(P=0.004),提示新輔助化療后Ki-67≥20%與患者不良預后相關,可能傾向于早期復發。
同時,治療后Ki-67水平高的患者提示當前的一線化療方案抗腫瘤效應的有限性,針對這類患者,可以在術后采用個體化的治療方案,如適度延長化療療程、調整化療方案、加用靶向藥物等,以期延長患者的疾病無進展生存時間及總生存時間。
本研究有以下局限性,首先本研究為單中心、回顧性研究,樣本量相對較小,結果可能受混雜因素影響;其次,由于隨訪時間相對較短,難以評估總生存期是否存在差異;此外,Ki-67在整個腫瘤中的內源表達也分布不均,單一樣本可能不能完全反映腫瘤的異質性[28]。本研究中Ki-67的表達是使用術后病理組織標本進行評估的,多部位取材并計算平均結果可能會減少這種差異。因此,Ki-67在卵巢癌患者預后中的預測價值尚需前瞻性隨機對照試驗進行驗證。由于輸卵管癌及原發性腹膜癌發病率明顯低于卵巢癌,本研究中輸卵管癌共14例,原發性腹膜癌共15例,在樣本量限制下統計學意義有限,可在未來進一步擴大樣本量的情況下針對輸卵管癌及原發性腹膜癌患者中該指標的預后意義進行進一步研究。

