灰飛虱共生真菌P450過量表達介導的吡蟲啉抗藥性
張月亮 劉寶生 王利華

摘要:昆蟲共生菌廣泛參與寄主昆蟲抗藥性的形成,但對其抗性產生的分子機制的研究相對較少。本研究首先在室內敏感品系基礎上建立了灰飛虱抗、感吡蟲啉品系,利用現有灰飛虱轉錄組數據庫,序列驗證并定量分析了15條灰飛虱共生真菌P450基因,與敏感品系相比,發現其中10條P450基因在吡蟲啉抗性品系中顯著過量表達(LsSFP450-2、LsSFP450-8、LsSFP450-14、LsSFP450-12、LsSFP450-4、LsSFP450-5、LsSFP450-10、LsSFP450-7、LsSFP450-15、LsSFP450-9),由此推斷灰飛虱共生真菌P450解毒代謝途徑同樣是介導吡蟲啉抗藥性的潛在因子,此結果為宿主共生菌介導殺蟲劑抗性研究及田間害蟲有效化學防控提供了新理論視角。
關鍵詞:灰飛虱;共生真菌;P450;吡蟲啉;過量表達;抗藥性
殺蟲劑抗藥性是威脅糧食安全生產的重要難題,解析殺蟲劑抗藥性機制是化解抗性難題的重要理論依據。殺蟲劑抗性機制主要包括解毒代謝抗性和靶標抗性,解毒基因過量表達或突變致使代謝殺蟲劑能力增強是解毒代謝抗性的主要表現形式,已知的解毒代謝基因主要包括脂酶,谷胱甘肽-S-轉移酶,細胞色素P450多功能氧化酶 [1-4];靶標抗性涉及靶標基因突變,殺蟲劑結合靶標能力減弱是導致害蟲產生高水平抗藥性的主因。不同類型的殺蟲劑具有不同的作用靶標,目前研究發現殺蟲劑靶標主要包括有機磷和氨基甲酸酯類殺蟲劑靶標乙酰膽堿脂酶,環戊二烯類殺蟲劑靶標γ-氨基丁酸(GABA)受體,雙酰胺類殺蟲劑靶標魚尼丁受體,苯甲酰脲類殺蟲劑靶標幾丁質合成酶,新煙堿類殺蟲劑靶標乙酰膽堿受體,菊脂類殺蟲劑靶標鈉離子通道等[5-11]。
昆蟲體內棲息多種共生菌,這些共生菌與宿主昆蟲形成了和諧的相互依存關系,宿主共生菌不僅能為寄主昆蟲提供必要營養,還能調控昆蟲自身免疫。近年來研究表明,多種共生菌廣泛參與宿主昆蟲對殺蟲劑的抗性,但目前為止,對于共生菌介導的昆蟲抗性分子機制研究相對較少 [12-15]。
灰飛虱是一種重要的水稻害蟲,其不僅能通過刺吸危害,還能傳播多種病毒病,對灰飛虱進行有效防控尤其是減緩殺蟲劑抗性產生已成為水稻安全生產的重要環節[16-19]。吡蟲啉是一種重要的新煙堿類殺蟲劑,其對稻飛虱具有優異的殺蟲活性,但抗性監測表明稻飛虱已對其產生不同程度的抗藥性[20-21]。本研究首先建立灰飛虱抗、感吡蟲啉品系,然后檢測灰飛虱體內幾種共生真菌P450基因在灰飛虱抗、感吡蟲啉品系間的表達情況,此結果將為昆蟲共生菌介導的殺蟲劑抗性研究提供重要依據。
1 材料與方法
試驗時間: 2016年1月至2019年12月,地點:江蘇省農業科學院植物保護研究所。
1.1 供試昆蟲
灰飛虱云南敏感品系(YN)于2001年采自云南省楚雄市,室內不接觸任何殺蟲劑飼養至今,吡蟲啉抗性品系(YN-IMR)以云南敏感品系為材料,經過63代的不連續篩選,選擇2 500頭3齡若蟲,保持大約70%死亡率的殺蟲劑篩選壓力。所有試蟲在人工氣候室溫度: 26 ℃,光周期:14 h光照、10 h黑暗中采用武運粳7號稻苗飼養。
1.2 生物測定
藥劑配制:吡蟲啉原藥用N,N-二甲基甲酰胺配制成母液(含10%曲拉通X-100)。吡蟲啉母液兌水稀釋配成供試藥液。生物測定方法——浸苗法[19]:采用武運粳7號水稻依次浸種、催芽、播種至幼苗長至約15 mm高,每次重復用4根15 mm高稻苗浸泡吡蟲啉藥液30 s,然后晾干5 min,用鑷子取出放入做好標記對應的塑料杯中,用濕潤無菌紙包裹稻苗根部,并確保底部無積水,采用吸蟲器吸取3齡若蟲灰飛虱15頭轉移至藥液處理過的稻苗中,每個處理共計4個重復,用紗布和橡皮筋把杯口封牢,所有試蟲在溫度為26 ℃,光周期為14 h光照、10 h黑暗中飼養,于 120 h 后統計死亡率(注意稻苗根部保濕,確保無積水)。
1.3 RNA提取和定量分析
總 RNA 的提取參照 Promega的SV Total RNA Isolation System試劑盒說明書進行,提取的總RNA用1%瓊脂糖凝膠電泳和微量分光光度計 (Eppendorf BioPhotometer Plus) 檢測其質量和濃度,RNA樣品于-80 ℃保存, cDNA合成參照TaKaRa的PrimeScript RT Master Mix (Perfect Real Time) 試劑盒說明書進行。反應體系包括500 ng總RNA,2 μL 5×反轉錄緩沖液 (PrimeScript RT Master Mix),用無RNA酶水補充至總體積為10 μL,混樣在PCR儀中37 ℃溫育30 min,85 ℃滅活10 s,qPCR以 β-actin(AY192151.1)為內參[4],取1 μL稀釋20倍的 cDNA為模板,分別加入10 μL Taq 酶預混液(SYBR Premix Ex TaqTM)、0.4 μL RoxTM參比染料(ROX Reference Dye)(50×)和0.4 μL 10 μmol/L 上游和下游引物,補充無菌水至總體積為20 μL。qPCR程序為95 ℃預變性30 s;95 ℃ 5 s、60 ℃ 31 s,40個循環;最后進行溶解曲線擴增。
1.4 數據分析
生物測定數據采用 PoloPlus 軟件分析,根據致死中濃度(LC50,mg/L),共生真菌P450基因相對表達量的計算采用 2-ΔΔCT 法[22]。以敏感品系為對照,比較灰飛虱抗、感吡蟲啉品系中不同真菌P450相對表達量,結果分析均采用SPSS 19.0,統計分析采用Students T-test,分別在0.05和0.01水平上進行差異顯著性分析。
2 結果與分析
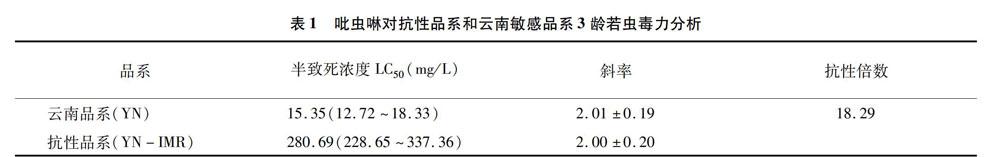
2.1 灰飛虱抗吡蟲啉品系抗性倍數
毒力分析顯示灰飛虱抗吡蟲啉品系LC50為28069 mg/L, 灰飛虱云南敏感品系的LC50為 15.35 mg/L,根據抗性倍數計算公式: 抗性倍數=抗性品系LC50 /敏感品系LC50,即280.69 /15.35=18.29倍(表1)。
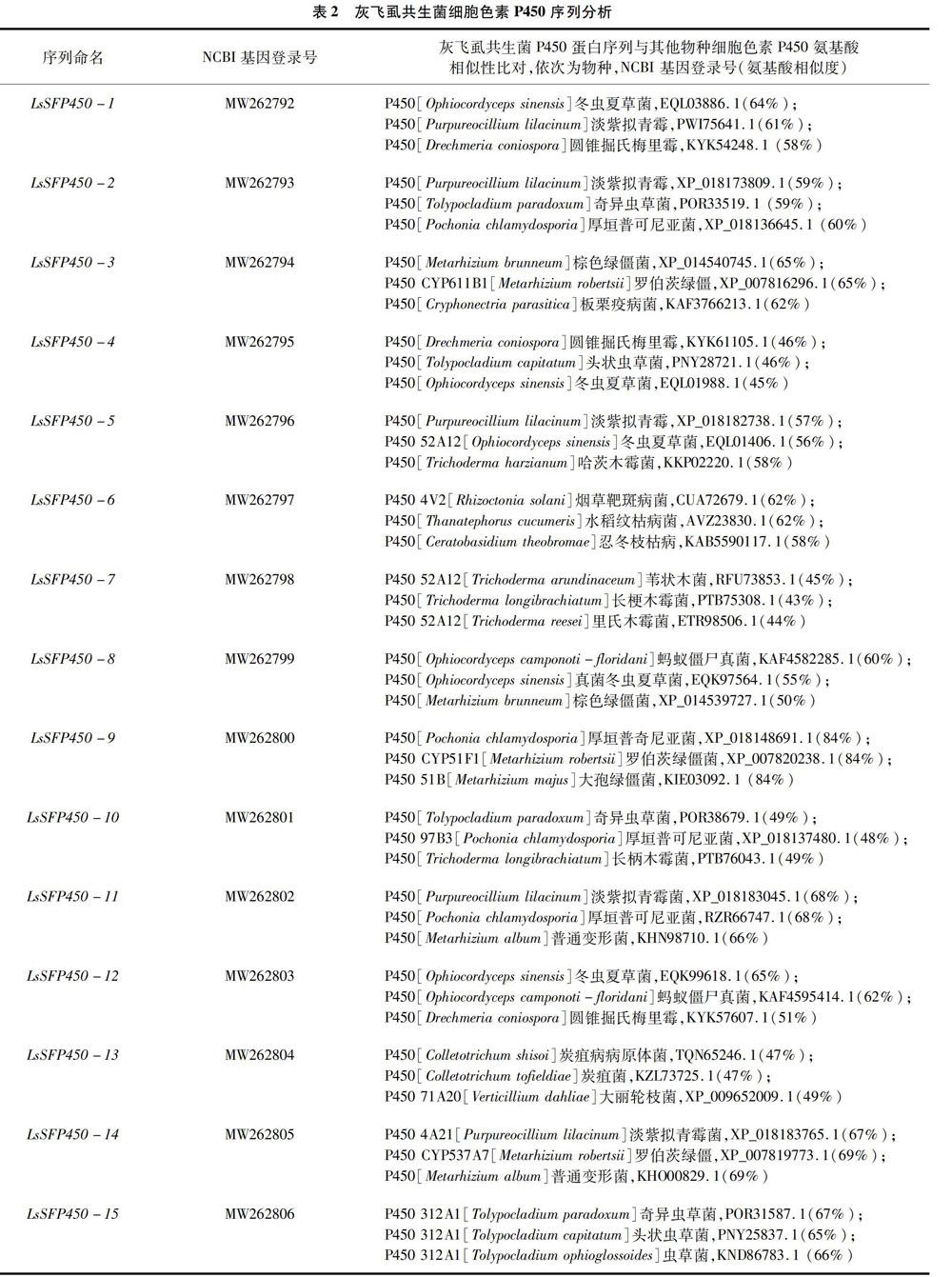
2.2 灰飛虱共生菌P450序列分析
根據灰飛虱轉錄組數據庫,通過NCBI序列比對和分析,共計發現15條灰飛虱共生真菌P450基因,并將這些共生真菌P450序列提交NCBI數據庫,氨基酸序列比對發現其和已發表的真菌P450序列具有較高的氨基酸相似性,序列信息詳見表2。
2.3 灰飛虱抗、感吡蟲啉品系間共生菌P450表達分析
與敏感品系相比,15條共生真菌P450基因中,發現10條灰飛虱共生真菌P450呈現顯著性或極顯著性過量表達(圖1),由此說明,過量表達的共生真菌P450解毒代謝與灰飛虱抗吡蟲啉的發生存在潛在聯系,灰飛虱共生真菌P450定量引物見表3。
3 討論與結論
昆蟲共生菌介導的殺蟲劑抗性一般涉及3種途徑: 一是共生菌通過增加寄主免疫力來抵抗殺蟲劑的毒力脅迫; 二是共生菌通過自身的解毒代謝酶分解殺蟲劑為無毒代謝物從而減弱對宿主的危害;三是共生菌通過調控宿主解毒代謝因子來增強殺蟲劑抗性[23-26]。
細胞色素P450多功能氧化酶是一種廣譜的解毒代謝酶,其廣泛參與昆蟲抗藥性,昆蟲細胞色素P450活性增加導致其抗藥性水平升高的研究相對較多[3, 27-31],盡管前期筆者所在課題組也發現多個灰飛虱P450過量表達與吡蟲啉抗性相關[31],在灰飛虱轉錄組數據庫中筆者所在課題組同樣鑒定出15條共生菌真菌P450基因,定量分析發現其中10條真菌P450基因在灰飛虱對吡蟲啉的抗性品系中同樣呈現顯著過量表達,由此說明共生真菌解毒代謝途徑也是介導灰飛虱抗吡蟲啉的潛在作用因子。此外,本研究所用的灰飛虱抗吡蟲啉品系源于室內連續飼養多年的云南敏感品系,在此基礎上建立的吡蟲啉抗、感品系具有相似的遺傳背景,在一定程度上消除了田間復雜的殺蟲劑抗性背景,也使得利用此抗性、敏感品系進行抗性分子機制研究更具說服力。本研究首次揭示了宿主共生菌P450過量表達與灰飛虱抗吡蟲啉直接相關,此結果豐富了共生菌參與宿主殺蟲劑的抗性研究內容,為新藥創制及田間害蟲抗性治理提供依據。
參考文獻:
[1]Giraudo M,Unnithan G C,le Goff G,et al. Regulation of cytochrome P450 expression in Drosophila:genomic insights[J]. Pesticide Biochemistry and Physiology,2010,97(2):115-122.
[2]Xu Z B,Zou X P,Zhang N,et al. Detoxification of insecticides,allechemicals and heavy metals by glutathione S-transferase SlGSTE1 in the gut of Spodoptera litura[J]. Insect Science,2015,22(4):503-511.
[3]Zhang Y L,Guo H F,Yang Q,et al. Overexpression of a P450 gene (CYP6CW1) in buprofezin-resistant Laodelphax striatellus (Fallén)[J]. Pesticide Biochemistry and Physiology,2012,104(3):277-282.
[4]Zhang Y L,Wang L H,Guo H F,et al. A transcriptome-based screen of carboxylesterase-like genes that are involved in chlorpyrifos resistance in Laodelphax striatellus (Fallén)[J]. Pesticide Biochemistry and Physiology,2012,104(3):224-228.
[5]Liu Z,Williamson M S,Lansdell S J,et al. A nicotinic acetylcholine receptor mutation conferring target-site resistance to imidacloprid in Nilaparvata lugens (brown planthopper)[J]. Proceedings of the National Academy of Sciences,2005,102(24):8420-8425.
[6]Nakao T,Kawase A,Kinoshita A,et al. The A2′ N mutation of the RDL γ-aminobutyric acid receptor conferring fipronil resistance in Laodelphax striatellus(Hemiptera:Delphacidae)[J]. Journal of Economic Entomology,2011,104(2):646-652.
[7]Ranson H,Jensen B,Vulule J M,et al. Identification of a point mutation in the voltage-gated sodium channel gene of Kenyan Anopheles gambiae associated with resistance to DDT and pyrethroids[J]. Insect Molecular Biology,2000,9(5):491-497.
[8]Suzuki Y,Shiotsuki T,Jouraku A,et al. Benzoylurea resistance in western flower thrips Frankliniella occidentalis (Thysanoptera:Thripidae):the presence of a point mutation in chitin synthase 1[J]. Journal of Pesticide Science,2017,42(3):93-96.
[9]Troczka B,Zimmer C T,Elias J,et al. Resistance to diamide insecticides in diamondback moth,Plutella xylostella (Lepidoptera:Plutellidae) is associated with a mutation in the membrane-spanning domain of the ryanodine receptor[J]. Insect Biochemistry and Molecular Biology,2012,42(11):873-880.
[10]Zhang Y L,Li S,Xu L,et al. Overexpression of carboxylesterase-1 and mutation (F439H) of acetylcholinesterase-1 are associated with chlorpyrifos resistance in Laodelphax striatellus[J]. Pesticide Biochemistry and Physiology,2013,106(1/2):8-13.
[11]Zhang Y L,Han Y C,Yang Q,et al. Resistance to cycloxaprid in Laodelphax striatellus is associated with altered expression of nicotinic acetylcholine receptor subunits[J]. Pest Management Science,2018,74(4):837-843.
[12]Douglas A E. The B vitamin nutrition of insects:the contributions of diet,microbiome and horizontally acquired genes[J]. Current Opinion in Insect Science,2017,23:65-69.
[13]Vilcinskas A. Evolutionary plasticity of insect immunity[J]. Journal of Insect Physiology,2013,59(2):123-129.
[14]Gressel J. Microbiome facilitated pest resistance:potential problems and uses[J]. Pest Management Science,2018,74(3):511-515.
[15]Pang R,Chen M,Yue L,et al. A distinct strain of Arsenophonus symbiont decreases insecticide resistance in its insect host[J]. PLoS Genetics,2018,14(10):e1007725.
[16]周益軍,劉海建,王貴珍,等. 灰飛虱攜帶的水稻條紋病毒免疫檢測[J]. 江蘇農業科學,2004,32(1):50-51.
[17]陳思宏,程兆榜,馬學文,等. 江蘇和云南地區水稻條紋葉枯病流行差異分析[J]. 江蘇農業科學,2013,41(3):88-90.
[18]李 碩,王世娟,訾金燕,等. 灰飛虱從離體病葉快速獲得水稻條紋病毒的方法[J]. 江蘇農業學報,2014,30(2):449-451.
[19]王利華,方繼朝,劉寶生. 幾類殺蟲劑對灰飛虱的相對毒力及田間種群的抗藥性現狀[J]. 昆蟲學報,2008,51(9):930-937.
[20]潘以樓,陳嘯寅,朱桂梅,等. 鎮江地區褐飛虱種群對吡蟲啉的抗藥性及其治理[J]. 江蘇農業科學,2008,36(4):122-123.
[21]Liu Z W,Han Z J,Wang Y C,et al. Selection for imidacloprid resistance in Nilaparvata lugens:cross-resistance patterns and possible mechanisms[J]. Pest Management Science,2003,59(12):1355-1359.
[22]Livak K J,Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods,2001,25(4):402-408.
[23]Xia X M,Zheng D D,Zhong H Z,et al. DNA sequencing reveals the midgut microbiota of diamondback moth,Plutella xylostella (L.) and a possible relationship with insecticide resistance[J]. PLoS One,2013,8(7):e68852.
[24]Kikuchi Y,Hayatsu M,Hosokawa T,et al. Symbiont-mediated insecticide resistance[J]. Proceedings of the National Academy of Sciences,2012,109(22):8618-8622.
[25]李 娜,陳建明,張玨鋒,等. 褐飛虱共生菌抗感吡蟲啉菌株體內抗氧化酶活性的比較[J]. 植物保護學報,2011,38(3):258-264.
[26]Cai T W,Zhang Y H,Liu Y,et al. Wolbachia enhances expression of NlCYP4CE1 in Nilaparvata lugens in response to imidacloprid stress[J]. Insect Science,2020,28(2):12834.
[27]Balabanidou V,Kampouraki A,MacLean M,et al. Cytochrome P450 associated with insecticide resistance catalyzes cuticular hydrocarbon production in Anopheles gambiae[J]. Proceedings of the National Academy of Sciences,2016,113(33):9268-9273.
[28]Liu N N,Li M,Gong Y H,et al. Cytochrome P450s-their expression,regulation,and role in insecticide resistance[J]. Pesticide Biochemistry and Physiology,2015,120:77-81.
[29]Feyereisen R. Insect P450 inhibitors and insecticides:challenges and opportunities[J]. Pest Management Science,2015,71(6):793-800.
[30]王靈軍,葉昌林,鄭明輝,等. 細胞色素 P450 介導的果蠅抗藥性研究進展[J]. 基因組學與應用生物學,2019(3):1304-1309.
[31]Zhang Y C,Liu B S,Zhang Z C,et al. Differential expression of P450 genes and nAChR subunits associated with imidacloprid resistance in Laodelphax striatellus (Hemiptera:Delphacidae)[J]. Journal of Economic Entomology,2018,111(3):1382-1387.常晨晨,王曉莉,朱紅艷,等. 設施內不同施肥處理對辣椒生長及土壤養分的影響[J]. 江蘇農業科學,2021,49(3):110-115.

