養殖密度對長江鱘幼魚生長的影響
顏濤 龍治海 趙鳳麒

摘要:本研究旨在揭示不同養殖密度對長江鱘幼魚生長情況的影響,為現階段長江鱘幼魚的人工飼養密度提供一定的技術指導。設置2.45(D20)、4.96(D40)、7.08(D60)、9.64 kg/m3(D80)等4個初始密度,分析14、28 d后長江鱘幼魚餌料轉化率(FCR)、特定生長率(SGRL和SGRW)、日增質量率(DWG)、肥滿度(K)以及變異系數(CVL和CVW)等生長參數差異。D20和D40組餌料轉化率、特定生長率、日增質量率均顯著高于D60和D80組,而D20組的肥滿度顯著低于D60和D80組;各密度組的特定生長率、餌料轉化率隨養殖時間延長而降低,但各組間變異系數卻隨養殖時間的延長而變大。考慮到產量、收益以及種間均勻度,本階段長江鱘幼魚適宜的養殖密度為4.96 kg/m3。
關鍵詞:養殖密度;長江鱘;特定生長率;變異系數;餌料轉化率
長江鱘(Acipenser dabryanus Dumeril)別稱達氏鱘,是長江上游一種特有的本土淡水魚類,也是19世紀90年代以前長江上游主要的經濟捕撈魚類之一[1-2]。近幾十年來,由于過度的捕撈,長江鱘的野外種群數量急劇下降[3-4]。1996年,長江鱘被列入世界自然保護聯盟(IUCN)紅色名錄,并禁止捕撈其野外種群[5]。然而,由于環境的破壞以及污染,其種群數量仍在進一步減少[3,5]。為保護這一長江特有魚類,自20世紀70年代起,水產科研工作者通過捕撈野外親本,在長江鱘的人工繁殖技術方面開展了大量的前期工作,至21世紀初,長江鱘人工繁殖已初步取得成功[6]。養殖密度作為水產養殖重要的環境因子之一,會直接影響養殖魚類的生長。探索長江鱘幼魚適宜的養殖密度可提高養殖產量和收益。以往的研究主要集中在長江鱘的疾病[4]、遺傳多樣性[7]以及基因組[8]等方面,而關于長江鱘的人工養殖方面探究甚少。本研究探索不同初始密度同一生長階段以及同一初始密度不同生長階段長江鱘幼魚生長參數的差異,探究現階段長江鱘幼魚的適宜養殖密度,以期為長江鱘的規模化養殖提供理論依據。
1 材料與方法
1.1 試驗材料
試驗于2019年6月在四川省農業科學院水產研究所宜賓基地進行,選用平均體長為(12.04±040) cm、平均體質量為(7.09±0.52) g的健康試驗魚,養殖在圓柱形的平底玻璃缸(半徑為0.3 m,高1.0 m)中,水深0.3 m,每缸設置1個進水口和1個中心出水口,進水口流量為3.5×10-5 m3/s。試驗用水為曝氣24 h以上的自來水,24 h不間斷充氧,溶氧量為(7.19±0.29) mg/L,溫度為(23.68±0.05) ℃,pH值為8.07±0.08。
1.2 試驗方法
試驗設計初始密度分別為20(D20,2.45 kg/m3)、40(D40,4.96 kg/m3)、60(D60,7.08 kg/m3)、80尾/缸(D80,9.64 kg/m3)等4個密度組,每個密度組設3次重復。每天投喂2次,分別在09:00和17:00進行,每次投喂約魚總體質量70%的水蚯蚓,并記錄投喂量。每隔14 d測量1次各缸長江鱘的體質量和體長。
1.3 數據分析
試驗數據用平均值±標準誤表示,采用Excel 2003和SPSS 22.0統計軟件進行處理和分析,利用方差分析(One-way ANOVA)進行顯著性檢驗,用Duncans多重比較檢驗養殖密度對長江鱘生長性能的影響,P<0.05表示差異顯著。
2 結果與分析
2.1 養殖密度對長江鱘幼魚的生長性能的影響
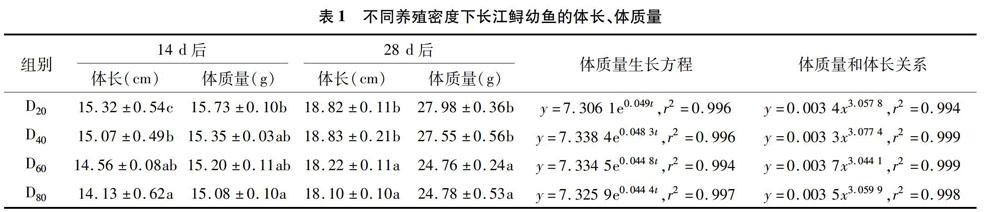
試驗期間,各密度組的長江鱘幼魚未發現死亡現象,對長江鱘幼魚的存活未造成顯著影響。開始階段,各密度組體質量、體長均無顯著性差異。由表1可知,14 d后,D20組體長顯著高于其余3組,D40組顯著高于D80組;D20組體質量顯著高于D80組。28 d后,D20組和D40組體長和體質量均顯著高于D60組和D80組。
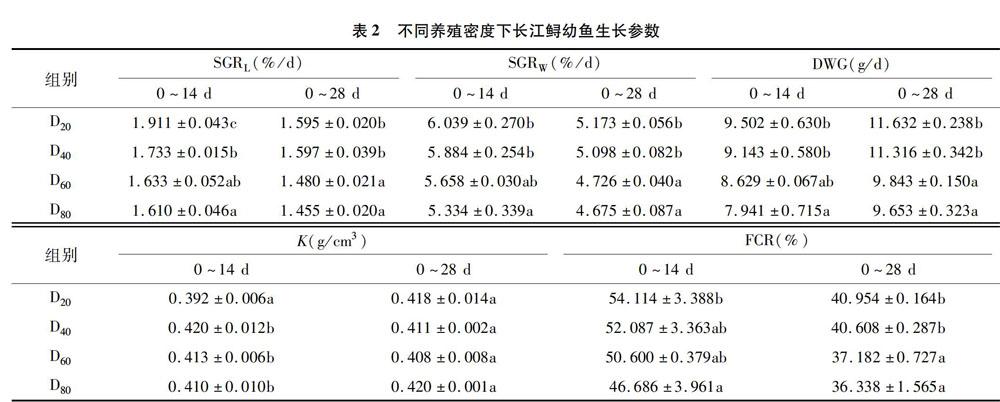
由表2可知,0~14、0~28 d低密度組(D20和D40組)長江鱘幼魚的SGR、DWG、FCR等生長參數均優于高密度組(D60和D80組)。0~14 d,D20組的SGRL均顯著大于其余3組,其FCR顯著大于D80組;D20和D40組的SGRW、DWG顯著大于D80組;而D20的肥滿度顯著低于其余3組。0~28 d,D20和D40組的SGRW、SGRL、DWG和FCR均顯著大于D60和D80組;各組肥滿度無顯著性差異。0~28 d各密度組的SGRL、SGRW和FCR等生長參數均較0~14 d有所下降,而DWG有所增加。其中,SGRL分別降低了0.316%/d、0.136%/d、0.153%/d和0155%/d;SGRW分別降低了0.866%/d、0.786%/d、0.932%/d、0.659%/d;FCR分別降低了13.160、11.479、13418、10.348百分點;DWG分別增加了2.130、2173、1.214、1.712 g/d。結果表明,長江鱘幼魚的生長受到養殖密度和生長階段的影響。
2.2 養殖密度對長江鱘幼魚生長離散的影響
由表3可知,養殖密度對長江鱘幼魚的體長和體質量變異系數均有顯著影響。0~14 d,D20組的體長變異系數顯著大于其余3組,體質量變異系數顯著大于D40組。0~28 d,D40組的體長變異系數顯著小于D20和D60組,D20組的體質量變異系數顯著大于D40和D80組。同時,隨著養殖時間的延長,各組體長和體質量變異系數均有不同程度增加。其中,體長變異系數分別增加了0.912、0.548、2.359、1703百分點;體質量變異系數分別增加了4.681、4.439、3.369、2.46百分點。結果表明,養殖密度顯著改變了長江鱘幼魚的均勻生長。
3 討論與結論
養殖密度是影響水產動物生長、存活和產量的一個關鍵因子,已有眾多關于養殖密度與經濟魚類生長的研究報道[9-11]。本研究發現,低密度組(D20和D40組)的SGR、DWG、K和FCR等生長參數均優于高密度組(D60和D80組),這與Tolussi等的研究結果[12-15]是一致的。高密度養殖能夠增加水體利用率,但會導致種內對空間和食物的競爭,同時,增加的密度會改變魚類代謝和行為相關的免疫應答和生理進程[16-19]。Ardiansyah等發現,盲曹魚(Lates calcarifer)血清中皮質醇、葡萄糖和乳酸含量隨著養殖密度增加而明顯升高[20];同時,相關研究也發現高密度組盲曹魚血清中升高的皮質醇、葡萄糖和乳酸含量也與緩慢的生長、升高的食物轉換率有關[21-22]。另外,0~28 d所有密度組的SGR、FCR均小于0~14 d。相似的,厚唇灰鯔(Chelon labrosus)幼魚出膜0~75 d階段的FCR顯著低于出膜0~45 d階段[23]。因此,根據本研究結果可以得出,養殖密度和生長階段2個因素均可直接影響長江鱘幼魚的生長。
以往研究表明,種內的個體變異系數受到養殖密度的影響[24-25]。本研究發現,整個試驗期間長江鱘個體體長和體質量變異系數均受到養殖密度的顯著影響,表明養殖密度會引起種內個體均勻度的差異,這主要是由于種內不同等級水平的建立[26]。然而,一些種類在不同密度時卻能均勻地生長,例如尖齒胡鯰(Calarios gariepinus)[27]、歐洲舌齒鱸(Dicentrarchus labrax)[28]、北美牙鲆(Paralichthys californicus)[29]等。大多數學者認為個體變異系數取決于多種因素,其中物種的行為和養殖密度是主要的影響因素。因此,本研究結果表明,設置的養殖密度梯度足以改變長江鱘幼魚的行為,同時很大程度上導致了種間不均勻的食物獲得。
養殖密度能夠顯著改變平均體質量為(7.09±0.52) g的長江鱘幼魚的生長以及種間個體的均勻度,考慮產量、收益以及種內均勻生長等因素,建議體質量為(7.09±0.52) g的長江鱘幼魚適宜的養殖密度為4.96 kg/m3,同時,在養殖過程中,應不斷分級飼養,使長江鱘的生長狀態達到最優。
參考文獻:
[1]Zhang H,Wei Q W,Du H,et al. Present status and risk for extinction of the Dabrys sturgeon (Acipenser dabryanus) in the Yangtze River watershed:a concern for intensified rehabilitation needs[J]. Journal of Applied Ichthyology,2011,27(2):181-185.
[2]Zhang S H,Luo H,Du H,et al. Isolation and characterization of twenty-six microsatellite loci for the tetraploid fish Dabrys sturgeon (Acipenser dabryanus)[J]. Conservation Genetics Resources,2012,5(2):409-412.
[3]魯雪報,倪 勇,饒 軍,等. 達氏鱘的資源現狀及研究進展[J]. 水產科技情報,2012,39(5):251-253,257.
[4]Yang R,Liu Y,Wang Y,et al. Pathogenesis and pathological analysis of Edwardsiella tarda,from Dabrys sturgeon (Acipenser dabryanus) in China[J]. Aquaculture,2018,495:637-642.
[5]Zhang S,Xu Q,Boscari E,et al. Characterization and expression analysis of g-and c-type lysozymes in Dabrys sturgeon (Acipenser dabryanus)[J]. Fish & Shellfish Immunology,2018,76:260-265.
[6]龔 全,劉 亞,杜 軍,等. 達氏鱘全人工繁殖技術研究[J]. 西南農業學報,2013,26(4):1710-1714.
[7]Wang X D,Jing H F,Li J X,et al. Development of 26 SNP markers in Dabrys sturgeon (Acipenser dabryanus) based on high-throughput sequencing[J]. Conservation Genetics Resources,2016,9(2):205-207.
[8]Liu J J,Tan C,Xiao K,et al. The complete mitochondrial genome of Dabrys sturgeon (Acipenser dabryanus)[J]. Mitochondrial Dna Part B,2017,2(1):54-55.
[9]MBalaka M, Kassam D ,Rusuwa B. The effect of stocking density on the growth and survival of improved and unimproved strains of Oreochromis shiranus[J]. The Egyptian Journal of Aquatic Research,2012,38(3):205-211.
[10] Grelahin S,Yanar M,Kumlu M. The effects of stocking density,Tubifex feeding and monosex culture on growth performance of guppy (Poecilia reticulata) in a closed indoor recirculation system[J]. Aquaculture,2018,493:153-157.
[11]Refaey M M,Li D,Tian X,et al. High stocking density alters growth performance,blood biochemistry,intestinal histology,and muscle quality of channel catfish,Ictalurus punctatus[J]. Aquaculture,2018,492:73-81.
[12]Tolussi C E,Hilsdorf A S,Caneppele D,et al. The effects of stocking density in physiological parameters and growth of the endangered teleost species piabanha,Brycon insignis (Steindachner,1877)[J]. Aquaculture,2010,310(1/2):221-228.
[13]Hwang H K,Son M H,Myeong J I,et al. Effects of stocking density on the cage culture of Korean rockfish (Sebastes schlegeli)[J]. Aquaculture,2014,434:303-306.
[14]宋志飛,溫海深,李吉方,等. 養殖密度對流水養殖系統中俄羅斯鱘幼魚生長的影響[J]. 水產學報,2014,38(6):835-842.
[15]莊 平,李大鵬,王明學,等. 養殖密度對史氏鱘稚魚生長的影響[J]. 應用生態學報,2002,13(6):735-738.
[16]Costas B,Arago C,Mancera J M,et al. High stocking density induces crowding stress and affects amino acid metabolism in Senegalese sole Solea senegalensis(Kaup 1858)juveniles[J]. Aquaculture Research,2010,39(1):1-9.
[17]Laizcarrión R,Viana I R,Cejas J R,et al. Influence of food deprivation and high stocking density on energetic metabolism and stress response in red porgy,Pagrus pagrus L[J]. Aquaculture International,2012,20(3):585-599.
[18]Heras V D L,Martos-Sitcha J A,Yúfera M,et al. Influence of stocking density on growth,metabolism and stress of thick-lipped grey mullet (Chelon labrosus) juveniles[J]. Aquaculture,2015,448:29-37.
[19]Schram E,Heul J D,Kamstra A,et al. Stocking density-dependent growth of Dover sole (Solea solea)[J]. Aquaculture,2006,252(2/3/4):339-347.
[20]Ali A,Fotedar R.Water quality,growth and stress responses of juvenile barramundi (Lates calcarifer Bloch),reared at four different densities in integrated recirculating aquaculture systems[J]. Aquaculture,2016,458:113-120.
[21]Lupatsch I,Santos G A,Schrama J W,et al. Effect of stocking density and feeding level on energy expenditure and stress responsiveness in European sea bass Dicentrarchus labrax[J]. Aquaculture,2010,298(3/4):245-250.
[22]Teles M,Pacheco M,Santos M A. Endocrine and metabolic responses of Anguilla anguilla L. caged in a freshwater-wetland (Pateira de Fermentelos—Portugal)[J]. The Science of the Total Environment,2007,372(2/3):562-570.
[23]De las Heras V,Martos-Sitcha J A,Yúfera M,et al. Influence of stocking density on growth,metabolism and stress of thick-lipped grey mullet (Chelon labrosus) juveniles[J]. Aquaculture,2015,448:29-37.
[24]Dong S L,Liang M,Gao Q F,et al. Intra-specific effects of sea cucumber (Apostichopus japonicus) with reference to stocking density and body size[J]. Aquaculture Research,2010,41(8):1170-1178.
[25]Liang M,Dong S L,Gao Q F,et al. Individual variation in growth in sea cucumber Apostichopus japonicus(Selenck)housed individually[J]. Journal of Ocean University of China,2010,9(3):291-296.
[26]Lambert Y,Dutil J D. Food intake and growth of adult Atlantic cod (Gadus morhua L.) reared under different conditions of stocking density,feeding frequency and size-grading[J]. Aquaculture,2001,192(2):233-247.
[27]Toko I,Fiogbe E D,Koukpode B,et al. Rearing of African catfish(Clarias gariepinus)and vundu catfish (Heterobranchus longifilis) in traditional fish ponds(whedos):effect of stocking density on growth,production and body composition[J]. Aquaculture,2007,262(1):65-72.
[28]Marco P D,Priori A,Finoia M G,et al. Physiological responses of European sea bass Dicentrarchus labrax to different stocking densities and acute stress challenge[J]. Aquaculture,2008,275(1/2/3/4):319-328.
[29]Merino G E,Piedrahita R H,Conklin D E. The effect of fish stocking density on the growth of California halibut (Paralichthys californicus) juveniles[J]. Aquaculture,2007,265(1/2/3/4):176-186.韋夢婷,王 英,劉小莉,等. 低度黑莓果酒發酵菌株篩選與工藝優化[J]. 江蘇農業科學,2021,49(3):156-161.

