神經突方向離散度與密度成像對帕金森病腦深部核團的臨床研究
黃小盼,韓鴻宇,王敏,馬東輝,李沛珊,王紅
作者單位:新疆醫科大學第二附屬醫院影像科,烏魯木齊830063
帕金森病是一種慢性不可逆的異質性神經系統疾病,臨床上多表現為震顫、運動遲緩、僵硬等運動障礙及嗅覺減退、認知功能不全、睡眠障礙等非運動癥狀[1]。在帕金森病中,多巴胺能神經元的丟失和路易小體的積聚通常伴隨著神經膠質細胞變性損傷、軸突脫髓鞘改變,細胞外小膠質細胞濃度的增加[2]。因此,檢測具有多巴胺能神經的腦組織和沿著多巴胺能通路的細胞外微結構異常,對發現早期帕金森病的生物標志物有重要意義。
目前,擴散張量成像(diffusion tensor imaging,DTI)[3]技術被廣泛用于探索帕金森病黑質病理改變,其原理是評估水分子的擴散運動,反映水和細胞基質之間的相互作用,從而獲得有關組織完整性的信息。其主要參數各向異性分數(fractional anisotropy,FA)主要反映神經纖維微結構情況。先前研究發現,PD 患者黑質部位FA 值較對照組顯著降低[4-6],少數表現為FA 值升高[7]或無明顯差異[8]。另一項研究僅發現PD 患者平均擴散系數增加[9]。這些研究結果表明DTI技術研究PD患者多能檢測到黑質微結構的變化,但這些結果存在一定的異質性。并且FA值難以特異性的解釋黑質結構潛在的病理變化,無法準確判斷是由神經密度降低還是由脫髓鞘改變引起的,因此存在一定的局限性。
相較于傳統的DTI 模型,最近發展的NODDI[10]新技術采用多室間隔組織模型,將腦組織微結構分為細胞內、細胞外及腦脊液,更接近于復雜的生物結構。本研究旨在利用NODDI 新技術研究PD 黑質紋狀體微結構改變情況,并進一步闡明這些變化是由神經密度減少還是由軸突分散度引起的,為PD 臨床診斷提供新的神經影像學支持。
1 材料與方法
1.1 一般資料
收集2019 年12 月至2020 年6 月在我院就診的36 例PD 患者,其中男21 例,女15 例;年齡45~80 歲,平均(61.44±7.69)歲。隨機選取26 例性別年齡相匹配的健康受試者,其中男16 例,女10 例;年齡42~75歲,平均年齡(60.15±6.83)歲。病例組納入標準:(1)由我院帕金森病門診專家依據《帕金森治療指南(2018 年版)》診斷標準做出確診;(2)均為右利手;(3)年齡在40~80 歲之間,可配合檢查者。排除標準:(1)嚴重心腎功能不全者;(2)有癡呆等神經或精神疾病史者;(3)外傷、腦梗死、中樞神經系統腫瘤、蒼白球鈣化等器質性改變者。研究方案經本院醫學倫理委員會批準(批準文號:20190712-03),受試者均知情同意。
1.2 MRI掃描及數據處理
通過飛利浦3.0 T MRI 獲得MR 圖像。利用自旋回波平面成像序列獲得擴散加權圖像,該序列由在前后相位編碼方向沿32個各向同性擴散梯度獲取的兩個b 值(1000、2000 s/mm2)組成。每一次DWI 采集都使用無梯度圖像(b=0)作為補充。序列參數如下:TR 3000 ms,TE 83 ms;FOV 200 mm×232 mm×119 mm;層厚5 mm,層數20 層;DKI 采集時間:309 s。掃描范圍:頂葉至小腦。
MR掃描得到的原始數據傳至后處理工作臺,將DKI序列通過Spin軟件分離圖像,dcm2niigui軟件轉換格式,用Matlab R2013a軟件執行圖像分析得到神經突體積分數(intracellular volume fraction,Vic)圖、神經突方向分散度(orientation dispersionindex,ODI)圖。
1.3 選取分析感興趣區
感興趣區(region of interest,ROIs)由2 名8 年以上診斷經驗的放射科主治醫師雙盲情況下多次測量取平均值,若出現意見不一致,則由另一名放射學診斷副主任醫師協商。筆者以MRI 常規序列T1WI、T2WI 圖像作為參考,選取ROIs 分別獲得Vic,ODI 值(圖1)。感興趣區有:雙側蒼白球、尾狀核頭和殼核以及黑質、紅核、丘腦,分別比較兩組各個核團的Vic、ODI 值。不同核團Vic 的ROI 曲線下面積(圖2)有所不同。
1.4 統計學分析
所有數據均使用SPSS 22.0 版進行統計分析。計數資料比較采用卡方檢驗,計量資料比較采用t檢驗。使用Kolmogorov-Smirnov 檢驗來分析正態分布,臨床變量均呈正態分布,用均數±標準差(±s)表示。統計學顯著性標準設為P<0.05。獨立樣本t檢驗用于評估ROIs 的Vic、ODI 值組間差異。用ROC 曲線評估不同核團Vic 值診斷效能。AUC 為0.7~0.9時有一定準確性,>0.9準確性較高。
2 結果
PD 組和對照組年齡分布(P=0.498,獨立樣本t 檢驗)接近匹配,性別無明顯差異(P=0.8,卡方檢驗)。研究發現,與健康對照組相比,PD 患者右側尾狀核、殼核、蒼白球、紅核及雙側黑質、丘腦Vic值顯著降低(P<0.05)(表1),且右側尾狀核頭、殼核、蒼白球、紅核及雙側黑質ODI值明顯降低(P<0.05)(表2)。同時ROC 曲線(圖2)顯示,PD 患者Vic 在右側黑質部位AUC最大,為0.861,臨界值為0.614,敏感度為93.3%,特異度為84.6%。最后,分別對右側黑質蒼白球、右側黑質殼核的Vic值(圖3)進行聯合診斷,得出AUC面積為0.925,0.921,AUC 均可達到90%以上,表明多核團聯合診斷效能較任何單一核團的高。
3 討論
3.1 NODDI基本原理及臨床應用
NODDI[10]是一種新興的非侵入性的微結構成像技術,它基于磁共振擴散成像,但使用不同強度的擴散梯度來提供比DTI更具特異性的指標。主要參數有:Vic、ODI 及腦脊液體積分數(isotropic volume fraction,Viso),神經突外體積分數(entracellular volume fraction,Vec)。其中Vic 反映神經突密度,通常灰質中較低,白質中較高,若神經樹突、軸突丟失或破壞時,Vic值預計會降低。ODI則描述突起方向變化,若白質中ODI增加,表明白質纖維束中的軸突組織紊亂,而灰質中ODI 減少提示樹突變薄。事實上,這種將細胞內組織分裂成軸突的分散和密度,是NODDI所獨有的。
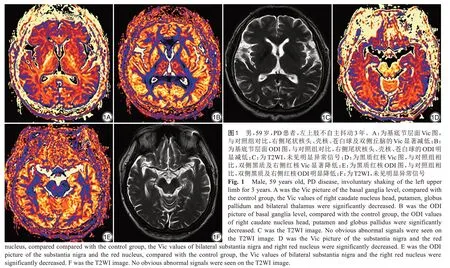
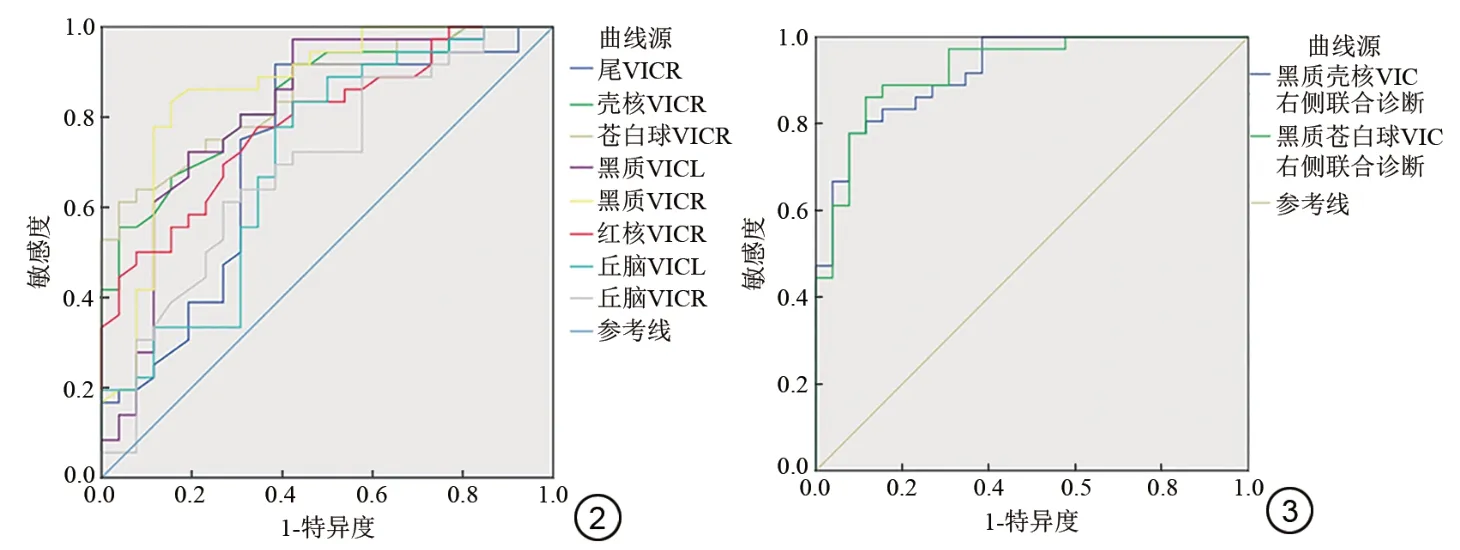
圖2 PD 患者灰質核團Vic值的ROC 曲線。ROC 分析顯示:尾狀核、殼核、蒼白球、黑質、紅核及丘腦中,右側黑質Vic 值曲線下面積最大,為0.861,診斷效能最佳 圖3 黑質蒼白球及黑質殼核Vic 聯合診斷PD 的ROC曲線。兩者AUC分別為0.925、0.921,顯示出多核團Vic聯合診斷的診斷效能優于單一核團,且診斷效能較好Fig.2 ROC curve of the Vic values in gray matter nucleus of PD patients. ROC analysis showed that in right caudate nucleus, putamen, globulus, red nucleus and bilateral substantia nigra and thalamus, the AUC of Vic value in the right substantia nigra was 0.861, which was the largest one and showed the best diagnostic efficiency. Fig.3 ROC curve of the combined diagnosis of substantia nigra and globus pallidus, substantia nigra and putamen. The AUC were 0.925 and 0.921, showing that the diagnostic efficiency of the combined diagnosis of multi-nucleus Vic was better than the single nuclei,and the diagnostic efficiency was good.
目前,NODDI 技術在中樞神經系統疾病中的相關研究較為成熟,比如自閉癥、多發性硬化,中風[11-13]等。以往研究表明,NODDI 在描述軸突取向、分散和密度變化方面有其獨有的優勢。
3.2 NODDI技術對PD腦灰質核團微結構的分析
PD 經典的運動功能障礙模型是皮質-基底節-丘腦運動回路[14]。基底節是該回路的關鍵節點,本研究以此為依據,利用NODDI 技術檢測PD 患者黑質、尾狀核、蒼白球、殼核等腦深部灰質核團微結構情況。研究發現,腦灰質核團微結構發生廣泛改變。以往研究者通過DTI,DKI 技術發現PD 患者錐體外系灰質核團顯微結構的改變,但是FA值的特異性不夠,而DKI 參數難以解釋核團微結構改變的潛在病理基礎[15-16]。
首先,本研究結果顯示黑質、殼核Vic、ODI 較對照組明顯降低,這與劉偉星等[17]報道結果相一致,黑質Vic 的降低反映黑質軸突、樹突密度的降低,引起神經細胞體積的縮小或數量的減少。而黑質、殼核ODI 的減少則反映了樹突變短和棘突數量的減少。而黑質多巴胺能神經元的損傷會對直接通路及間接通路[18]產生消極作用,進而導致蒼白球神經元活性降低。
其次,與Kamagata 等[19-20]報道不同點在于,本研究利用NODDI 技術檢測到PD 患者蒼白球Vic、ODI 的降低,可能與患者的納入標準及病程不一致有關。蒼白球由梭形的多極神經元組成,通過抑制γ-氨基丁酸能通路,從而抑制丘腦活動,而丘腦可以向皮層運動區輸出刺激從而激活運動[21]。筆者認為,PD 患者的蒼白球Vic、ODI 減低,表明PD 患者蒼白球神經元存在丟失情況,一定程度上減輕了對丘腦的抑制作用,丘腦活動增加,進而導致運動激活增多。筆者還發現,與對照組相比,丘腦Vic減低,反映了該部位細胞數量的減少,這可能與丘腦神經細胞的損傷有關,丘腦活動減低,進而運動激活減少。綜上,蒼白球及丘腦微結構損傷均會增加PD運動障礙發生的可能性。
表1 兩組人群間Vic值的比較(±s)Tab.1 Comparison of Vic values between the two groups(±s)
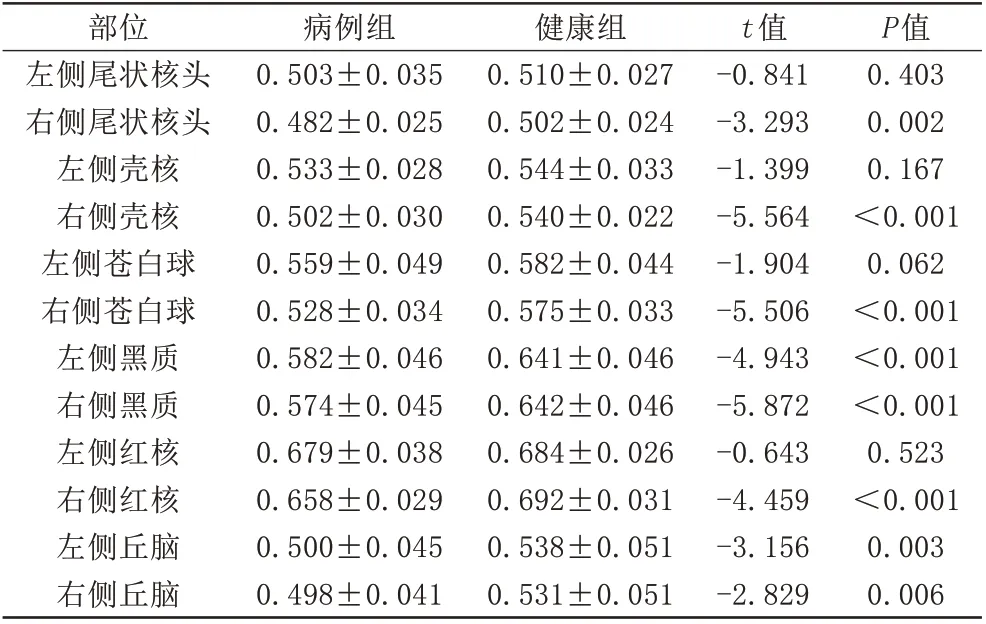
表1 兩組人群間Vic值的比較(±s)Tab.1 Comparison of Vic values between the two groups(±s)
注:比較采用獨立樣本t檢驗
P值0.403 0.002 0.167<0.001 0.062<0.001<0.001<0.001 0.523<0.001 0.003 0.006部位左側尾狀核頭右側尾狀核頭左側殼核右側殼核左側蒼白球右側蒼白球左側黑質右側黑質左側紅核右側紅核左側丘腦右側丘腦病例組0.503±0.035 0.482±0.025 0.533±0.028 0.502±0.030 0.559±0.049 0.528±0.034 0.582±0.046 0.574±0.045 0.679±0.038 0.658±0.029 0.500±0.045 0.498±0.041健康組0.510±0.027 0.502±0.024 0.544±0.033 0.540±0.022 0.582±0.044 0.575±0.033 0.641±0.046 0.642±0.046 0.684±0.026 0.692±0.031 0.538±0.051 0.531±0.051 t值-0.841-3.293-1.399-5.564-1.904-5.506-4.943-5.872-0.643-4.459-3.156-2.829
表2 兩組人群間ODI值的比較(±s)Tab.2 Comparison of ODI values between the two groups(±s)
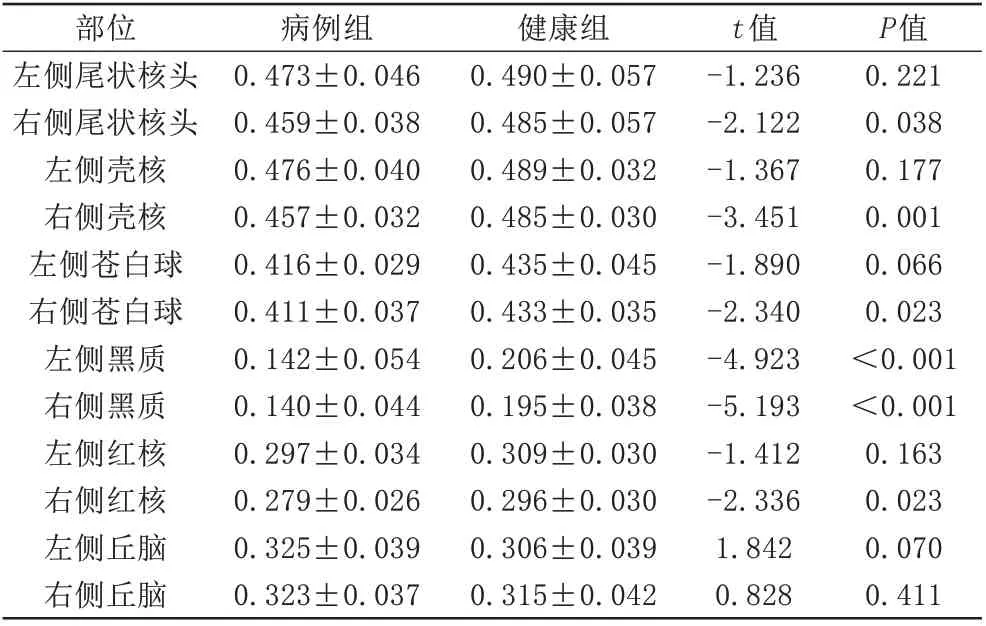
表2 兩組人群間ODI值的比較(±s)Tab.2 Comparison of ODI values between the two groups(±s)
注:比較采用獨立樣本t檢驗
P值0.221 0.038 0.177 0.001 0.066 0.023<0.001<0.001 0.163 0.023 0.070 0.411部位左側尾狀核頭右側尾狀核頭左側殼核右側殼核左側蒼白球右側蒼白球左側黑質右側黑質左側紅核右側紅核左側丘腦右側丘腦病例組0.473±0.046 0.459±0.038 0.476±0.040 0.457±0.032 0.416±0.029 0.411±0.037 0.142±0.054 0.140±0.044 0.297±0.034 0.279±0.026 0.325±0.039 0.323±0.037健康組0.490±0.057 0.485±0.057 0.489±0.032 0.485±0.030 0.435±0.045 0.433±0.035 0.206±0.045 0.195±0.038 0.309±0.030 0.296±0.030 0.306±0.039 0.315±0.042 t值-1.236-2.122-1.367-3.451-1.890-2.340-4.923-5.193-1.412-2.336 1.842 0.828
這些灰質核團神經軸突的微結構損傷引起基底神經節結構的完整性受損,影響了整個運動控制回路,導致PD患者出現運動遲緩、僵硬及其他運動問題。
3.3 NODDI參數在PD中的診斷價值
ROC分析顯示,右側黑質Vic曲線下面積最大,為0.861,敏感度93.3%,特異度84.6%。據報道,當PD的運動核心缺陷歸因于多巴胺能黑質紋狀體系統的喪失[22],本研究中黑質中Vic 的減少可以被認為是NODDI 以良好的靈敏度捕獲了黑質結構的神經元丟失。最后,本研究分別對右側黑質殼核及黑質蒼白球的Vic 值進行聯合診斷,得出AUC 為0.921,0.925,臨界值為0.624,0.535,表明:(1) Vic 的多核團聯合診斷低于臨界值時,對PD的診斷提供影像學支持;(2)多核團聯合診斷價值較任何單一核團的高,并且診斷效能較好,這兩者均適合作為是否患該病的預測指標。
本研究存在一定局限性。首先是樣本量不夠,在今后的研究中需增大樣本量。其次,本研究納入患者不夠嚴謹,未考慮臨床干預情況,可能對結果產生一定影響。最后,NODDI 技術本質上是一種數學模型,在反映大腦微結構的真實情況缺乏一定準確性。
綜上所示,這些發現表明NODDI可以定性區分PD患者及健康人群,并且NODDI 參數更直觀、準確的檢測到腦深部灰質核團神經突起的形態學變化,有助于加深對PD 病理生理機制的理解,可以作為PD 診斷神經影像學指標。
作者利益沖突聲明:全體作者均聲明無利益沖突。

