腦血管源性細胞間通訊異常與腦疾病機制研究
陸 露,劉秀秀,李政懋,韓 峰
(南京醫(yī)科大學藥學院,心腦血管醫(yī)學重點實驗室,江蘇 南京 211166)
中樞神經(jīng)系統(tǒng)疾病的發(fā)生往往被認為是由于大腦神經(jīng)網(wǎng)絡(luò)的穩(wěn)態(tài)遭到破壞,進而引起神經(jīng)元細胞的異常代謝和凋亡。神經(jīng)元作為神經(jīng)傳遞的基本信號單元,一直以來是神經(jīng)科學研究的熱點。幾十年來諸多研究集中于神經(jīng)元這個單一類型,開展分子機制的解析和藥物靶標的研究。但是,基于單獨神經(jīng)元保護理論的藥物靶標發(fā)現(xiàn)和新藥研發(fā)在臨床試驗中屢屢受挫。由此,本領(lǐng)域研究者逐漸認識到,游離于系統(tǒng)生物學理論之外的單一類型細胞“純凈”研究系統(tǒng),難以解釋腦疾病復雜病理過程和機制[1]。迄今為止,尚不清楚多種神經(jīng)元細胞和各種分子如何協(xié)同作用以實現(xiàn)復雜的腦功能以及病理過程。研究者們發(fā)現(xiàn),大腦是通過特定的機制獲得持續(xù)不斷的氧氣和營養(yǎng)物質(zhì)的,1890年Roy等人首次提出了神經(jīng)結(jié)構(gòu)如何影響大腦血流調(diào)節(jié)的機制。這也提示著研究者們,僅以神經(jīng)元為中心的聚焦是不夠的,必須結(jié)合所有大腦中的細胞類型,包括神經(jīng)元、神經(jīng)膠質(zhì)和血管成分。這些不同來源的細胞間信號傳導和耦聯(lián)構(gòu)成了正常生理過程的基礎(chǔ),而信號和耦聯(lián)紊亂則是神經(jīng)功能障礙和引發(fā)病變的關(guān)鍵生物化學基礎(chǔ)。腦內(nèi)基本功能單元被稱為“神經(jīng)血管單元(neurovascular unit,NVU)”,是由神經(jīng)元及其相關(guān)的神經(jīng)膠質(zhì)細胞和內(nèi)皮細胞等組成,在相同的微環(huán)境中具有正負反饋機制的相互作用。
圍繞神經(jīng)血管單元的概念,神經(jīng)病理學的研究達到了新的高度。腦內(nèi)的信號轉(zhuǎn)導需要神經(jīng)元和神經(jīng)膠質(zhì)細胞、血管細胞等之間的相互作用,從而介導神經(jīng)遞質(zhì)的釋放和突觸再攝取。血腦屏障(blood brain barrier,BBB)的完整性也是維持正常腦功能必不可缺的條件,主要取決于神經(jīng)膠質(zhì)細胞和腦微血管內(nèi)皮細胞、周細胞等的相互作用。已有一些報道證明神經(jīng)血管單元的組成部分損傷存在于急性腦病中,例如創(chuàng)傷性腦損傷和腦卒中等;同時也存在于慢性疾病中,例如癡呆等退行性疾病。在這些病理過程中,存在著較為常見的特征,例如血腦屏障的通透性和選擇性的缺失、細胞基底層成分的降解以及炎癥反應(yīng)等。此外,周細胞假說近年來逐漸成為腦疾病相關(guān)的研究熱點[2]。因此,靶向神經(jīng)血管單元可能成為神經(jīng)血管疾病治療的新策略。
神經(jīng)血管單元研究的最終目的是發(fā)現(xiàn)和確證治療腦病的藥物靶標。臨床研究表明,基于單獨神經(jīng)元保護的治療策略未能達到確切的療效[3]。以腦卒中為例,該病是高發(fā)的、具有高致死率和致殘率的中樞神經(jīng)系統(tǒng)疾病。盡管通過溶栓治療和血栓切除手術(shù)改善缺血性腦卒中患者的預(yù)后,但這兩種方法治療效果有限。由于在腦卒中等疾病的病理過程中,神經(jīng)元的存活與死亡是重要的終點現(xiàn)象,而疾病發(fā)生發(fā)展及轉(zhuǎn)歸過程中神經(jīng)血管單元各組分細胞全部參與其中,由此靶向神經(jīng)血管單元的治療方法預(yù)計可以產(chǎn)生更顯著的治療效果。深入了解以神經(jīng)元為中心的神經(jīng)血管單元的結(jié)構(gòu)與功能,將更能真實地模擬臨床腦疾病病理過程,有助于解析疾病發(fā)生發(fā)展及轉(zhuǎn)歸過程中腦微血管網(wǎng)絡(luò)的細胞間信號通訊時空變化規(guī)律,在此基礎(chǔ)上發(fā)現(xiàn)和確證治療各類腦病的藥物靶標。
1 神經(jīng)血管單元構(gòu)成細胞間通訊的結(jié)構(gòu)和功能平臺
1.1 神經(jīng)血管單元腦血流是氧氣和營養(yǎng)物質(zhì)輸送到大腦特定腦區(qū)的保證,神經(jīng)血管單元根據(jù)神經(jīng)系統(tǒng)需求來改變血液的供應(yīng)。神經(jīng)血管單元的提出,更加強調(diào)了多種細胞類型之間共同協(xié)作發(fā)揮作用,以維持大腦結(jié)構(gòu)與功能的完整性。神經(jīng)血管單元由神經(jīng)元、神經(jīng)間質(zhì)、星形膠質(zhì)細胞、周細胞、血管內(nèi)皮細胞和細胞外基質(zhì)構(gòu)成(Fig 1)。神經(jīng)血管單元的各個組成部分形成相互緊密連接,形成了一個完整的結(jié)構(gòu)體系,從而構(gòu)成高效的腦血流調(diào)節(jié)系統(tǒng)。激活的神經(jīng)元釋放物質(zhì)并擴散到血管,改變血管平滑肌狀態(tài)以調(diào)節(jié)腦血流量。縫隙連接和粘附分子(鈣黏蛋白和整合蛋白等)參與各組成部分間的相互作用,可以促進Ca2+、K+和ATP等的運輸[4]。神經(jīng)血管單元的精密結(jié)構(gòu)是一系列遺傳編碼事件的結(jié)果。
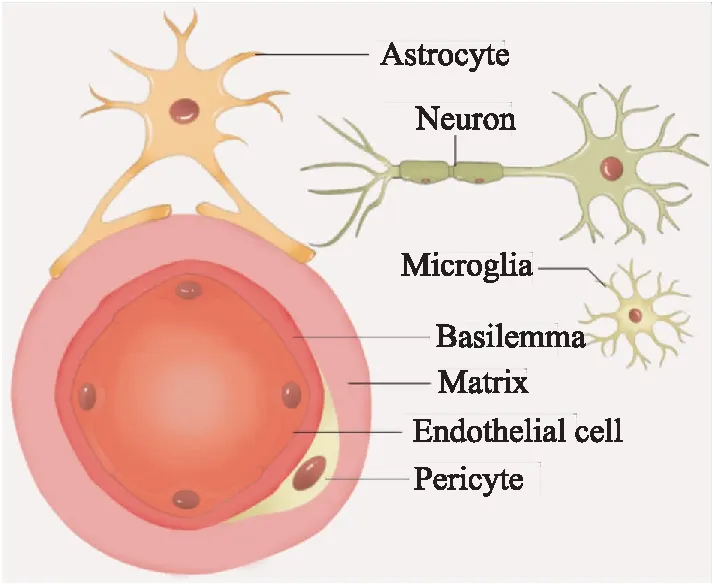
Fig 1 The schematic diagram of neurovascular unit structure
1.2 神經(jīng)血管耦聯(lián)正常的大腦功能取決于神經(jīng)血管單元間神經(jīng)元和血管脈管系統(tǒng)功能之間的密切耦聯(lián)。神經(jīng)元通過產(chǎn)生信號分子(如谷氨酸和Ca2+等)來調(diào)節(jié)腦血流量,該信號直接或通過關(guān)聯(lián)的細胞作用于局部血管以引發(fā)血管反應(yīng)。鄰近的星形膠質(zhì)細胞起信號傳遞作用,其與突觸和局部微血管密切相關(guān),很好地將神經(jīng)活動與腦微血管功能聯(lián)系起來。內(nèi)皮細胞在神經(jīng)血管信號的逆向傳播中具有重要作用,調(diào)節(jié)腦血流量以響應(yīng)相應(yīng)化學和機械信號。平滑肌細胞和周細胞被認為是血管舒縮反應(yīng)和血流調(diào)節(jié)的主要效應(yīng)器,神經(jīng)元及其他細胞產(chǎn)生的活動信號最終與平滑肌細胞與周細胞結(jié)合以改變血流量。以腦缺血損傷病理過程為例,這一系列的耦聯(lián)作用參與調(diào)控神經(jīng)-微血管網(wǎng)絡(luò)的動態(tài)變化[6]。見Fig 2。
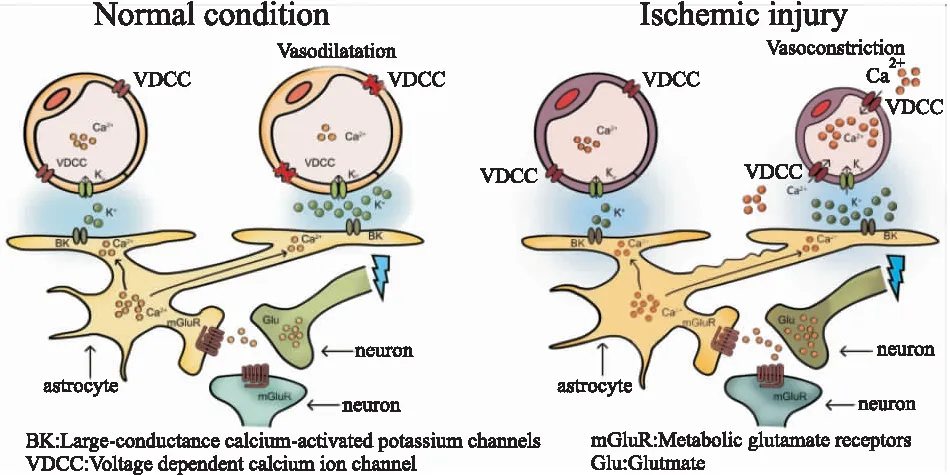
Fig 2 The schematic model of neurovascular coupling in normal condition and ischemic injury
神經(jīng)血管單元的細胞組分間信號傳導規(guī)律是理解功能耦聯(lián)以及可能有助于腦部疾病發(fā)展的無序耦聯(lián)的關(guān)鍵,然而神經(jīng)血管耦聯(lián)的潛在分子和細胞機制仍然知之甚少[5]。
2 腦血管源性細胞間通訊異常參與介導腦疾病模式及機制
2.1 腦血管源性分泌蛋白調(diào)控細胞間通訊模式脈管網(wǎng)絡(luò)中的非神經(jīng)元細胞對中樞神經(jīng)系統(tǒng)的信號接收和調(diào)控是維持大腦功能不可或缺的,營養(yǎng)成分、水和氧氣的交換需求通過提示傳遞入腦微脈管網(wǎng)絡(luò),以滿足高度活躍的神經(jīng)環(huán)境的生理和代謝需求。神經(jīng)元釋放神經(jīng)調(diào)節(jié)蛋白和腦源性神經(jīng)營養(yǎng)分子并由血腦屏障轉(zhuǎn)運,通過微環(huán)境的離子穩(wěn)態(tài)和信號傳導介質(zhì),神經(jīng)血管單元的組成部分實現(xiàn)多維、連續(xù)的通訊來維持中樞神經(jīng)系統(tǒng)的穩(wěn)態(tài)。腦微血管內(nèi)皮細胞通過連接粘附分子和附著蛋白形成緊密連接,構(gòu)成BBB。BBB的完整性和通透性與腦血管病直接相關(guān),BBB分解導致神經(jīng)元丟失及突觸功能障礙,引起認知功能退化和神經(jīng)炎癥。理清病理生理過程中局部腦微環(huán)境的物質(zhì)基礎(chǔ)變化將有助于探尋細胞間的通訊規(guī)律。因此,血管內(nèi)皮細胞是否可以直接與神經(jīng)元通訊,從而參與中樞神經(jīng)系統(tǒng)生理病理過程是值得探究的問題,新興的血管內(nèi)皮細胞分泌的蛋白在組織中的作用仍有待探尋。
腦內(nèi)分泌蛋白在特定細胞內(nèi)合成后,分泌到細胞外起信號轉(zhuǎn)導作用,進而調(diào)節(jié)大腦正常功能。有研究從血管內(nèi)皮細胞分泌蛋白Semaphorin 3G(Sema3G)著手,探索了腦內(nèi)血管內(nèi)皮細胞與神經(jīng)元之間進行跨細胞類型的配體受體信息交流的新模式。Sema3G是最近發(fā)現(xiàn)的一類分泌信號蛋白亞家族的成員,主要表達在內(nèi)皮細胞中,在神經(jīng)元或膠質(zhì)細胞中均無表達。研究發(fā)現(xiàn)血管內(nèi)皮細胞特異性敲除Sema3G的小鼠存在認知功能障礙表型,由此研究者推測這種模型中血管內(nèi)皮細胞和神經(jīng)元細胞群間可能會存在通訊異常[2]。表達譜結(jié)果表明內(nèi)皮特異性分泌的Sema3G介導腦微血管內(nèi)皮細胞與神經(jīng)元通訊。血管內(nèi)皮細胞條件敲除Sema3G誘發(fā)的小鼠認知功能障礙與海馬CA3到CA1區(qū)的興奮性突觸環(huán)路連接的削弱關(guān)聯(lián),減少了海馬CA1錐體神經(jīng)元的興奮性突觸數(shù)量。Sema家族分泌蛋白激活叢狀蛋白(plexin)受體需要神經(jīng)纖毛蛋白2(neuropilin-2,Nrp2)來穩(wěn)固相互連接作用[2]。進一步對突觸功能的研究顯示,內(nèi)皮中Sema3G通過突觸后Nrp2/PlexinA4信號介導Sema3G對興奮性突觸傳遞的影響。此項研究明確了內(nèi)皮細胞傳遞到大腦神經(jīng)元信號的精確分子事件,發(fā)現(xiàn)了全新的神經(jīng)-血管相互作用機制,為血管內(nèi)皮細胞調(diào)節(jié)海馬認知功能相關(guān)的神經(jīng)元及突觸可塑性提供了重要依據(jù)。但是受到技術(shù)等因素的限制,該研究沒有對血管內(nèi)皮細胞中Sema3G蛋白的分泌調(diào)控機制和分泌后胞外運輸途徑進一步探索。
在腦部多種與炎癥相關(guān)的疾病中,如中風、血管性癡呆和多發(fā)性硬化癥中,均觀察到了神經(jīng)血管協(xié)調(diào)性的破壞。Duan等[6]在急性感染的小鼠中發(fā)現(xiàn),全身炎癥的2 h內(nèi),PDGFRβ血管壁細胞迅速分泌CC趨化因子配體2(CC chemokine ligand 2,CCL2),通過促進多個腦區(qū)的谷氨酸能神經(jīng)元的興奮性突觸傳遞而增加神經(jīng)元興奮性。實驗結(jié)果證明了在體內(nèi)PDGFRβ細胞通過分泌CCL2充當外周損傷的起始傳感器,對環(huán)境變化做出快速反應(yīng),協(xié)調(diào)血管與神經(jīng)元在急性炎癥中的耦聯(lián)作用。腦部感染或損傷引起的炎癥在不同程度上激活內(nèi)皮和神經(jīng)膠質(zhì)細胞,促進分泌細胞因子以響應(yīng)腦損傷反應(yīng)。從神經(jīng)血管單元的整體關(guān)聯(lián)出發(fā),明確與血管源性分泌因子作用的相關(guān)神經(jīng)膠質(zhì)細胞類型(例如星形膠質(zhì)細胞和小膠質(zhì)細胞),以及它們在腦疾病的發(fā)生、發(fā)展和轉(zhuǎn)歸階段的潛在功能變化和機制,可以很好地從分子水平解釋神經(jīng)病理學和血管功能障礙的合并癥。
2.2 星形膠質(zhì)細胞承前啟后調(diào)控不同類型細胞間通訊模式星形膠質(zhì)細胞在神經(jīng)元與毛細血管和周細胞間建立多功能連接,參與細胞間的長距離通信。星形膠質(zhì)細胞與神經(jīng)元信號相互作用是特異的,呈現(xiàn)出高度的復雜性。星形膠質(zhì)細胞的靜息鉀電導較大,極負性的膜電位有助于谷氨酸的攝取,同時也釋放前列腺素、ATP等物質(zhì),促進血管的舒張和收縮。星形膠質(zhì)細胞間隙連接的耦聯(lián)調(diào)節(jié)和其形態(tài)變化的依賴機制均能影響癲癇發(fā)作[7]。BBB的微血管系統(tǒng)的穩(wěn)態(tài)破壞被認為是導致癲癇在內(nèi)的腦部疾病的病因之一。劉等[8]報道了一種血管源性的新型自發(fā)性癲癇研究模型,對血管源性病因引發(fā)癲癇活動發(fā)作的分子機制進行了探索。內(nèi)皮細胞周期蛋白依賴性激酶(cyclin-dependent kinase 5,Cdk5)缺失以年齡依賴性方式誘發(fā)自發(fā)性海馬癲癇放電,四周齡的敲除小鼠海馬CA1錐體神經(jīng)元興奮性和海馬細胞外的谷氨酸明顯增加。由于星形膠質(zhì)細胞對維持谷氨酸穩(wěn)態(tài)有重要作用,研究者進一步檢測了神經(jīng)膠質(zhì)纖維酸性蛋白(glial fibrillary acidic protein,GFAP)的水平。免疫染色實驗發(fā)現(xiàn)突變小鼠中GFAP陽性星形膠質(zhì)細胞數(shù)量增加,提示著內(nèi)皮細胞敲除Cdk5引起進行性星形膠質(zhì)細胞增生并損害星形膠質(zhì)谷氨酸轉(zhuǎn)運體1(glutamate transporters,Glt1)功能。此外,實驗結(jié)果顯示Cdk5缺乏誘導內(nèi)皮中衍生的趨化因子配體1 (C-X-C motif chemokine ligand 1,CXCL1)異常升高,通過星形膠質(zhì)細胞中趨化因子受體2(C-X-C motif chemokine receptor 2,CXCR2)調(diào)節(jié)其谷氨酸的攝取。因此,以上研究揭示了血管內(nèi)皮源性Cdk5通過CXCL1/CXCR2級聯(lián)反應(yīng)觸發(fā)神經(jīng)膠質(zhì)細胞和神經(jīng)元的功能異常,為治療癲癇提供了神經(jīng)血管單元潛在新靶標[8]。
鑒于星形膠質(zhì)細胞在生理性腦功能中有許多潛在的作用,其功能障礙可能導致多種腦部疾病的發(fā)展。研究報道血管周圍神經(jīng)膠質(zhì)瘤細胞能夠破壞BBB和星形膠質(zhì)細胞和血管的偶聯(lián),但不損傷血管平滑肌細胞。膠質(zhì)瘤細胞可通過高度表達的Ca2+激活的K+通道來調(diào)節(jié)周圍血管的直徑從而影響腫瘤浸潤區(qū)域的血流量[9]。星形膠質(zhì)細胞也是參與突觸功能的不可或缺的元素,兩者與神經(jīng)元建立雙向通訊,釋放影響神經(jīng)元和突觸活動的神經(jīng)膠質(zhì)遞質(zhì)。早期的皮層-紋狀體環(huán)路中星形膠質(zhì)細胞增生驅(qū)動了亨廷頓舞蹈癥(Huntington′s disease,HD)的病理過程,并伴隨鉀離子通道4.1(Kir4.1)、Glt1和Ca2+信號轉(zhuǎn)導變化[10]。研究表明這種Ca2+和Glt1信號的功能紊亂可以被特異的星形膠質(zhì)細胞中Kir4.1修復所挽救,強調(diào)了K+穩(wěn)態(tài)機制在HD中的重要作用,提示著星形膠質(zhì)細胞和其前驅(qū)信號分子有望逆轉(zhuǎn)紋狀體環(huán)路缺陷,成為HD的新型治療靶點[10]。在唐氏綜合征模型中較早地發(fā)現(xiàn)了相較于生理情況下星形膠質(zhì)細胞更為頻繁的自發(fā)性鈣波動信號,從而影響神經(jīng)元興奮性和突觸連接異常[11]。后續(xù)研究發(fā)現(xiàn),利用γ-氨基丁酸受體拮抗劑、5-羥色胺重攝取抑制劑和天冬氨酸受體拮抗劑等小分子藥物阻斷星形膠質(zhì)細胞和神經(jīng)元間的通訊[12],可調(diào)節(jié)神經(jīng)元興奮性和突觸連接功能的病理變化,進一步證明星形膠質(zhì)細胞中Ca2+信號和神經(jīng)元之間的特定相互作用。綜上所述,星形膠質(zhì)細胞通過諸多神經(jīng)遞質(zhì)與離子通道介導血管與神經(jīng)元的串聯(lián)調(diào)控作用,參與中樞神經(jīng)系統(tǒng)生理發(fā)育和病理損傷的過程。未來,更多的與星形膠質(zhì)細胞功能相關(guān)的突觸受體和離子通道的調(diào)控化合物有望成為神經(jīng)系統(tǒng)疾病的新型治療藥物。
2.3 小膠質(zhì)細胞雙向調(diào)控細胞間通訊模式小膠質(zhì)細胞是大腦內(nèi)的巨噬細胞,被認為是不同腦部損傷引發(fā)神經(jīng)炎癥反應(yīng)的前哨[13],因而小膠質(zhì)細胞在中樞神經(jīng)系統(tǒng)疾病中的調(diào)節(jié)效應(yīng)得到廣泛的關(guān)注。小膠質(zhì)細胞是神經(jīng)血管單元內(nèi)的重要組成部分之一,與其他類型細胞產(chǎn)生協(xié)調(diào)作用。已有研究表明小膠質(zhì)細胞可促進星形膠質(zhì)細胞分化,而星形膠質(zhì)細胞通過旁分泌細胞信號傳導反向調(diào)節(jié)小膠質(zhì)細胞的表型,兩者相互調(diào)控影響血管發(fā)育和完整性。
常見的急性或者亞急性期的腦缺血損傷會破壞腦微血管系統(tǒng),并導致隨后的炎癥反應(yīng),伴隨著神經(jīng)元損傷加劇和小膠質(zhì)細胞激活。缺血性中風的臨床研究表明,在中風的不同病理進程階段均能檢測到小膠質(zhì)細胞的活化[14]。小膠質(zhì)細胞在腦微血管周圍募集,導致血管崩解及CD68的表達上調(diào)。已有的靶向小膠質(zhì)細胞的藥物——米諾環(huán)素和其他小膠質(zhì)細胞活化抑制劑已顯示出腦缺血損傷后神經(jīng)保護效應(yīng)[15-16]。但是圍繞缺血性中風中小膠質(zhì)細胞的雙向調(diào)節(jié)作用仍具有爭議,因此,靶向小膠質(zhì)細胞的臨床應(yīng)用還需要更多的探索工作。
小膠質(zhì)細胞的過度活化作用同樣是研究熱點,一般研究認為,促炎性的小膠質(zhì)細胞對機體有害,具有反向調(diào)控作用[14]。膿毒性腦病中血管炎癥引起的白細胞黏附與小膠質(zhì)細胞過度活化存在細胞間關(guān)聯(lián)。王等[17]使用活體雙光子激光掃描技術(shù)結(jié)合免疫印跡和免疫熒光方法,發(fā)現(xiàn)膿毒癥小鼠進行盲腸結(jié)扎和穿刺(cecal ligation and puncture,CLP)誘導后,嘌呤受體配體門控離子通道7(purinergic receptor,ligand gated ion channel 7,P2RX7)激活使小膠質(zhì)細胞活化并募集至具有炎癥反應(yīng)的腦微血管處,與粘附的白細胞相鄰。進而驗證了趨化因子配體受體CX3CL1-CX3CR1信號參與小膠質(zhì)細胞趨化和活化的基礎(chǔ)細胞間通訊。該項研究表明,CLP模型中P2RX7途徑的阻斷有助于降低小膠質(zhì)細胞活化和神經(jīng)血管損傷,由此揭示了膿毒癥腦病中的小膠質(zhì)細胞介導的炎癥反應(yīng)與神經(jīng)元損傷之間存在級聯(lián)反應(yīng)[17]。值得注意的是,這種級聯(lián)反應(yīng)的中間媒介細胞類型,是腦微血管內(nèi)皮細胞。此外,小膠質(zhì)細胞也通過P2RX7信號轉(zhuǎn)導參與阿爾茨海默癥的血管病理機制,藥理抑制P2RX7信號作用可有效改善Aβ誘導的病癥表現(xiàn)。以上證據(jù)揭示了神經(jīng)元、小膠質(zhì)細胞與腦微血管細胞間存在不同類型細胞間的級聯(lián)信號傳導,小膠質(zhì)細胞在神經(jīng)血管耦聯(lián)中的雙向調(diào)節(jié)作用機制是亟待明確的重要分子事件,將為臨床治療提供關(guān)鍵思路。
2.4 腦血管內(nèi)皮細胞-周細胞的細胞間通訊模式腦血管自身調(diào)節(jié)和肌原性張力可調(diào)節(jié)靜息腦血流量水平,并可能促進神經(jīng)血管耦合。血管平滑肌細胞對多種血管活性物質(zhì)作出收縮和舒張反應(yīng),并對下游血管發(fā)出血管舒張刺激。在腦毛細血管中,周細胞充當了血管平滑肌的角色。部分周細胞通過收縮對大腦產(chǎn)生的血管活性信號產(chǎn)生反應(yīng),從而影響毛細血管直徑。一些研究表明,周細胞在建立和維持血管結(jié)構(gòu)和BBB功能中必不可少。研究者利用Pdgfrb-Flp;Cspg4-FSF-CreER小鼠模型發(fā)現(xiàn)周細胞經(jīng)白喉毒素的消融作用后,小鼠表現(xiàn)出急性的BBB破壞,引發(fā)嚴重的缺血和周細胞來源的多效生長因子(pleiotrophin)減少造成神經(jīng)元的丟失[18]。這種快速的神經(jīng)變性級聯(lián)反應(yīng)將周細胞丟失。
在急性和慢性中樞神經(jīng)系統(tǒng)疾病中都發(fā)現(xiàn)了周細胞的減少,在缺血性中風和腦外傷之后迅速凋亡[19]。多個研究報道了缺血性中風不同階段的周細胞系列變化行為[20]。在中風的急性期,周細胞通過收縮使毛細血管堵塞,引發(fā)血液無回流現(xiàn)象;然而有趣的是,隨后周細胞具有促炎和免疫調(diào)節(jié)作用,通過保護管腔外側(cè)的內(nèi)皮細胞并釋放神經(jīng)營養(yǎng)蛋白以穩(wěn)定BBB并保護腦實質(zhì)。此外,在中風后恢復階段,周細胞具有神經(jīng)保護活性,促進血管再生與神經(jīng)元生長。可見周細胞在缺血-再灌注損傷和修復的復雜過程中響應(yīng)內(nèi)皮細胞和神經(jīng)元的動態(tài)變化,發(fā)揮著多重干預(yù)作用。
腦微血管周細胞同樣是BBB的關(guān)鍵組成部分,維持BBB屏障功能和促進血管重塑[21]。先前的發(fā)現(xiàn)表明,來自腦微血管的周細胞增強了原代培養(yǎng)的大鼠腦內(nèi)皮細胞的BBB完整性[22]。研究首次證明了瞬時受體電位M2(transient receptor potential M2,TRPM2)的硝化作用誘導的自噬參與周細胞損傷的病理過程,明確了周細胞損傷的分子機制對于開發(fā)治療神經(jīng)血管功能障礙相關(guān)病理的治療策略。TRPM2是氧化應(yīng)激的傳感器,同時也具有調(diào)節(jié)內(nèi)皮功能障礙和增加肺微血管滲透性等作用。研究者采用氧化鋅納米顆粒(zinc oxide nanoparticles,ZnO-NP)誘導的應(yīng)激模型,免疫印跡實驗表明TRPM2的蛋白表達呈時間依賴性增加。接著,通過使用TUNEL染色發(fā)現(xiàn)ZnO-NP處理后TUNEL陽性周細胞比例增加,而經(jīng)TRPM2-siRNA處理敲低TRPM2的表達可顯著抑制周細胞損傷期間的細胞凋亡和內(nèi)質(zhì)網(wǎng)應(yīng)激反應(yīng)。進一步實驗表明,ZnO-NP誘導引起的周細胞損傷分子事件與TRPM2的Y1485處酪氨酸硝化相關(guān),同時靶向TRPM2-Y1485S的定點突變及敲除TRPM2均可降低周細胞損傷。TRPM2這一分子靶點對于開發(fā)治療神經(jīng)血管功能障礙相關(guān)病理的治療策略具有關(guān)鍵意義[23]。
周細胞的募集和遷移增強了新形成毛細血管的成熟度和穩(wěn)定性。G蛋白偶聯(lián)受體124(G protein-coupled receptor 124,GPR124)有助于維持神經(jīng)系統(tǒng)中血管生成和BBB完整性,內(nèi)皮特異的GPR124缺失可導致小鼠胚胎期死亡[24]。最新研究表明,微球栓塞誘導的微血管損傷缺血中,周細胞中的GPR124表達增加,特別是黏著斑處[25]。形態(tài)學分析顯示,GPR124在黏著斑處與肌動蛋白結(jié)合蛋白連接,并上調(diào)Cdc42的表達。實驗結(jié)果提示,5-氨基-3-(4-嗎啉基)-1,2,3-惡二唑(3-morpholino-sydnonimine,SIN-1)或糖氧剝奪(oxygen-glucose deprivation,OGD)處理使GPR124重新分布到人腦血管周細胞的前邊緣,參與了絲狀偽足的形成,這對于缺血樣損傷情況下導致周細胞極化和遷移至關(guān)重要[25]。因此,周細胞中GPR124參與細胞遷移和分化,可能是涉及神經(jīng)血管重建的腦部疾病的潛在治療靶標。基于神經(jīng)血管耦聯(lián)學說,對腦缺血病理過程中GPR124介導的信號通路,其影響神經(jīng)元和其他膠質(zhì)細胞活化的時空變化規(guī)律還需進一步的研究。
3 展望
“神經(jīng)血管單元”概念的提出是了解神經(jīng)網(wǎng)絡(luò)與腦微血管結(jié)構(gòu)間通訊重要理論基礎(chǔ)。神經(jīng)網(wǎng)絡(luò)系統(tǒng)與血管網(wǎng)絡(luò)系統(tǒng)之間存在著雙向通訊,多種類型細胞的耦聯(lián)和精準通訊共同維持這兩個體系的結(jié)構(gòu)重塑和功能調(diào)節(jié)。中樞神經(jīng)系統(tǒng)的生理過程涉及神經(jīng)元、血管和神經(jīng)膠質(zhì)細胞系統(tǒng)及多種分泌因子的相互協(xié)同作用。病理損傷時健康大腦功能所需的神經(jīng)元、星形膠質(zhì)細胞、小膠質(zhì)細胞和血管細胞的平衡被破壞,影響血腦屏障通透性和完整性。這些不同類型的細胞在疾病的病理生理過程時空動態(tài)變化下,如何實現(xiàn)多維的精確調(diào)控以達到大腦能量和養(yǎng)分的代償性功能,是未來神經(jīng)科學領(lǐng)域還需繼續(xù)探索的重要問題。
開展復雜腦疾病機制研究,需要我們摸清血管細胞與神經(jīng)細胞的耦聯(lián)機制,探尋神經(jīng)細胞通過信號介質(zhì)影響多腦區(qū)功能的規(guī)律,拓寬中樞神經(jīng)系統(tǒng)疾病的研究思路。當前腦部疾病的細胞間通訊規(guī)律研究需要結(jié)合生物化學和神經(jīng)生物學多個領(lǐng)域的不同技術(shù)手段。神經(jīng)血管領(lǐng)域的研究需要借助神經(jīng)藥理基因編輯、神經(jīng)電生理、光遺傳學和化學遺傳學等多種實驗方法準確探究實驗動物中目標基因或蛋白的生理功能及缺失后所產(chǎn)生的細胞間通訊異常病理效應(yīng)。神經(jīng)環(huán)路涉及眾多未知細胞和物質(zhì)類型,神經(jīng)遞質(zhì)和細胞因子間的跨腦區(qū)通訊的實現(xiàn)依據(jù)仍需逐步明確。鑒于神經(jīng)血管耦聯(lián)的復雜性,我們需要超越單一神經(jīng)元的范疇去探究不同腦病中涉及的神經(jīng)-血管網(wǎng)絡(luò)的細胞間分子信號傳導機制,進一步為開發(fā)有效的藥物靶標提供必要的依據(jù)。

