DLTH通過調(diào)節(jié)免疫功能和軟骨降解從而抑制RA的作用
王琪珊,范凱健,2,許冰馨,滕 輝,陳斯佳,王婷玉
(1.上海交通大學(xué)醫(yī)學(xué)院附屬第九人民醫(yī)院藥劑科,上海 200011;2.上海市崇明區(qū)精神衛(wèi)生中心藥劑科,上海 202150)
類風(fēng)濕性關(guān)節(jié)炎(rheumatoid arthritis,RA)是一種慢性自身免疫系統(tǒng)疾病,免疫系統(tǒng)的紊亂被認(rèn)為是導(dǎo)致RA發(fā)病的主要原因。脾臟作為人體內(nèi)最為重要的免疫器官,同時(shí)也是人體內(nèi)淋巴細(xì)胞聚集的場所。T淋巴細(xì)胞主要分為輔助性T淋巴細(xì)胞(T helper cells,Th)和抑制性T淋巴細(xì)胞(suppressor T cells,Ts),其平衡的失調(diào)會導(dǎo)致免疫性疾病的產(chǎn)生。T淋巴細(xì)胞的調(diào)節(jié)作用主要通過其分泌的細(xì)胞因子來實(shí)現(xiàn),而有些細(xì)胞因子具有很強(qiáng)的促炎功能并能加劇RA的病程進(jìn)展。RA的主要特征也包括關(guān)節(jié)炎癥和軟骨破壞。關(guān)節(jié)的慢性炎癥狀態(tài)會導(dǎo)致成纖維細(xì)胞樣滑膜細(xì)胞(fibroblast-like synoviocytes,F(xiàn)LSs)的激活和廣泛介質(zhì)的釋放,而這些介質(zhì)又作用于免疫細(xì)胞和軟骨細(xì)胞,從而加劇炎癥反應(yīng)和軟骨損傷[1]。
糖皮質(zhì)激素(glucocorticoids,GCs)在RA的治療中起著不可替代的作用,因?yàn)樗鼈兛梢钥焖倬徑怅P(guān)節(jié)腫脹和關(guān)節(jié)損傷[2]。但是,由于GCs的多靶點(diǎn)作用,在全身給藥后已報(bào)道了多種不良反應(yīng),例如體質(zhì)量減輕和高血糖。因此,迫切需要提高GCs治療的安全性。為了更加安全有效地使用GCs,研究人員開始開發(fā)針對GCs修飾的藥物。藥物傳遞系統(tǒng)(drug delivery systems,DDS)可以在預(yù)定的時(shí)間或所需的特定位置以預(yù)定的速率傳遞藥物來實(shí)現(xiàn)更好的治療效果并克服常規(guī)藥物制劑的不足。作為先進(jìn)的DDS,可注射的溫敏水凝膠起著非常重要的作用[3]。以體內(nèi)注射的方式,水凝膠在正常人體溫度下變?yōu)榘牍腆w的凝膠。將地塞米松摻入水凝膠后,該系統(tǒng)將能充當(dāng)體內(nèi)持續(xù)的地塞米松釋放庫[4]。可注射的溫敏凝膠系統(tǒng)擁有多種優(yōu)點(diǎn),例如疏水性藥物的溶解度提高、安全性提高、位點(diǎn)特異性遞送。因此,在可注射的溫敏凝膠的輔助下,原位給藥是局部給藥的有效途徑。本研究將通過觀察膠原誘導(dǎo)性關(guān)節(jié)炎(collagen-induced arthritis,CIA)大鼠關(guān)節(jié)腔內(nèi)注射地塞米松溫敏凝膠(dexamethasone-loaded thermosensitive hydrogel,DLTH)后免疫功能和軟骨降解的變化,以確定DLTH治療RA的潛能。
1 材料與方法
1.1 實(shí)驗(yàn)動(dòng)物6-8周齡SPF級雄性Wistar大鼠(體質(zhì)量:200-250 g)30只,由上海交通大學(xué)醫(yī)學(xué)院附屬第九人民醫(yī)院動(dòng)物房所提供[SYXK(滬)2016-0016]。常規(guī)飼養(yǎng)于擁有獨(dú)立通氣籠盒(individual ventilated cages,IVC)的動(dòng)物房,12 h光照和夜循環(huán),溫度(22±2)℃,濕度50%-60%。
1.2 主要試劑與儀器牛Ⅱ型膠原(Chondrex公司,批號170376)、弗氏不完全佐劑(Chondrex公司,170594)、地塞米松(Stemcell Technologies,批號BX27114)、TRIzol(美國Ambion公司,批號184608)。PCR引物(上海生工生物科技有限公司)、PCR試劑盒(日本TaKaRa公司)、動(dòng)物脾臟組織淋巴細(xì)胞分離液(天津?yàn)笕A科生物科技有限公司)。7500實(shí)時(shí)定量PCR儀為美國Thermo Scientific公司產(chǎn)品,酶標(biāo)儀為美國Bio Tek公司產(chǎn)品。
1.3 實(shí)驗(yàn)方法
1.3.1地塞米松溫敏凝膠的制備 將殼聚糖溶解在1%的醋酸溶液中制備成2%的溶液。加入一定量的甘油和地塞米松藥物溶液,并在攪拌中滴入硼砂溶液,最后在pH=7的條件下獲得地塞米松濃度為2.5 g·L-1的新型DLTH。凝膠在室溫為流動(dòng)液體,在37 ℃時(shí)為半固態(tài)水凝膠狀態(tài)(Fig 1)。
Fig 1 Morphology of hydrogel at different conditionsA.At room temperature;B.At 37 ℃
1.3.2CIA模型的建立與給藥 d 0的時(shí)候,將牛Ⅱ型膠原與弗氏不完全佐劑按1 ∶1混勻成乳劑后環(huán)繞大鼠尾根部進(jìn)行注射。d 7時(shí),以同樣方式注射于大鼠尾根部。將造模成功的大鼠隨機(jī)分為模型組和DLTH組,同時(shí)設(shè)置對照組。從d 12起,DLTH組大鼠雙側(cè)膝關(guān)節(jié)內(nèi)各注射40 μL DLTH(即1 mg·kg-1地塞米松),每周2次,連續(xù)3周。對照組和模型組注射等量生理鹽水。
1.3.3ELISA檢測細(xì)胞因子白介素1β(interleukin-1β,IL-1β)和腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)的表達(dá) 在實(shí)驗(yàn)結(jié)束時(shí),腹腔內(nèi)注射戊巴比妥鈉(45 mg·kg-1)麻醉所有大鼠。從麻醉大鼠眼睛的內(nèi)眥靜脈收集血液。將血液在4 ℃下以3 600 r·min-1離心10 min后獲得血清。根據(jù)說明書,使用ELISA試劑盒測量血清中的細(xì)胞因子(TNF-α、IL-1β)水平。
1.3.4脾臟淋巴細(xì)胞的提取和病理學(xué)觀察 給藥結(jié)束后,眼周取血后處死大鼠,取出脾臟,將脾臟組織一半固定于4%的多聚甲醛中,一半取大鼠的脾淋巴細(xì)胞。將3組大鼠的脾臟,研磨、過濾、離心后加紅細(xì)胞裂解液,去除紅細(xì)胞后,可獲得脾臟組織單細(xì)胞懸液。根據(jù)說明書,取等量的脾臟組織單細(xì)胞懸液加于淋巴細(xì)胞分離液液面上,500×g離心30 min。離心后,用吸管吸取環(huán)狀乳白色淋巴細(xì)胞層,并加清洗液再次離心清洗細(xì)胞,得到脾臟淋巴細(xì)胞。將大鼠的脾臟組織進(jìn)行石蠟包埋和病理切片,經(jīng)蘇木精-伊紅染色(hematoxylin-eosin staining,HE)后,用顯微鏡觀察病理改變。根據(jù)生發(fā)中心,動(dòng)脈周圍淋巴鞘(periarterial lymphatic sheath,PALS) 的細(xì)胞密度、邊緣區(qū)來進(jìn)行評分:0分為正常;1分為輕度;2分為中度;3分為重度;4分為極重。
1.3.5膝關(guān)節(jié)的組織病理學(xué)分析 分離后肢,將其置于4%多聚甲醛中24 h,然后用0.5 mol·L-1EDTA脫鈣并包埋在石蠟中。制備5 μm厚的石蠟切片,然后用二甲苯脫蠟,用乙醇梯度脫水,最后進(jìn)行甲苯胺藍(lán)染色,通過甲苯胺藍(lán)染色分析膝關(guān)節(jié)中的軟骨降解情況。
1.3.6膝關(guān)節(jié)的免疫組化分析 將切片在二甲苯中脫蠟,并用梯度乙醇水化。添加蛋白酶K消化緩沖液以修復(fù)抗原,并添加3%過氧化氫以阻斷內(nèi)源性過氧化物酶。用5%的BSA封閉,然后將它們與一抗(基質(zhì)金屬蛋白酶9(matrix metalloproteinase-9,MMP-9)、MMP-13,聚集蛋白聚糖酶5(A disintegrin and metalloproteinase with thrombospondin motifs-5,ADAMTS-5)在4 ℃孵育過夜。洗滌一抗,并與二抗在室溫下孵育30 min,然后添加DBA進(jìn)行顯色。用Mayer蘇木精復(fù)染后封片。由兩名獨(dú)立的觀察員評估關(guān)節(jié)軟骨中MMP-9、MMP-13和ADAMTS-5的表達(dá)水平。
1.3.7PCR檢測相關(guān)細(xì)胞因子的表達(dá)情況 分離對照組、模型組和給藥組大鼠脾淋巴細(xì)胞和軟骨組織進(jìn)行PCR檢測。使用TRIzol試劑提取總RNA,并測量其濃度和純度。根據(jù)標(biāo)準(zhǔn)程序使用cDNA反轉(zhuǎn)錄試劑盒逆轉(zhuǎn)錄成cDNA。實(shí)時(shí)熒光定量PCR引物由上海生工生物有限公司合成。引物見Tab 1。
2 結(jié)果
2.1 DLTH對CIA大鼠血清中IL-1β、TNF-α含量的影響與對照組相比,模型組大鼠血清中IL-1β、TNF-α的表達(dá)量明顯升高。在給予DLTH治療后,這些炎癥因子的表達(dá)都明顯降低,見Fig 2。
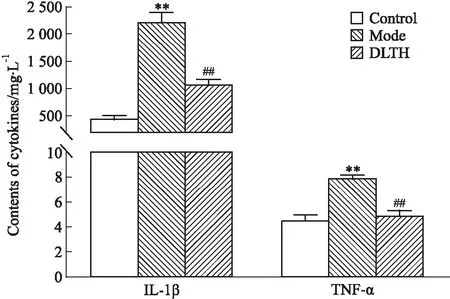
Fig 2 Effects of IL-1β and TNF-α **P<0.01 vs control group;##P<0.01 vs model group.
2.2 DLTH對CIA模型脾臟病理的影響與對照組相比,CIA大鼠脾臟結(jié)構(gòu)出現(xiàn)嚴(yán)重的變形,白髓增殖明顯,纖維囊變薄,并且有大量生發(fā)中心形成。在給予DLTH治療后,脾臟結(jié)構(gòu)病理性變化明顯改善,見Fig 3。
2.3 DLTH對CIA大鼠脾淋巴細(xì)胞中炎癥因子的影響相較對照組,模型組脾淋巴細(xì)胞中,TNF-α mRNA的表達(dá)量明顯升高。在給予DLTH治療后,其表達(dá)量明顯降低。與對照組相比,模型組中Th1細(xì)胞相關(guān)的IL-2、干擾素γ(interferon-γ,IFN-γ),Th2細(xì)胞相關(guān)的IL-4、IL-5,及Th17 細(xì)胞相關(guān)的IL-17a的基因表達(dá)量明顯增加,而Treg相關(guān)的細(xì)胞因子IL-10和轉(zhuǎn)化生長因子-β(transforming growth factor-β,TGF-β)基因表達(dá)量顯著降低。DLTH膝關(guān)節(jié)給藥后,以上炎癥狀態(tài)可明顯被逆轉(zhuǎn),見Fig 4。
2.4 DLTH對CIA大鼠脾淋巴細(xì)胞中特異性轉(zhuǎn)錄因子的影響T-bet,RORγT、GATA3和Foxp3是Th1、Th17、Th2和Treg的特異性轉(zhuǎn)錄因子。T-bet、RORγT的基因分別是Tbx21、RORc。與對照組相比,模型組中脾淋巴細(xì)胞中Tbx21、RORc的mRNA表達(dá)升高,GATA3、Foxp3的mRNA表達(dá)下降。在給予DLTH治療后,Tbx21、RORc的mRNA表達(dá)下降,GATA3、Foxp3的mRNA表達(dá)上升,差異均具有統(tǒng)計(jì)學(xué)意義。與對照組相比,模型組Tbx21/GATA3、RORc/Foxp3升高,給藥后比值降低,見Fig 5。
2.5 DLTH對CIA大鼠膝關(guān)節(jié)軟骨的影響大鼠膝關(guān)節(jié)甲苯胺藍(lán)染色病理學(xué)分析表明,與對照組大鼠相比,CIA大鼠膝關(guān)節(jié)軟骨層軟骨降解明顯,DLTH給藥后可以明顯改善嚴(yán)重的軟骨損傷,見Fig 6。
2.6 DLTH對CIA大鼠軟骨中相關(guān)酶表達(dá)的影響MMP-9、MMP-13、ADAMTS-5是在軟骨降解起重要作用的酶。與對照組相比,CIA大鼠軟骨層MMP-9、MMP-13、ADAMTS-5的表達(dá)明顯升高。在給予DLTH治療后,MMP-9、MMP-13、ADAMTS-5的表達(dá)都明顯降低,見Fig 7。
2.7 DLTH對CIA大鼠軟骨中炎癥因子和基質(zhì)金屬蛋白酶基因表達(dá)的影響與對照組相比,模型組大鼠軟骨組織中IL-1β、IL-6、IL-17、TNF-α mRNA的表達(dá)量明顯升高。在給予DLTH治療后,這些炎癥因子的表達(dá)量均明顯降低。與對照組相比,CIA大鼠軟骨中MMP-3、MMP-9、MMP-13、ADAMTS-5的mRNA表達(dá)顯著升高。在給予DLTH治療后,這些軟骨相關(guān)降解基因的表達(dá)都顯著降低,見Fig 8。
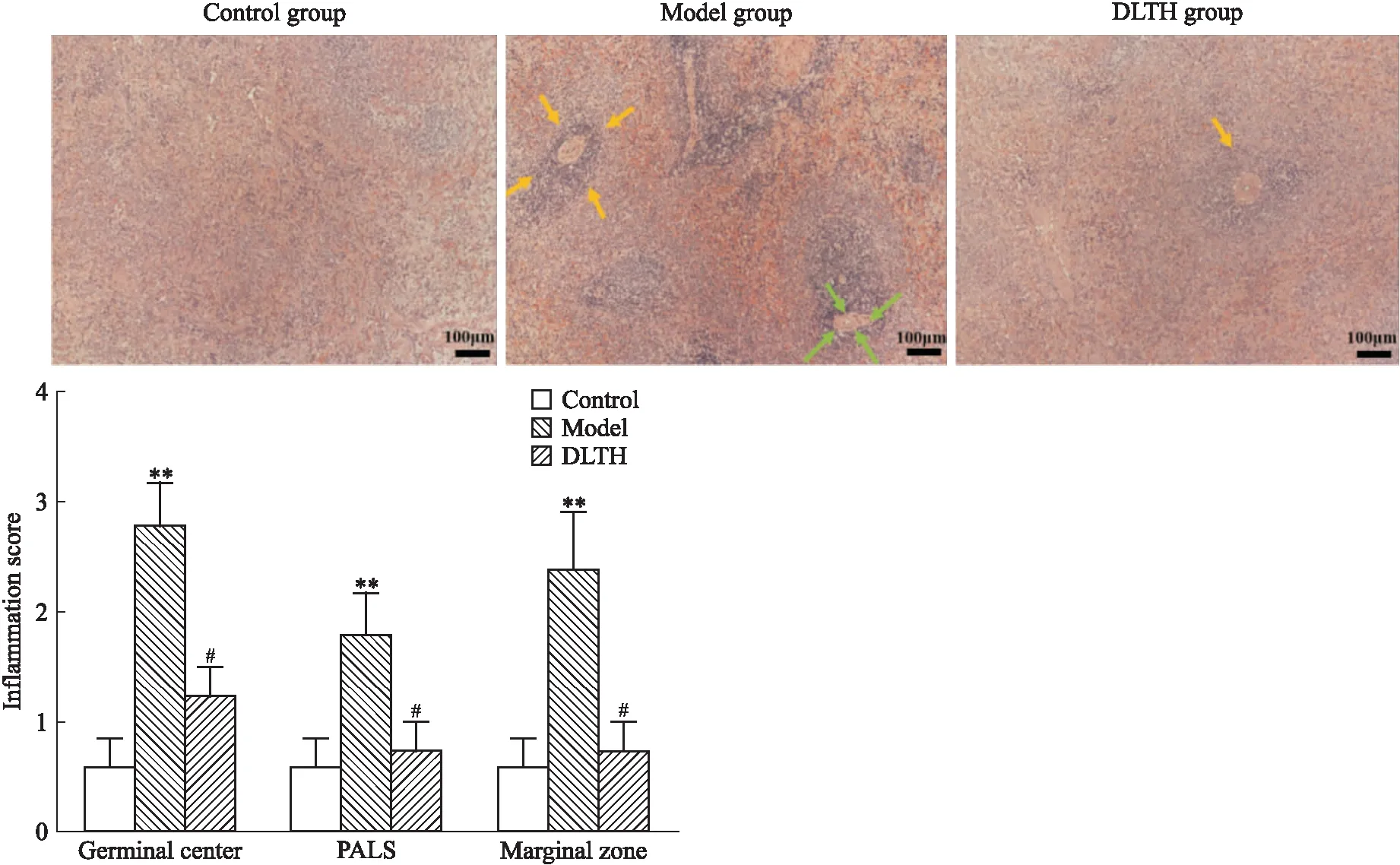
Fig 3 The pathological changes of spleen The yellow arrows indicate white pulp and the green arrows indicate germinal Scale bar=100 μm.**P<0.01 vs control group;#P<0.01 vs model group.
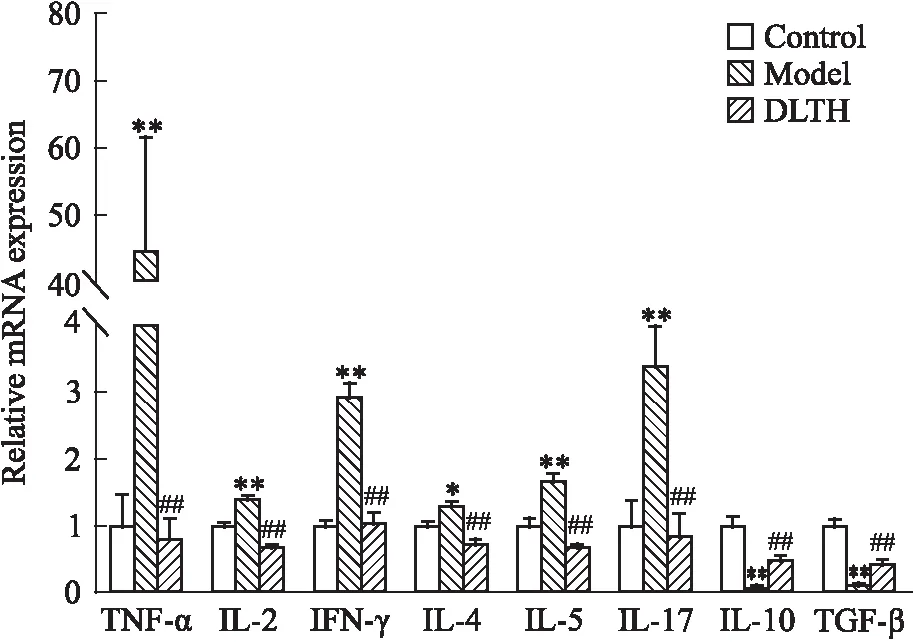
Fig 4 Expression of splenic lymphocyte *P<0.05,**P<0.01 vs control group;##P<0.01 vs model group.
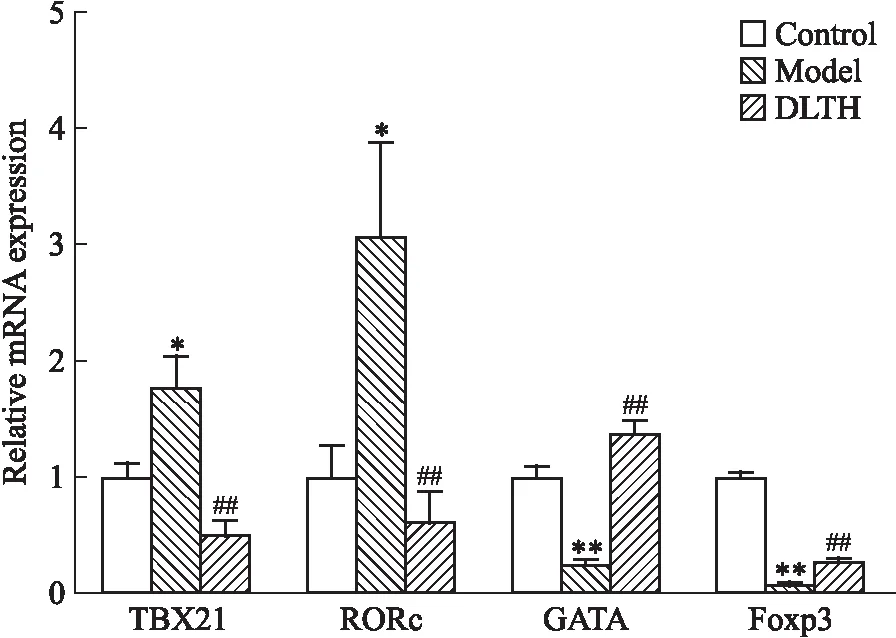
Fig 5 Expression of splenic lymphocyte specific transcription *P<0.05,**P<0.01 vs control group;##P<0.01 vs model group.
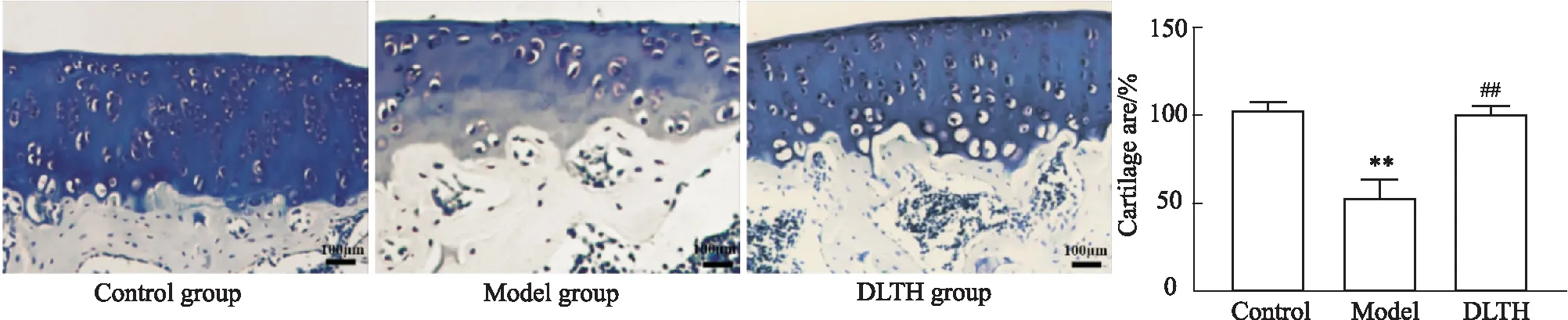
Fig 6 Histological changes of knee **P<0.01 vs control group;##P<0.01 vs model group.Scale bar=100 μm.
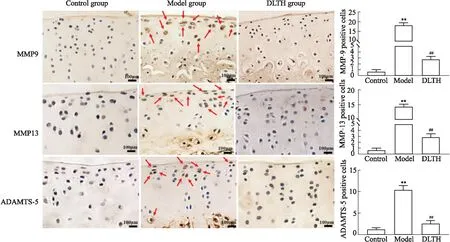
Fig 7 Effects of related enzyme expression in Red arrows indicate positive cells.**P<0.01 vs control group;##P<0.01 vs model group.Scale bar=100 μm.
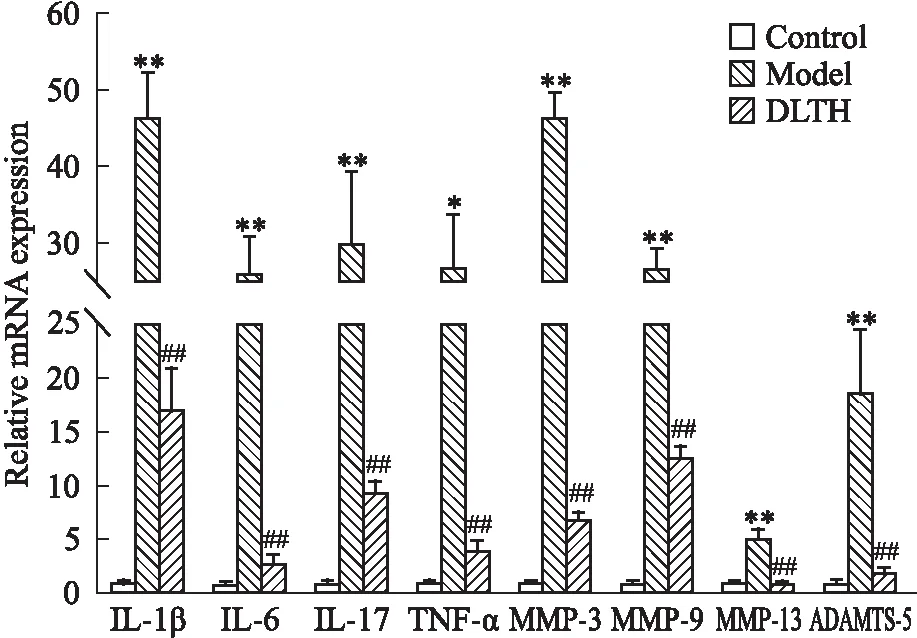
Fig 8 Effects of inflammatory and matrix metalloproteinase genes expression in **P<0.01 vs control group;##P<0.01 vs model group.
3 討論
RA是一種自身免疫性疾病,其主要特征是炎癥引起的關(guān)節(jié)破壞。雖然目前尚無治愈 RA 的方法,但已經(jīng)有多種藥物可以用來減緩疾病發(fā)展的進(jìn)程。目前臨床上應(yīng)用比較多的藥物包括非甾體類抗炎藥、糖皮質(zhì)激素和抗風(fēng)濕藥物。糖皮質(zhì)激素類藥物雖然已被證明具有緩解疼痛的作用,但不能緩解疾病進(jìn)展,且伴隨的不良反應(yīng)也令人不安。殼聚糖是一種天然多糖,具有生物相容性、生物降解性、無毒、生理惰性,并且對蛋白質(zhì)有顯著親和力、耐細(xì)菌、止血等許多特性。由于其良好的生物相容性,殼聚糖被廣泛用于制備微球制劑[5-6]。殼聚糖基材常用于藥物遞送領(lǐng)域,作為藥物可持續(xù)釋放的基材。特別是含有多種多元醇(如甘油、乙二醇和山梨醇)的殼聚糖,由于它們能夠在特定靶點(diǎn)持續(xù)釋放特定的藥物,可作為注射性的凝膠,因此備受關(guān)注。這些多元醇可使殼聚糖保持液態(tài),在酸性溶液中,多元醇在殼聚糖周圍形成水的屏障,并在較高的pH值和較低的溫度下保持殼聚糖的溶解度[7]。近年來,有研究報(bào)道,殼聚糖、高甘油鈉或甘油和飽和硼砂溶液混合制備可形成溫敏水凝膠[8]。因此,在溫敏殼聚糖基材的凝膠載體研究中,甘油也受到了廣泛的關(guān)注。硼砂常常被用作該溫敏水凝膠體系的pH調(diào)節(jié)劑[9]。因此,我們選擇殼聚糖-甘油-硼砂作為地塞米松的載體。殼聚糖-甘油-硼砂原位凝膠是一種優(yōu)良的局部給藥系統(tǒng),是一種可注射的微創(chuàng)溶液,在局部給藥后會隨溫度變化而變成半固態(tài)凝膠。DLTH通過直接注射到關(guān)節(jié)腔室,不僅能達(dá)到在關(guān)節(jié)處富集藥物,降低全身毒性的作用,還能延長藥物釋放時(shí)間,提高地塞米松的治療指數(shù),降低不良反應(yīng)風(fēng)險(xiǎn)。因此,本研究將探索地塞米松溫敏凝膠關(guān)節(jié)腔內(nèi)注射治療后對RA的免疫調(diào)節(jié)和軟骨保護(hù)作用。
RA起病的主要原因包括自身抗體形成,激活T細(xì)胞和B細(xì)胞,釋放大量炎癥因子,包括IL-1β、TNF-α。IL-1β、TNF-α參與全身炎癥反應(yīng),導(dǎo)致關(guān)節(jié)組織破壞。并且,TNF-α的釋放,可使巨噬細(xì)胞與促炎因子結(jié)合,進(jìn)一步加重全身炎癥。實(shí)驗(yàn)中,模型組大鼠血清IL-1β、TNF-α水平升高,DLTH給藥后明顯降低血清IL-1β、TNF-α含量,提示DLTH可改善RA全身炎癥反應(yīng)。脾臟是機(jī)體最為重要的免疫器官之一,可以準(zhǔn)確反映機(jī)體的免疫情況。在實(shí)驗(yàn)中,對照組大鼠的脾臟病理切片顯示,白髓和紅髓界限分明,且被厚的纖維囊所包裹。而CIA大鼠的脾組織結(jié)構(gòu)出現(xiàn)明顯的扭曲且纖維囊變薄,大量生發(fā)中心形成。在給予 DLTH治療后,脾臟病理性結(jié)構(gòu)變化得到顯著改善。脾臟在調(diào)節(jié)機(jī)體免疫的時(shí)候,還會通過調(diào)節(jié)Th細(xì)胞來調(diào)節(jié)機(jī)體免疫反應(yīng)。作為CD4+Th細(xì)胞的四個(gè)重要亞型,Th1、Th2、Th17和Treg細(xì)胞與RA顯著相關(guān)。RA患者的Th1/Th2比值增加,并且與疾病活動(dòng)呈正相關(guān)[10]。RA疾病可能還會損害以Th17/Treg比值低為特征的Th17與Treg之間的平衡。因此,調(diào)節(jié)Th1/Th2和Th17/Treg失衡狀態(tài)有利于治療RA。本次研究發(fā)現(xiàn)DLTH可能通過抑制大鼠T細(xì)胞向Th1和Th17分化來調(diào)整Th1/Th2、Th17/Treg失衡狀態(tài),最終改變CIA大鼠免疫應(yīng)答紊亂狀態(tài)。
RA中免疫紊亂會導(dǎo)致炎癥反應(yīng)、軟骨破壞等。炎性細(xì)胞因子,如IL-1β、TNF-α、IL-6、IL-17a,在關(guān)節(jié)炎中起非常重要的作用[11-12]。這些細(xì)胞因子表達(dá)的升高會刺激軟骨或滑膜內(nèi)的炎癥細(xì)胞產(chǎn)生MMPs和ADAMTS。關(guān)節(jié)軟骨主要是由軟骨細(xì)胞和細(xì)胞外基質(zhì)(extracellular matrix,ECM) 組成,ECM主要是由組織液、膠原蛋白和蛋白多糖所組成。MMPs 是一類在ECM的降解過程中占據(jù)重要地位的蛋白酶超家族。MMPs 的表達(dá)增加與 RA 疾病的進(jìn)展有顯著的相關(guān)性。在各種MMPs中,MMP-3、MMP-9和MMP-13對膠原蛋白的降解最為重要。Tuncer等[13]研究發(fā)現(xiàn),RA患者的血清中MMP-3的表達(dá)水平顯著高于對照組,且軟骨破壞嚴(yán)重。MacLauchlan等[14]研究發(fā)現(xiàn),MMP-9表達(dá)的升高會增強(qiáng)破骨細(xì)胞的活性和形成從而導(dǎo)致軟骨破壞。MMP-13過表達(dá)的轉(zhuǎn)基因小鼠發(fā)生自發(fā)性的關(guān)節(jié)內(nèi)軟骨破壞,而MMP-13敲除小鼠會在軟骨內(nèi)骨化表現(xiàn)出明顯的障礙[15]。ADAMTS是一種聚集蛋白聚糖酶,在軟骨ECM的分解代謝中起著重要的作用[16]。ADAMTS的家族成員眾多,其中ADAMTS-4和ADAMTS-5跟關(guān)節(jié)軟骨密切相關(guān)。Liacini等[17]研究發(fā)現(xiàn),中藥雷公藤F(tripterygium wilfordii Hook F,TWHF)可以抑制軟骨細(xì)胞中 ADAMTS-4 的表達(dá)從而具有軟骨保護(hù)作用。Glasson等[18]研究發(fā)現(xiàn),ADAMTS-5的缺失會抑制關(guān)節(jié)炎模型中的軟骨損傷。在本次研究中,CIA大鼠軟骨破壞嚴(yán)重,且軟骨細(xì)胞中炎癥因子(IL-6、IL-17a、TNF-α、IL-1β)和降解酶(MMP-3、MMP-9、MMP-13、ADAMTS-5)表達(dá)增加。在給予DLTH治療后,軟骨破壞現(xiàn)象明顯減輕,且炎癥因子和降解酶表達(dá)顯著降低。
綜上,通過體內(nèi)研究證明DLTH對RA具有明顯的免疫調(diào)節(jié)和軟骨保護(hù)作用。因此,DLTH作為地塞米松的新劑型,可能為治療RA提供一種更為有效和安全的方法。

