低溫干旱環(huán)境對紫花苜蓿根頸耐寒性的影響
徐洪雨, 甄莉麗, 李鈺瑩, 董寬虎, 李向林
(1. 山西農(nóng)業(yè)大學(xué)草業(yè)學(xué)院, 山西 太谷 030801;2. 對外經(jīng)濟(jì)貿(mào)易大學(xué)外語學(xué)院, 北京 100029;3. 中國農(nóng)業(yè)科學(xué)院北京畜牧獸醫(yī)研究所, 北京100193)
紫花苜蓿(MedicagosativaL.,以下簡稱苜蓿)是一種蛋白含量豐富的優(yōu)質(zhì)飼草,其在我國的種植面積不斷擴(kuò)大,且主要集中在內(nèi)蒙古、甘肅和新疆等北方地區(qū)[1]。我國北方冬季寒冷少雪,因此苜蓿越冬失敗、不能正常返青時(shí)有發(fā)生,給生產(chǎn)上造成了嚴(yán)重的經(jīng)濟(jì)損失。在管理措施中,有研究表明澆灌越冬水可提高苜蓿的越冬能力[2]。秋冬季節(jié),氣溫和地面溫度不斷下降,并一直向地下傳遞。當(dāng)氣溫下降至凍結(jié)溫度后,地下土壤剖面就會(huì)形成深度逐漸增加的凍土層。在形成的凍土層中,上層土壤剖面(約20~40 cm)的溫度與地面溫度具有很好的相關(guān)性,但因溫度波向地下傳遞需要一定的時(shí)間,上層土壤剖面的溫度與地面溫度相比仍存在很大的滯后性[3]。另外,土壤凍結(jié)后,土壤孔隙被冰完全充填,凍土層可阻隔大氣與土壤空氣的熱交換[3]。因此,在苜蓿整個(gè)越冬過程中,土壤凍土層能夠緩解低溫和溫度劇烈變化對根頸和根系的傷害[4-5]。但北方地區(qū)(如內(nèi)蒙古阿魯科爾沁旗和甘肅等地)多為沙性土,沙性土保水能力差,澆灌越冬水時(shí)水分快速下滲,加上蒸發(fā)和空氣循環(huán)等因素導(dǎo)致表層土壤水分丟失嚴(yán)重,使越冬期間表土層內(nèi)水分含量低,難以形成凍土層。此種情況下,越冬水并不能對苜蓿根頸和根系起到很好的保護(hù)作用。2019年2月,對中國農(nóng)業(yè)科學(xué)院國際農(nóng)業(yè)高新技術(shù)產(chǎn)業(yè)園(河北,廊坊)內(nèi)‘WL440HQ’苜蓿的越冬情況調(diào)查時(shí)發(fā)現(xiàn),當(dāng)月平均氣溫-6℃,0~10 cm表土層范圍內(nèi)的土壤(沙質(zhì)土)含水量僅約田間持水量的20%~30%,土壤松散,苜蓿根頸失水嚴(yán)重,存在萎縮現(xiàn)象(圖1-A),經(jīng)多樣點(diǎn)測定,根頸組織細(xì)胞液相對滲透率達(dá)到81.7%~89.6%。2019年4月,再次對產(chǎn)業(yè)園內(nèi)的苜蓿進(jìn)行調(diào)查,當(dāng)月平均氣溫已達(dá)8℃,苜蓿返青率不足10%,原2月份調(diào)查時(shí)失水萎縮的根頸絕大部分已發(fā)生霉變(圖1-B)。冬季寒冷和土壤干旱共同組成低溫干旱環(huán)境,此種不利的環(huán)境條件可能是導(dǎo)致苜蓿無法順利越冬的原因之一。

圖1 紫花苜蓿越冬期間根頸萎蔫及返青期根頸霉變的情況
在低溫脅迫下,植物細(xì)胞膜發(fā)生龜裂,透性增大,當(dāng)細(xì)胞液相對滲透率達(dá)到50%時(shí)所對應(yīng)的溫度稱為低溫半致死溫度(LT50),常用來衡量植物的耐寒性[6-8]。根頸靠近地表,是苜蓿返青時(shí)新枝條的生長點(diǎn),因此根頸也被認(rèn)為是苜蓿最重要的越冬組織[9],常用根頸的LT50來衡量苜蓿的耐寒性。有研究認(rèn)為,脯氨酸不僅可防止細(xì)胞膜脫水,而且具有穩(wěn)定蛋白質(zhì)的作用,是影響苜蓿抗寒性的主要氨基酸[10]。在低溫脅迫初期,苜蓿通過冷適應(yīng)積累物質(zhì)以提高自身的抗寒能力,其中可溶性糖是對低溫條件反應(yīng)較為敏感的物質(zhì)[11]。可溶性糖不僅具有滲透調(diào)節(jié)的作用,還具有冷凍保護(hù)的作用[12-13]。此外,苜蓿的耐寒性還與冷適應(yīng)期間低溫誘導(dǎo)可溶性蛋白的積累有關(guān),如脫水蛋白和營養(yǎng)貯藏蛋白[14]。可溶性蛋白可與細(xì)胞成分形成氫鍵從而結(jié)合水分,發(fā)揮冷凍保護(hù)劑的作用[10,15]。有研究表明,K-3脫水蛋白的轉(zhuǎn)錄水平在冷適應(yīng)過程中顯著提高,并且在苜蓿抗寒性的輪回選擇性育種中,該基因在苜蓿群體中正等位基因的頻率也會(huì)增加[14]。低溫導(dǎo)致細(xì)胞脫水時(shí),K3脫水蛋白在維持細(xì)胞膜的完整性中發(fā)揮著重要作用[16-17],與苜蓿的耐寒性息息相關(guān)[18]。
為研究冬季冷凍期土壤干旱對苜蓿越冬的影響,本研究在實(shí)驗(yàn)室內(nèi)通過培養(yǎng)箱控溫和更換表土試驗(yàn),模擬苜蓿越冬過程中的低溫干旱環(huán)境,借助根頸組織細(xì)胞膜透性、低溫半致死溫度、細(xì)胞活力和丙二醛等指標(biāo),分析低溫干旱環(huán)境對不同秋眠級苜蓿根頸耐寒性的影響,并通過根頸組織含水量、脯氨酸、可溶性糖和可溶性蛋白等脅迫抗逆標(biāo)志物含量,分析低溫干旱環(huán)境對苜蓿耐寒性影響的原因。本研究結(jié)果將為研究如何通過管理措施提高苜蓿越冬能力提供參考。
1 材料與方法
1.1 試驗(yàn)材料
本試驗(yàn)選擇的苜蓿品種為‘WL440HQ’(秋眠級6.0,WL)和‘肇東’(秋眠級2.0,ZD),ZD種子購買于甘肅大業(yè)牧草科技有限責(zé)任公司,WL苜蓿種子購買于北京正道生態(tài)科技有限公司。試驗(yàn)共涉及3個(gè)處理階段,2種水分處理,4次生物學(xué)重復(fù)。
試驗(yàn)所用的苜蓿苗在中國農(nóng)業(yè)科學(xué)院國際農(nóng)業(yè)高新技術(shù)產(chǎn)業(yè)園區(qū)進(jìn)行培育,園區(qū)位于河北省廊坊市萬莊鎮(zhèn),占地約1 330 ha,全年光照充足,年平均氣溫11.9℃,年平均降水量為554.9 mm,土壤為沙質(zhì)土,田間持水量為0.203 3 g·g-1(水/干土)。2018年5月育苗,2019年5月在培育好的材料中選取根系大小相近的2個(gè)品種苜蓿苗,而后移栽到預(yù)先準(zhǔn)備好的PVC管(直徑10 cm,高度15 cm)內(nèi),管內(nèi)填充育苗田里的沙質(zhì)土壤。將移栽好的苜蓿苗帶回培養(yǎng)室內(nèi)進(jìn)行為期1個(gè)月的恢復(fù)生長,PVC管內(nèi)的土壤含水量通過稱重法維持在田間持水量的75%。進(jìn)行恢復(fù)生長期間,培養(yǎng)室內(nèi)的其它條件設(shè)置為:溫度(24±2)/(20±2)℃(晝/夜),光照時(shí)長12 h,光照強(qiáng)度600~800 μmol·m-2·s-1。
1.2 試驗(yàn)處理及取樣
本研究的試驗(yàn)處理過程如圖2所示,具體處理細(xì)節(jié)如下所述:
(1)適應(yīng)性生長。苜蓿苗在培養(yǎng)室恢復(fù)生長1個(gè)月后,將苗轉(zhuǎn)移到低溫光照培養(yǎng)箱(LRH-200-GD,THK Ltd.,廣東)內(nèi)進(jìn)行適應(yīng)性生長1周。培養(yǎng)箱內(nèi)的條件控制:24/20℃(晝/夜)、光照12 h和光照強(qiáng)度400 μmol·m-2·s-1。
(2)冷適應(yīng)處理(階段1)。適應(yīng)性生長1周結(jié)束后,降低培養(yǎng)箱溫度對苜蓿苗進(jìn)行冷適應(yīng)處理。將培養(yǎng)箱溫度設(shè)置從24/20℃(晝/夜)降低到4/0℃(晝/夜),光照條件不變,冷適應(yīng)處理1周。此處理階段不涉及控水處理,土壤含水量保持75%田間持水量。冷適應(yīng)處理結(jié)束后,剪掉所有苜蓿地上部,烘干稱重測定含水量和地上部干重。每個(gè)品種隨機(jī)選取4管(Sampling 1,S1),剪掉地上部,烘干稱重測定含水量及干重;將地下部洗凈吸干,稱取濕重,然后將根頸和根系分開,根系烘干并計(jì)算地下部含水量,根據(jù)含水量及地下部總鮮重,計(jì)算地下部總干重;根頸部位用于測定冷適應(yīng)處理后苜蓿根頸的細(xì)胞液相對滲透率、LT50和細(xì)胞活力的大小以及丙二醛、脯氨酸、總可溶性糖和總可溶性蛋白的含量。此階段2個(gè)品種的試驗(yàn)處理樣品分別標(biāo)記為WL-1-B和ZD-1-B。
(3)剪掉地上部和更換表層土壤。在冷凍處理之前,剪掉地上部,模擬苜蓿越冬期地上部枯黃。將階段1取樣后每個(gè)品種剩余的樣品分別隨機(jī)分成2份,其中1份用烘干的陶粒(直徑1 mm)替換表層5 cm范圍內(nèi)的表土,模擬越冬期土壤干旱條件,另外1份保持原土壤及75%田間持水量的含水量不變。
(4)冷凍處理(階段2和階段3)。剪掉地上部和更換表層土壤后,關(guān)閉培養(yǎng)箱光照(地上部已剪掉,光合作用停止),將培養(yǎng)箱溫度設(shè)置從4/0℃(晝/夜)降低到-2℃(夜),對苜蓿進(jìn)行冷凍處理,以模擬北方苜蓿越冬。在冷凍處理5天后(Sampling 2,S2)和7天后(Sampling 3,S3)分別取樣一次,地下部樣品的處理參考冷適應(yīng)階段取樣。在階段2和階段3處理后,未更換表層土壤的2個(gè)苜蓿品種樣品冷凍處理后分別標(biāo)記為WL-2-B,WL-3-B,ZD-2-B和ZD-3-B,而更換表層土壤的2個(gè)苜蓿品種樣品冷凍處理后分別標(biāo)記為WL-2-K,WL-3-K,ZD-2-K和ZD-3-K。
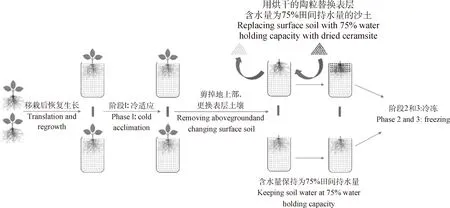
圖2 試驗(yàn)過程示意圖
1.3 試驗(yàn)指標(biāo)的測定
(1)細(xì)胞液相對滲透率和LT50的測定
本研究采用細(xì)胞液相對滲透率和LT50作為判斷各處理間根頸耐寒性的主要依據(jù)。受低溫脅迫,細(xì)胞膜受到破壞,細(xì)胞液滲透增加,通過組織細(xì)胞電導(dǎo)率計(jì)算細(xì)胞液相對滲透率。具體計(jì)算公式如下:
相對滲透率(%)=(EL1-EL)/(EL2-EL)×100
(1)
式(1)中EL1為試驗(yàn)處理后根頸樣品的電導(dǎo)率;EL2為經(jīng)高壓滅菌鍋蒸煮后根頸樣品的電導(dǎo)率,代表細(xì)胞完全破裂、細(xì)胞液完全滲出式樣品的電導(dǎo)率;EL為浸泡根頸樣品所用蒸餾水的電導(dǎo)率。
LT50的測定原理是對樣品進(jìn)行不同溫度的冷凍,并測定每一冷凍溫度下的細(xì)胞液相對滲透率,再根據(jù)Logistic方程計(jì)算出細(xì)胞液相對滲透率為50%所對應(yīng)溫度即為LT50。試驗(yàn)處理后,苜蓿根頸組織LT50的測定及計(jì)算方法參考徐洪雨[19-20]的方法。本研究測定根頸組織LT50時(shí),對樣品進(jìn)行冷凍的溫度設(shè)置9個(gè)梯度,分別為-2℃,-4℃,-6℃,-8℃,-10℃,-12℃,-14℃,-16℃和-18℃。
(2)細(xì)胞活力的測定
根頸細(xì)胞活力的測定參考王學(xué)奎[21]測定植物根系細(xì)胞活性的方法。
(3)丙二醛、脯氨酸、總可溶性糖和總可溶性蛋白的測定
參考Catola[22]和Nemat[23]的方法提取樣品,參考Draper[24],Troll[25],Yemm[26]和Sedmak[27]的方法分別對丙二醛、脯氨酸、總可溶性糖和總可溶性蛋白的含量進(jìn)行測定。
1.4 數(shù)據(jù)分析
采用最小顯著差數(shù)法(LSD),對試驗(yàn)各階段間指標(biāo)變化的差異顯著性以及同一階段處理間比較的差異顯著性進(jìn)行分析,差異顯著標(biāo)準(zhǔn)為P<0.05。
根據(jù)根頸組織的LT50、細(xì)胞液相對滲透率、細(xì)胞活力、含水量、干物質(zhì)量以及丙二醛、脯氨酸、總可溶性糖和總可溶性蛋白的含量,采用隸屬函數(shù)法對2個(gè)品種苜蓿在整個(gè)試驗(yàn)期間的表現(xiàn)進(jìn)行綜合評價(jià)。
2 結(jié)果與分析
2.1 低溫干旱環(huán)境對苜蓿耐寒性的影響分析
2.1.1細(xì)胞液相對滲透率和低溫半致死溫度大小 圖3-A為試驗(yàn)期間苜蓿根頸細(xì)胞液相對滲透率的變化情況,其大小可表征細(xì)胞膜的透性。除WL-K外,WL-B,ZD-B和ZD-K樣本的根頸在試驗(yàn)期間細(xì)胞液相對滲透率無顯著性變化。經(jīng)過階段2的冷凍,WL-K樣本的根頸細(xì)胞液相對滲透率明顯提高,其值達(dá)到62.26%;經(jīng)過階段3的冷凍,其值達(dá)到66.99%。據(jù)此判斷,低溫干旱環(huán)境對WL苜蓿根頸的影響極其顯著,導(dǎo)致細(xì)胞液相對滲透率超過50%,即意味著細(xì)胞死亡,但此環(huán)境對ZD苜蓿根頸的影響并不顯著。
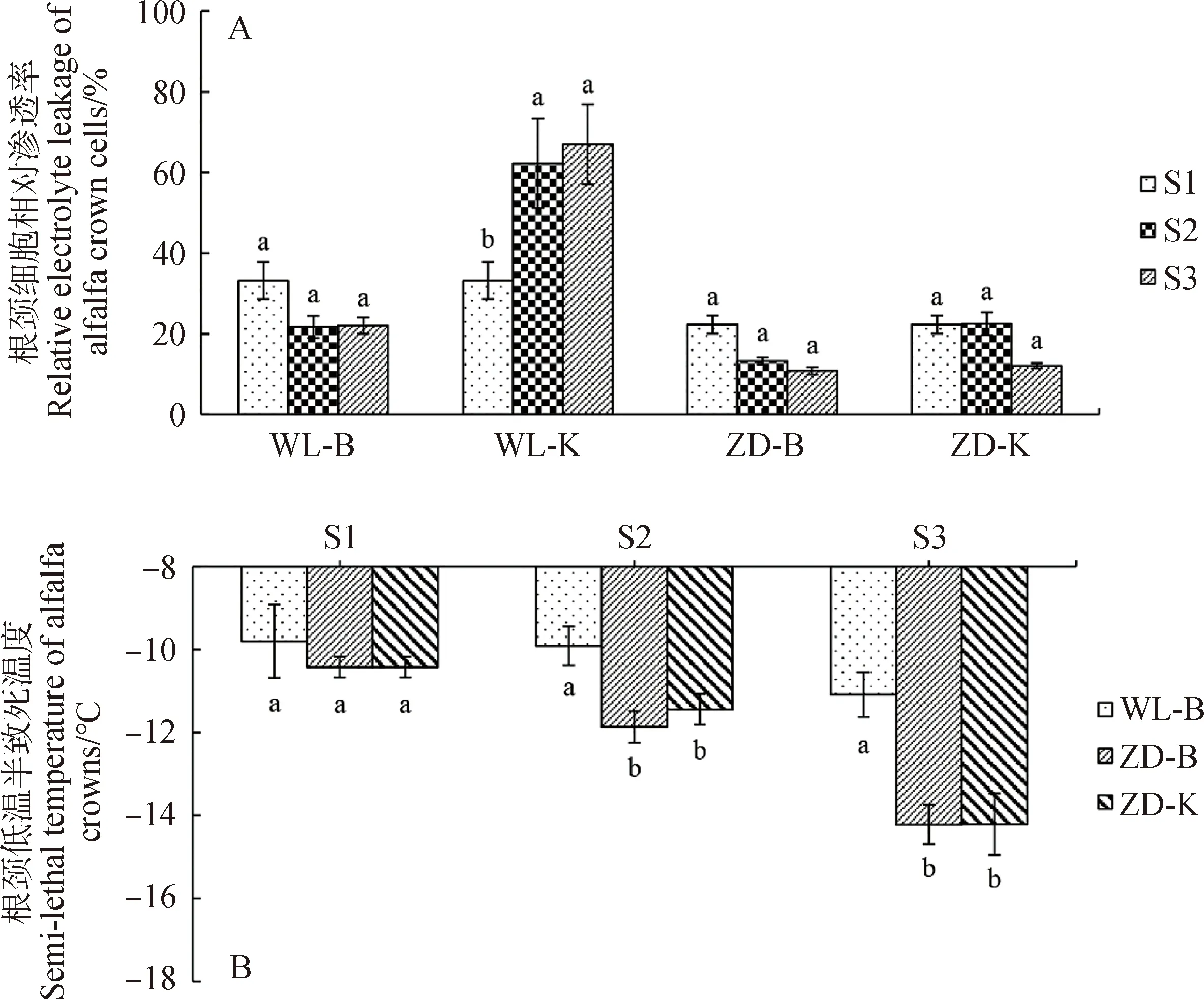
圖3 試驗(yàn)期間根頸細(xì)胞膜透性和低溫半致死溫度
圖3-B為試驗(yàn)期間WL-B,ZD-B和ZD-K樣本根頸的LT50的變化。經(jīng)過階段2的冷凍,ZD-B和ZD-K中根頸的LT50均有明顯降低。經(jīng)過階段3的冷凍后,ZD-K和ZD-B中根頸的LT50顯著低于WL-B中根頸的(P<0.05),但在ZD-K和ZD-B樣本間根頸LT50的大小并無顯著性差異。對于WL苜蓿而言,冷凍處理已使WL-K中的根頸致死,其LT50大小遠(yuǎn)遠(yuǎn)高于WL-B中根頸的LT50大小。綜上,本研究中更換表土后的土壤干旱嚴(yán)重影響了WL苜蓿在零下低溫環(huán)境中的耐寒性,但對ZD苜蓿并無顯著性影響。
2.1.2細(xì)胞活力大小 圖4為試驗(yàn)期間苜蓿根頸細(xì)胞活力的變化情況。冷適應(yīng)結(jié)束后,ZD-B中根頸的細(xì)胞活力顯著高于WL-B中根頸的(P<0.05)。而經(jīng)過階段2和階段3的冷凍,4個(gè)樣本中根頸的細(xì)胞活力均有所下降。在取樣點(diǎn)S2和S3,根頸細(xì)胞活力的大小在樣本間的比較為:ZD-B>ZD-K>WL-B> WL-K(P<0.05)。由此可見,經(jīng)過冷適應(yīng)和冷凍處理后,ZD苜蓿根頸的細(xì)胞活力大于WL苜蓿的,不控水處理的根頸細(xì)胞活力大于控水處理的。
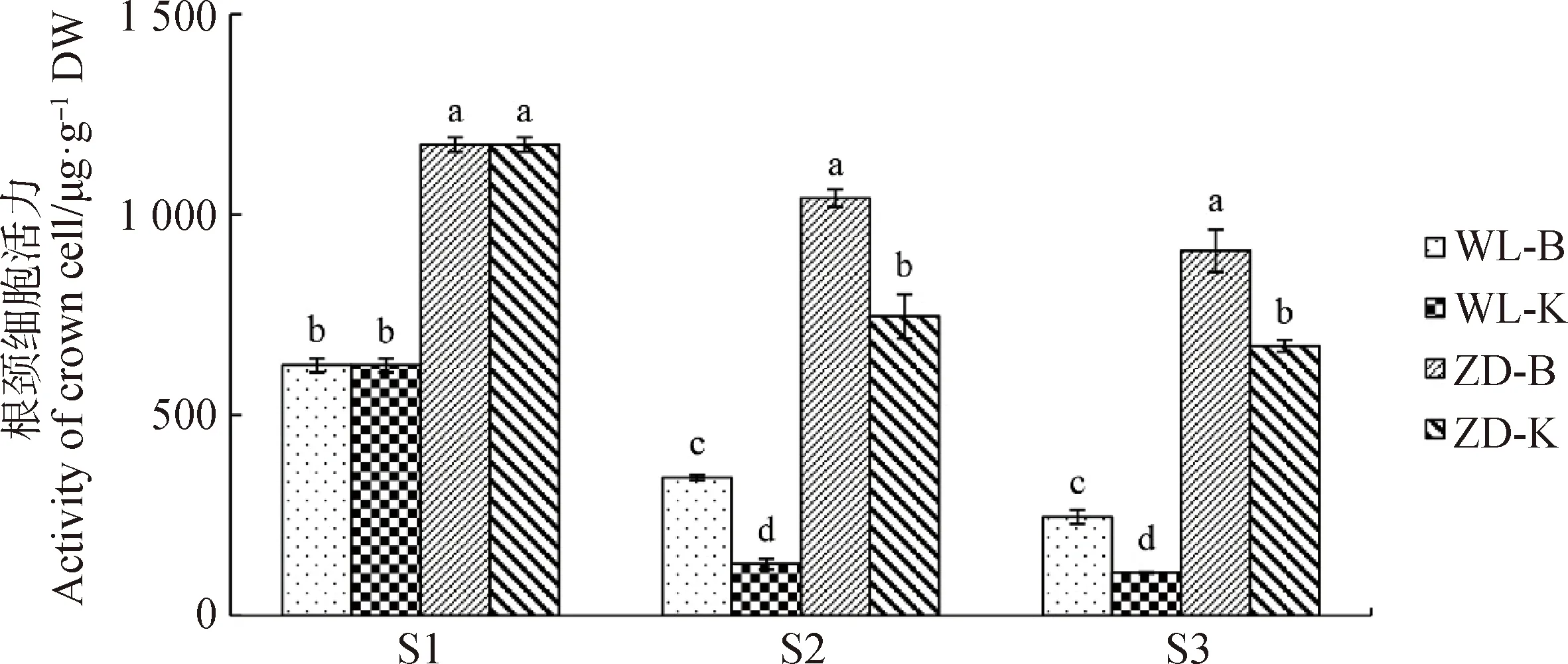
圖4 試驗(yàn)期間苜蓿根頸細(xì)胞活力
2.1.3丙二醛含量 圖5為試驗(yàn)期間苜蓿根頸細(xì)胞內(nèi)丙二醛的含量變化。由圖可知,經(jīng)過冷適應(yīng)處理后,WL-B根頸中的丙二醛含量顯著高于ZD-B根頸中的(P<0.05)。經(jīng)過冷凍后,4個(gè)樣本根頸中的丙二醛含量均有所增加,其中WL-K根頸中的丙二醛含量在階段2增加最明顯。經(jīng)過冷凍后,在取樣點(diǎn)S2和S3,WL-B和WL-K根頸中的丙二醛含量仍高于ZD-B和ZD-K根頸中的;WL-K根頸中的丙二醛含量顯著高于WL-B根頸中的(P<0.05);對于ZD苜蓿,根頸中的丙二醛含量在ZD-B和ZD-K樣本間并無顯著性差異。根據(jù)試驗(yàn)樣本根頸內(nèi)的丙二醛含量變化判斷,低溫干旱環(huán)境對WL苜蓿的影響較大,而對ZD苜蓿影響不明顯。
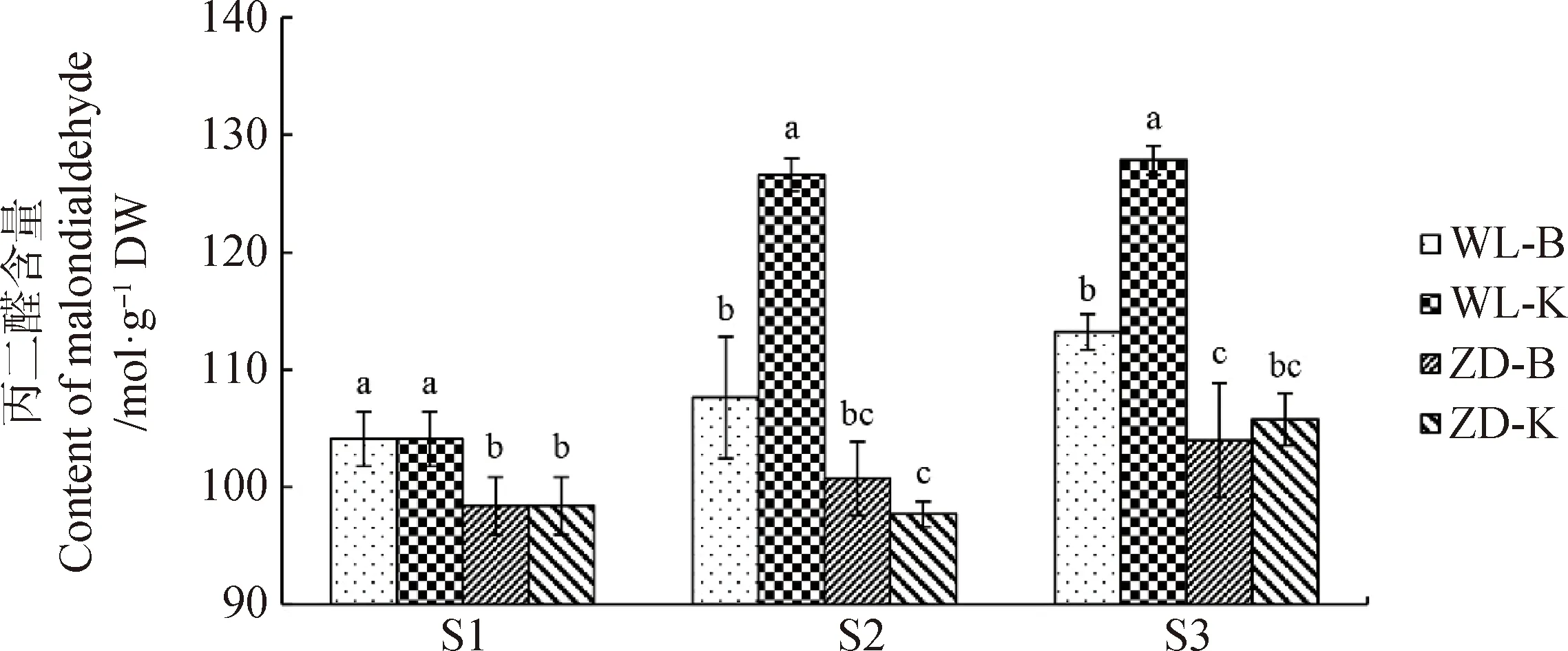
圖5 試驗(yàn)期間苜蓿根頸丙二醛含量
2.2 低溫干旱環(huán)境對苜蓿耐寒性影響的原因分析
2.2.1地上部和地下部干物質(zhì)量 圖6為試驗(yàn)期間苜蓿單株的地上部和地下部干物質(zhì)量,目的是為評估試驗(yàn)期間苜蓿生長可能對根頸耐寒性的影響。在本研究中,冷適應(yīng)處理結(jié)束后剪掉所有苜蓿的地上部并測定其干物質(zhì)量,WL-B和ZD-B樣本地上部干物質(zhì)量分別為0.51 g·株-1和0.57 g·株-1,且平均單株地上部干物質(zhì)量在2個(gè)樣本間并無顯著性差異(圖6-A)。從圖6-B中還可看出,4個(gè)樣本中苜蓿地下部干物質(zhì)量在同一取樣點(diǎn)均無顯著性差異。

圖6 試驗(yàn)期間苜蓿單株地上部和地下部干物質(zhì)量
2.2.2組織含水量 冷凍試驗(yàn)結(jié)束后,WL-K中的根頸出現(xiàn)萎縮,而其它3個(gè)處理中的根頸無萎縮表現(xiàn)。圖7為試驗(yàn)期間地上部和地下部組織(根頸和根系)含水量的變化情況。由圖7-A可知,冷適應(yīng)結(jié)束后,WL地上部的含水量為74.38%,ZD苜蓿的為71.25%,2個(gè)品種苜蓿地上部組織含水量與土壤含水量相近。由圖7-B可知,在更換表層土壤進(jìn)行凍干處理之前,2個(gè)品種苜蓿地下部含水量基本保持在75%左右;經(jīng)過階段2冷凍處理后,WL-B和ZD-B中地下部組織含水量無明顯變化,而WL-K和ZD-K中的均顯著降低。在階段2和階段3期間,WL-K中根系的失水速率分別為3.48 %·d-1和5.0 %·d-1,2個(gè)階段的平均失水速率為3.91 %·d-1;而ZD-K中根系失水速率分別為1.52 %·d-1和2.5 %·d-1,2個(gè)階段的平均失水速率為1.80 %·d-1。因此,WL-K中根系失水速率較ZD-K中的快。
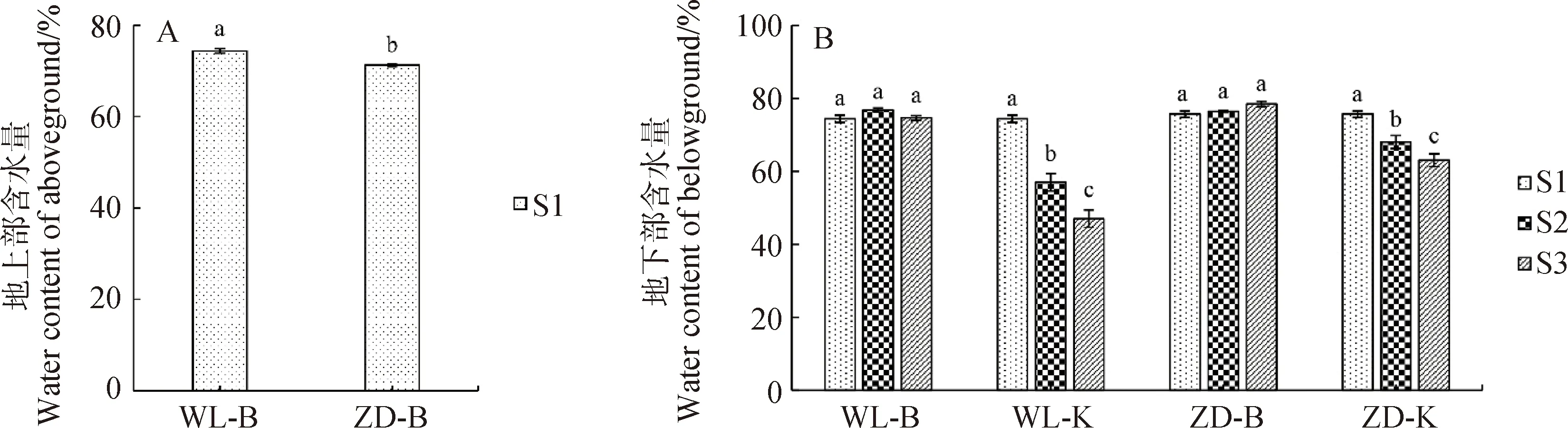
圖7 試驗(yàn)期間苜蓿地上部和地下部的含水量
2.2.3脯氨酸、總可溶性糖和總可溶性蛋白的含量 圖8為試驗(yàn)期間根頸細(xì)胞內(nèi)脯氨酸、總可溶性糖和可溶性蛋白含量的變化情況。與S1處樣本根頸內(nèi)的脯氨酸含量相比,經(jīng)過階段2和3的冷凍,4個(gè)樣本根頸中的脯氨酸含量均明顯下降。在取樣點(diǎn)S2和S3處,ZD-B和ZD-K根頸中的脯氨酸含量顯著高于WL-B和WL-K樣本根頸中的(P<0.05)。在S2點(diǎn),對于WL苜蓿來說,WL-K樣本根頸中的脯氨酸含量顯著高于WL-B樣本根頸中的(P<0.05);但對于ZD苜蓿來說,根頸內(nèi)的脯氨酸含量在ZD-B和ZD-K樣本間卻無顯著性差異(圖8-A)。在S3點(diǎn),對于同一品種苜蓿,根頸內(nèi)的脯氨酸含量在控水與不控水處理下的樣本間(WL-K和WL-B;ZD-K和ZD-B)均無顯著性差異(圖8-A)。從可溶性糖的含量來看(圖8-B),在同一取樣點(diǎn),ZD-B樣本根頸中的可溶性糖含量顯著高于WL-B樣本根頸中的(P<0.05),ZD-K中的顯著高于WL-K中的(P<0.05)。對于ZD苜蓿而言,根頸中的可溶性糖含量在ZD-B和ZD-K樣本間無顯著性差異;而對于WL苜蓿,WL-B樣本根頸中的可溶性糖含量顯著高于WL-K樣本根頸中的(P<0.05)(圖8-B)。對于根頸細(xì)胞內(nèi)的可溶性蛋白含量,在S2點(diǎn)處,ZD-B中的顯著高于WL-B中的(P<0.05);在S3點(diǎn)處,ZD-B中的顯著高于WL-B中的(P<0.05),ZD-K中的的顯著高于WL-K中的(P<0.05)。對于同一品種苜蓿,根頸中可溶性蛋白含量在ZD-B和ZD-K樣本間無顯著性差異,在WL-B和WL-K樣本間也無顯著性差異(圖8-C)。
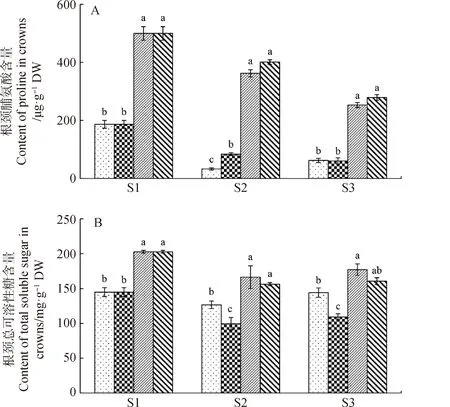
圖8 試驗(yàn)期間苜蓿根頸組織中脯氨酸、總可溶性糖和總可溶性蛋白含量
2.3 綜合評價(jià)
采用隸屬函數(shù)法對2個(gè)品種苜蓿在整個(gè)試驗(yàn)期間的表現(xiàn)進(jìn)行綜合評價(jià),評價(jià)結(jié)果見表1。根據(jù)多指標(biāo)的綜合評價(jià),結(jié)果顯示,排名前5位的全部為ZD苜蓿,而排名后5位的全部為WL苜蓿。在整個(gè)低溫干旱試驗(yàn)中,ZD苜蓿的表現(xiàn)完全優(yōu)于WL苜蓿,這與單純根據(jù)LT50和細(xì)胞液相對滲透率等指標(biāo)所比較的結(jié)果相一致。
3 討論
本試驗(yàn)結(jié)果表明,WL苜蓿受低溫干旱環(huán)境的影響遠(yuǎn)大于ZD苜蓿,試驗(yàn)中更換表土使土壤干旱的處理嚴(yán)重影響了WL苜蓿應(yīng)對低溫冷凍的能力,本研究結(jié)果與過去的研究結(jié)果保持一致。針對冬季土壤干旱可能對苜蓿越冬造成不良的影響,生產(chǎn)者常通過澆灌越冬水來提高苜蓿的抗寒越冬能力[2],其原因是土壤凍土層能夠緩解溫度劇烈變化對根頸和根系的傷害[4-5]。土壤剖面的溫度滯后于空氣的溫度,且土壤凍結(jié)后孔隙被冰完全填充,凍土層阻隔了大氣與土壤空氣的熱交換[3]。但即使秋末冬初已澆灌越冬水,因某些因素的影響(如澆灌越冬水的時(shí)節(jié)過早、灌水時(shí)土壤(沙質(zhì)土)滲水過快或土壤蒸發(fā),等等),導(dǎo)致越冬期間地表含水量過低,不能形成凍土層,從而影響苜蓿根頸應(yīng)對低溫冷凍的能力。因此,根據(jù)本研究結(jié)果,建議越冬期間對地表土壤水分狀況進(jìn)行監(jiān)測,適時(shí)補(bǔ)充土壤水分可提高苜蓿的越冬能力。這與Wu等對冬季高土壤含水量利于苜蓿越冬的研究結(jié)論一致[28]。
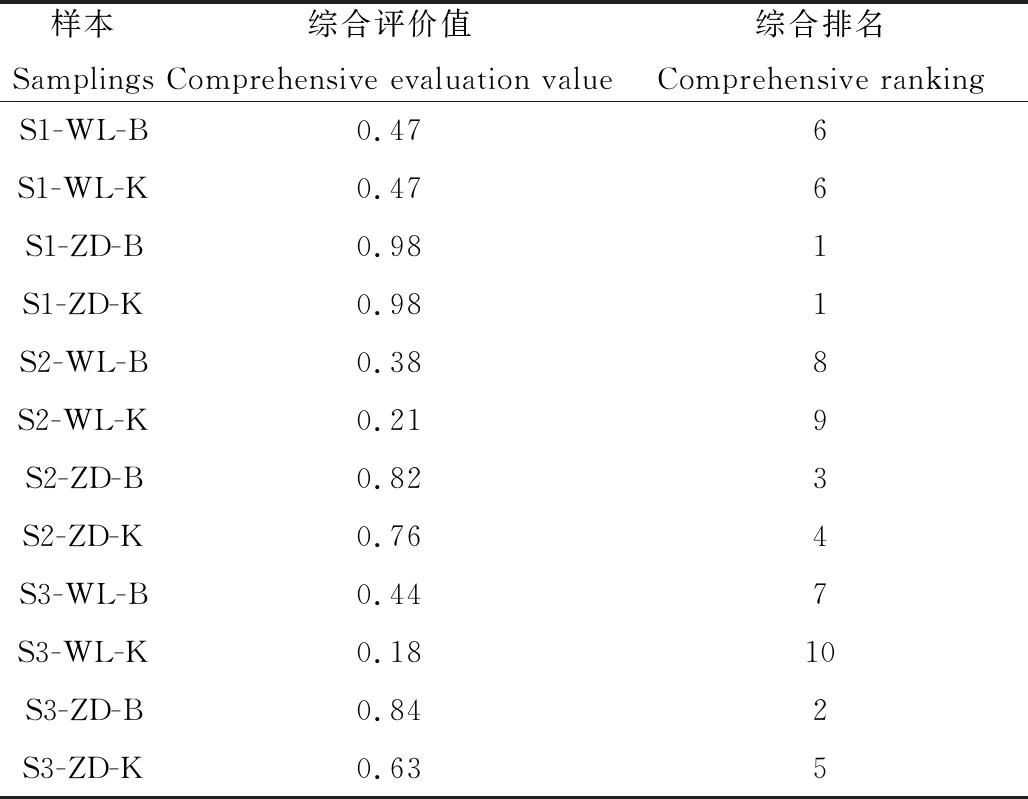
表1 隸屬函數(shù)法對2個(gè)品種苜蓿的綜合評價(jià)
研究表明,植物受到干旱或者低溫脅迫時(shí),都會(huì)導(dǎo)致細(xì)胞內(nèi)活性氧的增加[11,29]。細(xì)胞膜系統(tǒng)在受到氧化傷害后產(chǎn)生丙二醛,其含量可表征細(xì)胞膜脂過氧化的程度,也常用來表征細(xì)胞膜受破壞的程度[30]。在本研究中,經(jīng)過低溫冷凍處理后,WL根頸中的丙二醛含量明顯高于ZD苜蓿中的。此外,對于WL苜蓿而言,低溫干旱環(huán)境下根頸中的丙二醛含量顯著高于低溫環(huán)境下的,對于ZD苜蓿而言,低溫干旱環(huán)境下根頸細(xì)胞內(nèi)的丙二醛含量與低溫環(huán)境下的無顯著性差異。本研究中樣本根頸細(xì)胞內(nèi)丙二醛含量的對比結(jié)果與耐寒性的對比結(jié)果相一致,且符合丙二醛可表征細(xì)胞膜受破壞程度的理論。因此,本研究中丙二醛含量的對比結(jié)果可佐證耐寒性的對比結(jié)果。
在本研究中,調(diào)查了試驗(yàn)期間苜蓿地上部和地下部干物質(zhì)量的變化。冷適應(yīng)結(jié)束后,地上部干物質(zhì)量在2個(gè)苜蓿品種間并無顯著性差異。冷凍處理前,剪掉所有樣本的地上部,以模擬越冬期間苜蓿地上部枯黃。結(jié)果顯示,同一取樣點(diǎn)地下部干物質(zhì)量在各樣本間也沒有顯著性差異,可能是由于試驗(yàn)前所選的苜蓿樣本根系大小相近且冷凍處理期間地上部被剪掉后無新的物質(zhì)積累。根據(jù)各樣本間地上部和地下部干物質(zhì)量的差異性分析,推斷本研究中各樣本間根頸耐寒性的差異以及WL苜蓿根頸在經(jīng)過低溫干旱環(huán)境處理后死亡的原因,并不是因試驗(yàn)期間苜蓿的生長而造成的。從本研究中苜蓿根頸含水量的變化來看,WL-B和ZD-B根頸含水量在試驗(yàn)期間未發(fā)生顯著性變化,而WL-K和ZD-K根頸含水量在試驗(yàn)期間均存在顯著性降低,只是WL-K根頸的失水速率遠(yuǎn)大于ZD-K根頸的。據(jù)此結(jié)果推斷,低溫干旱環(huán)境下水分散失過快致使根頸組織細(xì)胞含水量低,可能是導(dǎo)致WL-K根頸在低溫冷凍期間細(xì)胞膜受到不可恢復(fù)的破壞的原因之一。
水分散失過快可能是導(dǎo)致低溫干旱環(huán)境下苜蓿根頸細(xì)胞死亡的原因,需進(jìn)一步分析是什么因素影響了苜蓿根頸細(xì)胞的水分散失速率。脯氨酸是植物體內(nèi)重要的滲透調(diào)節(jié)物質(zhì)[31-32],但有時(shí)植物抗寒性的增強(qiáng)要早于脯氨酸的積累,故無法確定它在改變植物耐寒性上的作用[33],然而也有研究通過轉(zhuǎn)基因手段證明了脯氨酸的積累在植物應(yīng)對非生物脅迫上的積極作用,如轉(zhuǎn)入P5CS基因的矮牽牛其脯氨酸的積累量較野生種提高1.5~2.6倍,耐旱性也明顯增強(qiáng)[34]。在本研究中,脯氨酸含量在品種間存在顯著性差異,ZD苜蓿根頸中的脯氨酸含量高于WL苜蓿根頸中的。對于同一品種苜蓿而言,在S2點(diǎn)處WL-K根頸含有比WL-B根頸較高的脯氨酸含量,在S3點(diǎn)處WL-K根頸含有與WL-B根頸相近的脯氨酸含量,但這并未能阻止在冷凍環(huán)境下WL-K根頸較快的失水速率以及較大的細(xì)胞液相對滲透率。此外,經(jīng)過階段2和3的低溫冷凍,2個(gè)品種苜蓿根頸內(nèi)的脯氨酸含量均有明顯降低,這與過去的研究結(jié)果相近。在對金銀花進(jìn)行干旱、低溫和水淹脅迫處理時(shí),曾發(fā)現(xiàn)隨著脅迫時(shí)間的延長,脯氨酸含量有降低的趨勢,可能是由于隨著脅迫時(shí)間的延長,碳水化合物供應(yīng)不足或酶活性降低等原因造成的[35]。在對2種暖季型草坪草進(jìn)行持續(xù)的干旱脅迫,結(jié)果發(fā)現(xiàn)隨著脅迫時(shí)間的延長,脯氨酸含量呈先升高后降低的現(xiàn)象,可能是由于脅迫時(shí)間的延長,根系活力下降造成的[36]。同時(shí),研究還認(rèn)為不能簡單將某一時(shí)間點(diǎn)的脯氨酸含量作為衡量植物抗性的標(biāo)準(zhǔn),可能會(huì)造成假結(jié)論的產(chǎn)生[36]。
此外,以往的研究表明,苜蓿在冷適應(yīng)過程中會(huì)積累可溶性蛋白,并且學(xué)者們也肯定了可溶性蛋白在抗寒越冬過程中的重要作用[10,15]。但在本研究中,可溶性蛋白在WL-B和WL-K 2個(gè)樣本間并無顯著的差異性,可溶性蛋白未能阻止WL-K樣本根頸細(xì)胞的破裂。可溶性糖也是苜蓿體內(nèi)重要的滲透調(diào)節(jié)劑,還具有冷凍保護(hù)劑的作用,可影響苜蓿的耐寒性,如棉子糖和水蘇糖等[10,37-38]。在本研究中,ZD苜蓿根頸內(nèi)可溶性糖的含量顯著高于WL苜蓿根頸內(nèi)的。同時(shí),對于ZD苜蓿而言,經(jīng)過低溫干旱環(huán)境和低溫環(huán)境處理后,苜蓿根頸內(nèi)的可溶性糖含量在2個(gè)樣本間無顯著差異;對于WL而言,低溫干旱環(huán)境處理后苜蓿根頸中的可溶性糖含量顯著高于低溫環(huán)境處理后苜蓿根頸中的,此結(jié)果與本研究中根頸耐寒性的比較結(jié)果相一致。據(jù)此推斷,在低溫干旱環(huán)境下根頸中的可溶性糖含量較低,可能是導(dǎo)致WL苜蓿根頸水分散失過快以及細(xì)胞受到嚴(yán)重?fù)p傷的原因之一。根據(jù)幾種物質(zhì)的含量在品種間及樣本間的差異性判斷,脯氨酸和可溶性蛋白的含量可能與ZD苜蓿應(yīng)對冷凍環(huán)境時(shí)更優(yōu)異的表現(xiàn)有關(guān),而可溶性糖的含量低是低溫干旱處理境下WL苜蓿根頸細(xì)胞滲透性變高乃至死亡的原因。
4 結(jié)論
在模擬的低溫干旱環(huán)境下,秋眠級較高的‘WL440HQ’苜蓿根頸失水速率較快,處理后細(xì)胞液相對滲透率超過60%,導(dǎo)致細(xì)胞受到無法修復(fù)的損傷,土壤干旱嚴(yán)重影響了‘WL440HQ’苜蓿抵抗冷凍的能力。而對于秋眠級較低的‘肇東’苜蓿,低溫干旱環(huán)境條件下其根頸失水速率較‘WL440HQ’苜蓿慢,土壤干旱未對冷凍期‘肇東’苜蓿根頸的耐寒性產(chǎn)生顯著性影響。從根頸細(xì)胞內(nèi)物質(zhì)的含量來看,脯氨酸和可溶性蛋白含量可能與‘肇東’苜蓿應(yīng)對低溫環(huán)境時(shí)更優(yōu)異的表現(xiàn)有關(guān),而可溶性糖含量低才是與“低溫干旱”環(huán)境下‘WL440HQ’苜蓿根頸失水速率快乃至耐寒性受到嚴(yán)重影響的原因。

