ZSM-5 分子篩協同脫硫脫硝脫汞的分子模擬
劉紅芳,周瑞生,姚貴佳,李奇超
(江西華贛瑞林稀貴金屬科技有限公司,江西宜春 331100)
目前聯合脫除煙氣中SO2、NO、Hg 污染物是國內外研究的熱點。其主要的方法有吸附法、 電子束法、低溫等離子體放電、光催化氧化、煙氣循環流化床和微波輻射脫除法等[1]。例如,袁媛等[2]采用TiO2-硅酸鋁纖維納米復合材料通過光催化作用進行脫硫脫硝脫汞實驗。結果表明,納米復合材料的脫硫脫硝脫汞效率均隨著反應溫度的升高而降低。李蘭廷等[3]探索了活性焦脫硫脫硝脫汞一體化技術的可行性。劉松濤等[4]通過實驗研究了富氧型高活性吸收劑脫硫脫硝脫汞性能。
由于分子篩具有良好的吸附性能,關于分子篩吸附的研究不斷涌現,且主要以分子模擬的方法為主。分子模擬的方法可以直接分析界面的分子模型,獲得通過實驗難以得到的信息[5]。目前,已有一些關于分子篩吸附的分子模擬研究,如曾曉放等[7]研究了NaY 分子篩模擬吸附油中噻吩;劉艷杰等[8]采用分子模擬的方法研究了H-STI 分子篩對氨分子的吸附;黃孟凱[7]探索了稠環芳烴在Y 分子篩中吸附規律等,但分子篩在脫硫脫硝脫汞方面的分子模擬卻很少。ZSM-5 是一種沸石分子篩,微孔孔徑在0.5~0.6 nm,熱穩定性好,能夠實現循環使用。其主要結構式由8 個五元環組成的結構單元構成,具有兩種相互交叉的孔道體系[9-10]。由純SiO2合成的ZSM-5分子篩價格低廉,在環保領域應用十分廣泛。本文采用分子模擬方法從微觀角度探討ZSM-5 分子篩脫除煙氣中SO2、NO、Hg 污染物的機制。
1 ZSM-5 吸附情況的分子模擬
1.1 ZSM-5 分子篩模型構建
本文在Materials Studio(以下簡稱“MS”)軟件包中構建ZSM-5 分子篩模型。晶胞參數a=2.007 nm,b=1.992 nm,c=1.342 nm,α=β=γ=90°。選取 8 個(2×2×2)晶胞作為基本計算單元,由 96 個 SiO2分子組成,密度為 1.782 45 g/cm3。應用 MS 中的 Forcite 模塊對新的ZSM-5 分子篩進行幾何結構優化,Forcite模塊條件設置如下:1)計算任務為幾何優化(Geom etry Opti-mization);2)精度控制為精確(Fine);3)力場為Universal;4) 加和方法中的靜電相互作用選擇原子截斷(Atom based)。優化后的 ZSM-5 分子篩骨架結構如圖1 所示。

圖1 ZSM-5 分子篩骨架結構
對優化后的 ZSM-5 分子篩模型用 MS 中的Reflex 模塊 Powder Diffraction 做 XRD 衍射,得到構建的ZSM-5 型分子篩模型的XRD 譜,如圖2 所示。將該XRD 譜與國際沸石協會結構委員會數據庫中的標準XRD 譜進行對比,發現兩個圖譜的XRD 峰位置一致。由此說明,所構建的分子篩模型可以正確表征實際分子篩結構。

圖2 ZSM-5 分子篩模型的XRD 譜
1.2 吸附模塊的參數設置
采用MS 軟件包中的Sorption 模塊來模擬SO2、NO、Hg 在ZSM-5 分子篩上的吸附情況。模擬過程中,使用的是蒙特卡洛法(GCMC),采用屬于分子力學范疇的巨正則系綜進行詮釋。預測SO2、NO、Hg 的吸附等溫線,定量分析溫度及壓強對體系的影響,研究純組分或混合組分體系在分子篩中的性質,從原子級別來理解吸附機制,通過圖形表示法分析、解釋模擬結果。Sorption 模塊的模擬條件設置如下:計算方法為 Metropolis,計算精度為精確(Fine),吸附質選擇需要模擬吸附質后綴為.xsd 的文件,性質勾選能量分布(Energy distribution)、態密度場(Density field)、能量場(Energy field)。平衡步數設為 104,生產步數設為105,溫度根據需要來設置。吸附分子的運動中各分配系數采用默認設置。靜電勢能和van de Waals 勢能設為 Ewald & Group 和 Atom based,吸附反應的壓強設置在0.01~101 kPa。
2 結果與討論
2.1 吸附等溫線
2.1.1 純組分吸附等溫線
溫度對吸附性能產生重要的影響,且不同物質對溫度的敏感性不同。為研究不同溫度對ZSM-5 分子篩吸附 SO2、NO 和 Hg 的影響,本文選取了 298 K、373 K、473 K、573 K 和 673 K 分別進行模擬,得到等溫吸附曲線如圖3~圖5。

圖3 ZSM-5吸附SO2 等溫線
從圖3 可以看出,常溫下ZSM-5 分子篩吸附SO2的能力較強。在 373 K 范圍內,SO2的吸附量受溫度的影響較小。隨著壓強的增大,吸附量先呈現快速增加;當壓強超過10 kPa 后,吸附量幾乎趨于平衡。當溫度高于 373 K 后,ZSM-5 分子篩對 SO2的吸附量急劇下降,在溫度趨近673 K 時,吸附量幾乎為0。在溫度低于473 K 時,符合BDDT 分類中的第Ⅰ型等溫線特點,能用Langmuir 吸附模型來描述,即吸附量在較低相對壓力時迅速增加,達到一定的吸附量后,趨于吸附平衡,達到極限吸附。由于ZSM-5 分子篩的孔徑在0.5~0.6 nm 左右,屬于微孔,達到極限吸附時,吸附質填滿了微孔。當溫度高于573 K時,吸附量與壓力成正比,吸附等溫線為通過原點的直線,吸附等溫線屬于第Ⅱ型,且溫度越高,曲線越緩,吸附量越低,這便于其在ZSM-5 分子篩的脫附。在298 K 時的吸附量的模擬結果與文獻[11]的實驗結果相吻合。

圖4 ZSM-5 吸附 NO 等溫線
從圖4 可以看出,NO 在ZSM-5 分子篩上的吸附量隨著溫度的升高而急劇下降。在473 K 時,平衡吸附量趨向于0。NO 總吸附量不大,符合第Ⅱ型吸附等溫線。

圖5 ZSM-5 吸附Hg 的吸附等溫線
從圖5 可以看出,ZSM-5 分子篩對Hg 的吸附量并不大,符合第Ⅱ型吸附等溫線,與NO 的吸附情況類似。吸附量隨著溫度的升高而降低,隨著壓力的增大而增大。當溫度達到673 K 時,吸附量接近于0,這有利于ZSM-5 分子篩脫附。
對比 SO2、NO 和 Hg 在 ZSM-5 分子篩上的吸附現象,SO2的吸附量較大可能與ZSM-5 分子篩的酸性位點有關,SO2呈現酸性,能較穩定地吸附在酸性位點上,而NO 和Hg 都近乎呈中性,只存在普通的微孔吸附。
2.1.2 混合組分吸附等溫線
為探索ZSM-5 分子篩同時吸附混合物的相互影響,模擬了Hg、SO2和NO 兩兩混合或三者同時存在相互之間的影響。模擬溫度均298 K,模擬結果如圖6 所示。

圖6 Hg、SO2 和NO 兩兩混合或三者同時存在的影響模擬等溫線對比(298 K)
從圖6(a)看出,Hg 與 SO2聯合脫除,ZSM-5 分子篩對SO2吸附量幾乎無影響,吸附量和吸附模型均未改變;而對Hg 的吸附影響顯著。此時,Hg 的吸附量幾乎為0,說明SO2的存在抑制了Hg 的吸附。圖6(b)顯示出Hg、NO 聯合脫除具有較好的效果,兩者吸附量有微小程度地降低,但總吸附量還是有所增加。這可能是由于Hg 和NO 在ZSM-5 分子篩中競爭吸附力相近。圖6(c)是SO2和 NO 聯合脫除的吸附等溫線,從中看出,SO2的吸附量依然沒有受到影響,而NO 的吸附量近乎為0,說明SO2抑制了NO在 ZSM-5 分子篩上的吸附。圖4(d)是 298 K 溫度下,ZSM-5 分子篩聯合脫除 SO2、NO 和 Hg 的吸附等溫線。從中看出,SO2的吸附量沒有改變,而Hg 的吸附量較Hg 與SO2共存時的吸附量略有增加。
綜合分析以上聯合脫除模擬結果,由于SO2、NO和Hg 在ZSM-5 分子篩中要相互競爭吸附位或者相互發生反應,因此SO2、NO 和Hg 的多組分吸附將與純組分吸附不同:1)當 Hg 與 SO2共存時,ZSM-5 分子篩的酸性是催化反應的活性中心,對反應效果起著關鍵性影響,能使ZSM-5 優先吸附SO2[12]。2)當Hg和NO 共存時,NO 幾乎呈現中性,對酸性位的爭奪很弱,幾乎能與汞同等概率地吸附于ZSM-5 分子篩孔道中。3)當 SO2、NO 共存時,SO2和 NO 相互競爭吸附位,由于SO2的分子極性強于NO,且分子直徑、臨界體積分子偶極矩均比NO 的大,導致SO2優先吸附[13]。4)當 SO2、NO 和 Hg 同時存在于混合氣中時,分子篩優先吸附SO2的同時,吸附的NO 被氧化成NO2;NO2將帶著電子轉移到吸附態的SO2上,使得SO2的吸附更容易。當 NO2存在時,少量的 NO2與Hg發生氧化還原反應,汞以氧化態形式吸附在ZSM-5 分子篩上,于是出現了當SO2、NO 和 Hg 同時存在于混合氣中時比僅Hg 與SO2共同存在時汞的脫除效率更高的現象。
2.2 能量分布圖
其他設置與吸附等溫線的設置一樣,溫度設置為 298 K,模擬得到SO2、NO、Hg 的吸附能量分布,見圖7。

圖7 SO2、NO、Hg 的吸附能量分布(298 K)
從圖7 中看出,SO2吸附能量分布在較低區間,NO 和 Hg 則分布在能量相對較高的區間,SO2與Hg、NO 吸附能量分布區間不存在重疊,而Hg 與NO的吸附能量分布區間卻存在重疊。NO 存在1 個很強的吸附峰,SO2與Hg 各自存在多個吸附峰,且能量分布區間較寬。結合SO2、NO、Hg 聯合脫除的等溫吸附曲線,推測三者聯合脫除時,NO 先吸附在ZSM-5分子篩上而被氧化為NO2; 由于NO2具有強氧化性,NO2被還原成 NO,NO 則從 ZSM-5 分子篩脫附,而 Hg則以氧化態的形式吸附在ZSM-5 分子篩上。于是,出現了NO 存在強吸附峰,結果吸附量卻很小的現象。
2.3 密度場分布規律
其他設置與吸附等溫線的設置一樣,只改變Sorption Calculation 中 Task/Adsorption isotherm 為Task/Fixed pressure。溫度設置為298 K,壓強設置為101 kPa 時,每50 步記錄1 次相關分子質量中心的位置,并在該位置記為1 個點,模擬得到吸附SO2、NO、Hg 的密度場分布規律,如圖8 所示。

圖8 吸附空間概率密度場
圖8 中3 種物質均有出現,但SO2分布的空間最廣,Hg 次之,NO 出現的概率最低。
2.4 吸附熱
吸附熱的大小可以衡量吸附能力強弱,吸附熱越大,吸附能力越強。為研究不同溫度對SO2、NO 和Hg 在ZSM-5 分子篩中的吸附熱的影響,本文選取了 298 K、373 K、473 K、573 K 和673 K 分別進行模擬,得到吸附熱曲線如圖9~圖11。
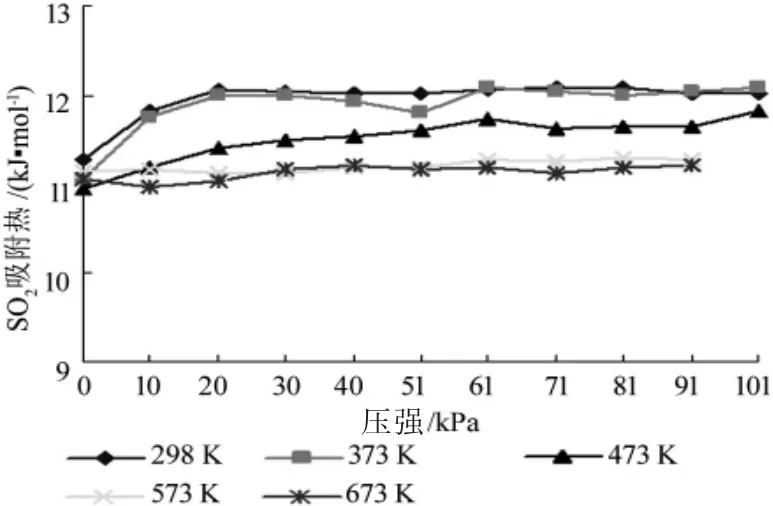
圖9 SO2吸附熱曲線

圖10 NO 吸附熱曲線

圖11 Hg 吸附熱曲線
一般來講,一種物質在另一種物質中的吸附熱,受反應條件影響而產生的吸附熱變化值并不大。但從圖9~圖11 可以看出,SO2在 ZSM-5 分子篩中吸附熱隨反應溫度升高而減小,NO、Hg 在ZSM-5 分子篩中的吸附熱均隨著反應溫度的升高而增大。
圖12 是在溫度為 298 K 時,SO2、NO、Hg 三者混合組分的吸附熱曲線。

圖12 SO2、NO、Hg 吸附熱曲線(298 K)
從圖8 得知,SO2在 ZSM-5 分子篩中的平均吸附熱最大,為 12 kJ/mol 左右,與文獻[11]的實驗值12.5 kJ/mol 接近。NO 的吸附熱近似為 5.4 kJ/mol,Hg的吸附熱近似為4.4 kJ/mol。
3 結 論
1)從吸附等溫線得出,混合組分吸附,SO2吸附量受其他組分的影響很小,NO 促進了Hg 的吸附。2)能量分布圖看出,處于低能量分布區的SO2更容易被吸附,Hg 與NO 的能量分布圖存在重疊區。3)3種氣體在ZSM-5 分子篩中出現多個吸附位點,且能量分布區間越寬,越容易被吸附;SO2概率密度分布空間最廣,Hg 次 之 ,NO 出現 的 概 率 最 低 ;SO2在ZSM-5 分子篩中的平均吸附熱最大,約為12 kJ/mol,NO 近 似 為 5.4 kJ/mol,Hg 在 4.4 kJ/mol 附 近 。4)ZSM-5 分子篩對 SO2、NO、Hg 都具有一定的吸附能力,且受溫度的影響程度存在較大差異,通過升溫能順利實現脫附分離,使得吸附質能回收,吸附劑能夠循環使用。

