pH和緩沖體系對植物多酚抑制脂氧合酶活性的影響
葉鳳凌 賈利蓉 何 強 董 怡
(四川大學輕工科學與工程學院,四川 成都 610065)
脂氧合酶(Lipoxygenase,EC1.13.11.12,LOX)是一種氧化還原酶,可專門催化具有順,順-1,4戊二烯結構的多不飽和脂肪酸發生分子內加氧產生脂肪酸氫過氧化物[1],例如,植物源的LOX底物主要是植物油脂中廣泛存在的亞油酸和亞麻酸[2-3]。LOX對油脂的劣變具有一定促進作用,可導致油脂和含油食品在貯藏和加工過程中氧化酸敗,降低產品營養和食用特性[4-5]。抑制脂氧合酶活性是延長油脂貨架期,維持油脂營養價值的重要途徑之一。已有研究證明,植物中提取得到的多酚類物質可通過螯合或還原LOX活性部位的亞鐵離子,或與脂質自由基發生反應從而中斷脂質氧化鏈式反應[3],達到良好的油脂氧化抑制作用[6-8]。
LOX酶活的常見測定方法有分光光度法、氧電極法、量壓法、同位素標記法、顯色法、染色法等,其中分光光度法最簡便、快速,能做到連續且精準的測定[9]。分光光度法通過測定LOX催化底物反應生成具有共軛二烯結構的氫過氧化合物的吸光度值(A234),計算共軛二烯生成量,推算出酶活大小[1]。該法已被廣泛用于作物中LOX酶活性的檢測[10-11],且已有較多研究利用該法檢測從茶葉[12]、虎杖根[8]、藍莓葉[6]等植物中提取的多酚類物質對LOX酶活的抑制作用。
植物多酚常具有鄰苯三酚或鄰苯二酚結構,其酚羥基具有供氫能力和供電子能力[13],使得多酚具有較強的抗氧化性以及清除自由基的能力[14]。常見的植物多酚如槲皮素[15-16](quercetin,QCT)、沒食子酸[17-18](gallic acid,GA)、兒茶素[19](catechins,C)和3,4-二羥基苯乙酸[20](3,4-dihydroxyphenylacetic acid,DOPAC)等均具有抗氧化、抗衰老、抗病毒、抗腫瘤等多種活性[21-22]。但多酚所在緩沖體系的溶劑及pH可影響多酚的活性[23]。多酚在酸性環境中較為穩定而在堿性環境不穩定,且堿性越強穩定性越差[24]。多酚在堿性條件下易脫下鄰位酚羥基上的H離子(酸堿中和反應)發生自氧化反應生成半醌和醌類物質,從而影響其活性[25]。多酚自氧化反應的中間產物在320 nm左右有特征吸收峰,隨著反應程度加劇或反應時間延長,中間產物被氧化轉變為終產物,終產物在440 nm左右出現特征吸收峰[26-27]。在已有的利用紫外分光光度法檢測多酚對LOX酶活抑制作用的研究中[6,12],檢測時所選取的緩沖體系多為硼酸鹽體系,所選取的pH一般以LOX的最適pH為準,對該緩沖鹽體系及pH條件是否對多酚活性造成影響未有深入探討。
為優化紫外分光光度法檢測多酚抑制LOX酶活方法中的反應體系,試驗擬研究不同緩沖體系和pH對LOX酶活力的影響,并選用QCT、GA、C、DOPAC 4種常見多酚,研究在不同緩沖體系和pH條件下4種多酚的自氧化情況,旨在為緩沖體系和pH對多酚自氧化及多酚對LOX酶抑制機理的研究提供理論依據。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
硼酸、十水合四硼酸鈉(硼砂)、二甲基亞砜(DMSO):分析純,成都金山化學試劑有限公司;
磷酸氫二鈉、磷酸二氫鈉、氫氧化鈉:分析純,成都科龍化工試劑廠;
吐溫20、Tris:分析純,德國BioFroxx公司;
鹽酸:分析純,成都市科隆化學品有限公司;
亞油酸、槲皮素(QCT)、沒食子酸(GA)、兒茶素(C)、3,4-二羥基苯乙酸(DOPAC):分析純,上海源葉生物公司;
脂氧合酶(LOX):活性5萬U/mg,上海源葉生物科技有限公司。
1.1.2 主要儀器設備
多功能微孔板檢測儀:Synergy H1型,美國BioTek公司;
電子天平:SQP型,奧多利斯科學儀器有限公司;
超聲波清洗器:KQ5200D型,東莞科喬超聲設備有限公司;
雷磁臺式pH計:PHS-3E型,儀電科學儀器股份有限公司。
1.2 方法
1.2.1 試劑的配制
(1) 緩沖液:用0.05 mol/L Na2B4O7溶液和0.2 mol/L H3BO4溶液混合調配得到pH分別為9.0,8.5,8.0,7.5,7.0的0.2 mol/L硼酸鹽緩沖液。用0.2 mol/L NaH2PO4溶液和0.2 mol/L Na2HPO4溶液混合調配得到pH分別為8.0,7.5,7.0,6.5,6.0的0.2 mol/L磷酸鹽緩沖液。向50 mL 0.4 mol/L Tris溶液中滴加濃鹽酸溶液調節至所需pH后用蒸餾水定容至100 mL,得到pH分別為9.0,8.5,8.0,7.5,7.0的0.2 mol/L Tris-HCl 緩沖液。
(2) 多酚溶液:用DMSO溶解多酚,分別配制成0.05,0.10,0.25,0.50,1.00,10.00 mmol/L的QCT溶液、GA溶液、C溶液、DOPAC溶液。
(3) LOX酶液:將100 mg脂氧合酶溶于pH 9.0的0.2 mol/L硼酸鹽緩沖液中,制得酶活約為2 500 U/mL的酶液。
(4) 底物溶液:參照吳桂玲等[6]的方法并略作修改。將0.125 mL Tween 20與5 mL pH 9.0的0.2 mol/L硼酸鹽緩沖液混合,邊搖邊加入0.135 mL亞油酸,混勻后邊搖邊加入1 mol/L NaOH溶液直至澄清,調節混合液pH至7.5,用pH 7.5的0.2 mol/L硼酸鹽緩沖液定容至500 mL。
1.2.2 pH、緩沖體系和多酚濃度對LOX酶活力的影響
參照吳桂玲等[12]的方法并略作修改。緩沖體系對LOX酶活力的影響:在96孔紫外酶標板中加入酶液20 μL、不同pH的緩沖液190 μL,放入酶標儀中在25 ℃下振蕩1 min(1 096 次/min,1 mm)后加入底物30 μL;多酚濃度對LOX酶活力的影響:在96孔紫外酶標板中加入酶液20 μL、濃度分別為0.00,0.05,0.10,0.25,0.50,1.00 mmol/L 的多酚溶液5 μL,pH 7.5的硼酸鹽緩沖液185 μL,放入酶標儀中在25 ℃下振蕩1 min(1 096 次/min,1 mm)后加入底物30 μL。加樣完成后立即在25 ℃下振板10 s(1 096 次/min,1 mm),并測量在234 nm處的吸光度,每10 s掃描一次,10 min共掃描60次。以溶劑做空白,進行3次平行試驗。制作吸光度隨時間變化的曲線,在前5 min內線性較好的區域中以234 nm處的吸光度值每分鐘增加0.001個單位定義為一個酶活單位。按式(1)計算酶活力。
(1)
式中:
X——酶活力,U;
A1——線性范圍內第1次測得的吸光度;
An——線性范圍內第n次測得的吸光度;
n——掃描檢測吸光度的次數。
1.2.3 緩沖體系和反應時長對多酚自氧化的影響 參照賈紅玉等[27]的方法并略作修改。在25 ℃條件下,于96孔紫外酶標板中添加5 μL多酚溶液與235 μL緩沖液,混合均勻后分別在0,60,120 min掃描280~500 nm處光譜(步長為2 nm),以5 μL的DMSO與235 μL緩沖液混合作為空白對照。
1.2.4 數據處理 所有試驗均平行3次,結果以平均值±標準差(SD)表示。采用Origin 8.0軟件分析并作圖。
2 結果與分析
2.1 緩沖條件對LOX酶活的影響
LOX存在多種同工酶,不同來源的LOX最適pH不同[1, 10]。植物來源的LOX所耐受的pH值一般在3~10,最適pH一般為6.0~9.0[28],同工酶LOX-1的最適pH為9.0。通過測定不同緩沖體系、不同pH條件下LOX活性發現:在硼酸鹽緩沖體系中[圖1(a)],酶活出現雙峰結構(pH=7.5,pH≥9.0),pH為9.0時酶活達38 U,在其他pH條件下酶活則在20~30,中性條件下酶活優于其他兩組,與劉國夫等[11]的研究一致;在磷酸鹽體系中[圖1(b)],酶活隨pH值升高而顯著上升(P<0.05),而酸性條件下酶活低于10 U;在Tris-HCl緩沖體系中[圖1(c)],堿性條件下酶活力均大于40 U,中性條件下酶活顯著低于堿性條件(P<0.05)。綜上可知,pH和緩沖體系對酶活具有一定影響。
酶的化學本質是蛋白質,結構上同時具有氨基和羧基,環境pH的變化可以使其結構變性而活性降低,導致其對環境pH極為敏感,且不同的離子也會對酶活造成一定影響[29],因此在不同環境條件下LOX酶可顯示出不同的酶活力。堿性條件下,試驗所用的LOX在Tris-HCl體系中酶活最高;中性條件下,則在硼酸鹽體系中酶活最高。
2.2 緩沖條件對多酚自氧化的影響
2.2.1 對QCT自氧化的影響 在硼酸鹽緩沖體系中(圖2),QCT在中性條件下反應120 min內紫外光譜圖沒有較大變化,在堿性條件下于320 nm有明顯吸收峰。緩沖體系的pH越高、反應時間越長,320 nm處峰越高,而382~400 nm及440~500 nm的峰下降,且382~400 nm 峰出現紅移。俞梅蘭等[30]研究認為,382~400 nm 及440~500 nm為QCT自身的特征吸收峰,320 nm 處為其自氧化產物的特征吸收峰。因此,在堿性條件下QCT會發生自氧化反應,隨著自氧化產物不斷積累,320 nm處吸收峰升高;而隨反應時間延長,QCT不斷消耗導致自身特征吸收峰降低,與Zhou等[31]的研究結果相符。在堿性條件下,QCT的B環上的鄰二酚羥基對自氧化反應敏感,可氧化形成具有半醌結構的中間產物,并進一步氧化成終產物槲皮素醌[30]。
QCT在磷酸鹽體系中(圖3)反應0 min時,在370~385 nm處的峰隨著pH降低峰高不變但峰位藍移。堿性條件下,QCT在326 nm處出峰且堿性越強峰越高,反應一段時間后峰下降,但QCT在pH為8.0的條件下320 nm 的峰明顯增長,表示在該條件下出現自氧化產物。因此,pH能顯著影響QCT穩定性,進而影響QCT的功能特性。榮家閔等[32]研究發現,pH為5~6時QCT對自由基的清除能力約為60%;隨著pH增加,其對自由基的清除能力急劇下降,在pH 9.0時清除率僅為10%。
QCT在中性和堿性Tris-HCl緩沖體系中(圖4),反應時間越長,360~410 nm處的峰下降越多;反應60 min相較于反應0 min在320 nm處峰值升高,且隨著pH越大而峰值升高越明顯;而反應120 min后相較于反應60 min,pH 9.0,8.5的曲線在320 nm的峰有所下降,pH 8.0,7.5的曲線在320 nm的峰上升,并在476 nm處出現新的吸收峰。推測該緩沖體系下320 nm處為QCT自氧化中間產物的特征吸收峰,476 nm處為QCT自氧化終產物的特征吸收峰。因此,QCT在堿性Tris-HCl緩沖體系中可發生自氧化,堿性弱的情況下自氧化中間產物堆積速率大于被消解的速率,表現為QCT自身特征吸收峰下降而中間產物特征吸收峰上升;當堿性越強自氧化反應越快,中間產物濃度大到一定程度之后促進第二步氧化的發生,導致中間產物堆積速率小于被消解的速率,終產物累積同時中間產物含量下降,表現為QCT自身特征吸收峰及中間產物特征吸收峰下降,終產物特征吸收峰上升。

不同pH條件下的字母不同表示差異顯著(P<0.05)
綜上可知,QCT在堿性條件下發生自氧化,且堿性越強自氧化程度越高。在堿性條件下,QCT在磷酸鹽緩沖體系中的穩定性最強,硼酸鹽緩沖體系次之,Tris-HCl緩沖體系最差。硼酸鹽可能與QCT的B環的酚羥基形成絡合物,因此硼酸鹽對QCT自氧化具有一定抑制作用[33]。
2.2.2 對GA自氧化的影響 在硼酸鹽緩沖體系中(圖5),GA反應0 min時各pH條件下紫外吸收曲線相似;反應60 min后,pH 8.0~9.0條件下在340~360 nm出現吸收峰,且pH越高峰越高。在pH 9.0和pH 8.5條件,450 nm處亦有出峰。由此推測,340~360,450 nm處分別為GA自氧化中間產物和終產物的特征吸收峰。在堿性較強的硼酸鹽緩沖體系中,在60 min內有GA自氧化終產物積累,且中間產物和終產物的累積隨反應時間延長和pH升高而增多。在pH 7.5,7.0條件下,340~360 nm處也出現一個小峰,即在各堿性硼酸鹽緩沖體系中反應120 min均發生自氧化。GA結構中3個相鄰的芳香族羥基易氧化,GA可以被氧化成醌或羥基相關的衍生物[34]。吳雪釵等[35]研究發現,當pH值為7.0~10.0時,GA在50 ℃以上的條件下3 h內可完全降解,可見GA在堿性和中性條件下不穩定,與試驗結論相符。
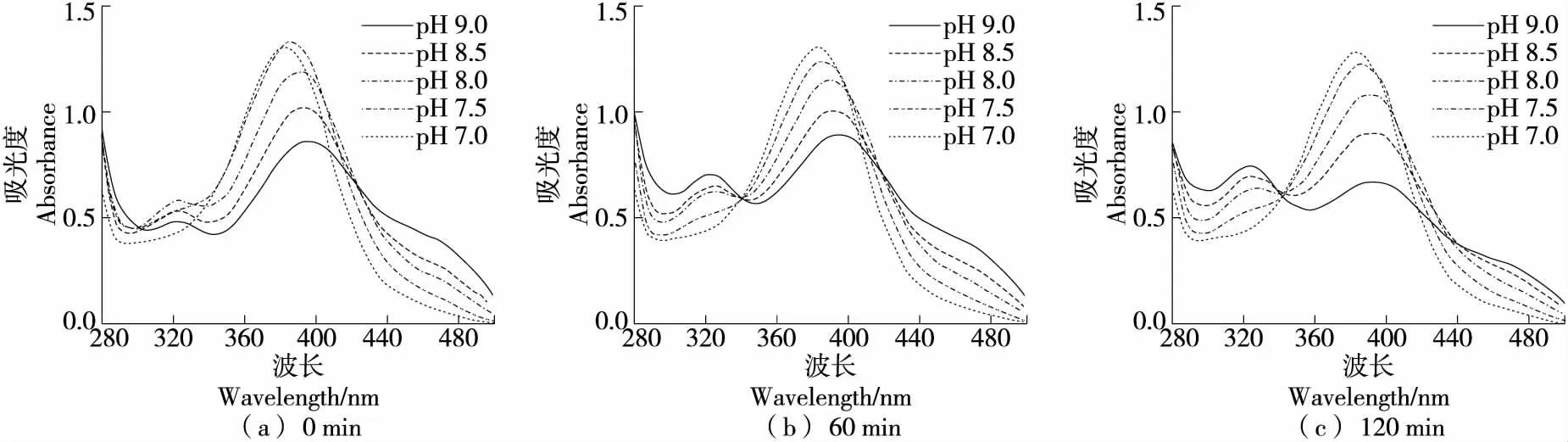
圖2 QCT在硼酸鹽緩沖體系中反應不同時間自氧化產物的吸收光譜

圖3 QCT在磷酸鹽緩沖體系中反應不同時間自氧化產物的吸收光譜
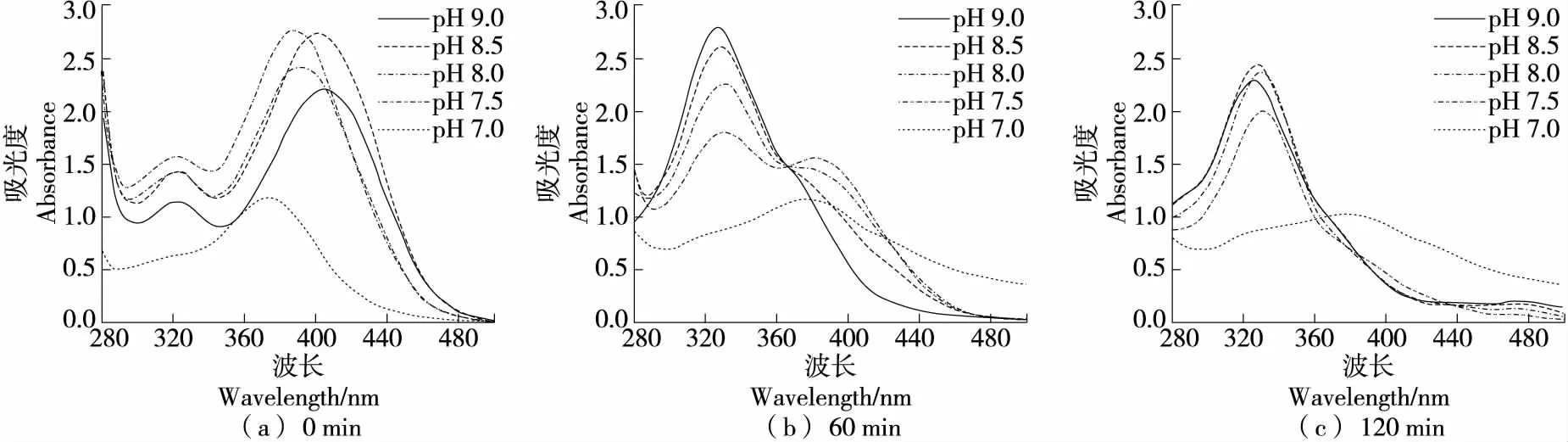
圖4 QCT在Tris-HCl緩沖體系中反應不同時間自氧化產物的吸收光譜
在磷酸鹽緩沖體系中(圖6),GA在堿性條件下反應時間越長,340~360 nm處吸收峰越明顯,且在中性條件下反應120 min時也發現吸收峰,而酸性條件下120 min 內該處無吸收峰,說明GA在酸性條件下穩定。堿性條件下反應120 min在446 nm處有明顯吸收峰。由此可知,GA在堿性條件下60 min內、中性條件下120 min內,均可發生自氧化并出現自氧化中間產物堆積,而自氧化產生終產物的反應需要較長的時間或需要有較多中間產物累積才能發生。
由圖7可知,GA在Tris-HCl緩沖體系中自氧化中間產物特征吸收峰為340 nm,終產物特征吸收峰在446 nm。在堿性條件下,GA反應60 min就已在340,446 nm 處出現吸收峰,且隨pH升高、反應時間延長峰值升高。由此可知,GA自氧化反應對反應時間和pH條件敏感,pH越高、反應時間越長產生的中間產物和終產物越多。中性條件下GA在反應60 min內尚未發生自氧化,而反應120 min時已出現自氧化中間產物。
綜上可知,GA僅在堿性條件和中性條件(較長反應時間下)發生自氧化反應。在硼酸鹽緩沖體系中,60 min僅有輕微自氧化跡象,120 min時才明顯出現中間產物,且中性和弱堿性條件下自氧化不明顯;在堿性磷酸鹽緩沖體系中反應60 min僅產生中間產物;在Tris-HCl緩沖體系中,反應60 min就已出現中間產物和終產物。相比之下,GA在硼酸鹽緩沖體系中的穩定性最強,磷酸鹽緩沖體系次之,Tris-HCl緩沖體系最差。
2.2.3 對C自氧化的影響 圖8顯示,除pH 7.0及pH 7.5,C在硼酸鹽緩沖體系中反應60 min時在328 nm處產生吸收峰,且峰高隨反應時間和pH的增加而增加;反應120 min后,除中性條件外均出現吸收峰且較60 min時有明顯升高。反應60 min與120 min均在452 nm處產生非常小的吸收峰但差異不明顯。因此,在硼酸鹽緩沖體系中,C在堿性條件下容易自氧化產生中間產物,但終產物的生成較為緩慢。

圖5 GA在硼酸鹽緩沖體系中反應不同時間自氧化產物的吸收光譜
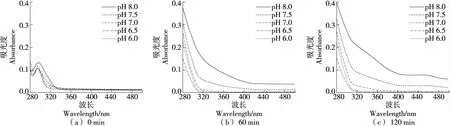
圖6 GA在磷酸鹽緩沖體系中反應不同時間自氧化產物的吸收光譜
如圖9所示,C在堿性磷酸鹽緩沖體系中反應60 min 在430 nm處出峰,反應時間越長峰越高,堿性條件下反應60 min和120 min后,在320 nm處吸收峰均不高,說明在堿性磷酸鹽緩沖體系中反應60 min后,C已經發生了自氧化,且產生的中間產物被快速反應掉形成了終產物。而在酸性磷酸鹽體系中,C未發生自氧化(120 min內)。C在酸性條件下具有較強抗氧化性,在偏堿性或C濃度較高的條件下容易發生自氧化[36],且堿性越強自氧化速率越快[37]。
在Tris-HCl緩沖體系中(圖10),C在反應60 min后在320,430 nm處出現吸收峰,說明已經發生自氧化并生成終產物;反應120 min后,在320,430 nm的吸收峰明顯增高,說明反應仍在不斷進行。C由3個烴環組成,其中B環上的鄰二羥基具有強大的氫供應能力,易在堿性條件下釋放氫,先反應為半醌自由基中間態然后轉變為鄰醌結構,C鄰醌還能與C發生聚合反應[38]。
綜上可知,C在酸性和中性條件下不發生自氧化。在堿性硼酸鹽緩沖體系中僅出現中間產物;在磷酸鹽緩沖體系中反應120 min出現終產物,中間產物不明顯;而在Tris-HCl緩沖體系中反應60 min已有明顯自氧化現象。因此,C在硼酸鹽和磷酸鹽緩沖體系中穩定性優于Tris-HCl體系。

圖7 GA在Tris-HCl緩沖體系中反應不同時間自氧化產物的吸收光譜

圖8 C在硼酸鹽緩沖體系中反應不同時間自氧化產物的吸收光譜

圖9 C在磷酸鹽緩沖體系中反應不同時間自氧化產物的吸收光譜
2.2.4 對DOPAC自氧化的影響 由圖11可知,DOPAC在硼酸鹽緩沖體系(pH 7.0~9.0)中具有較強的穩定性,可保持120 min內不發生自氧化。
在磷酸鹽緩沖體系中(圖12),DOPAC在pH 8.0(60 min)與pH 7.5 (120 min)條件下于345 nm處出現吸收峰,推測此處為自氧化中間產物的特征吸收峰。其中pH 7.5條件下吸收峰非常小,說明該條件下DOPAC發生氧化的程度較小。
DOPAC在Tris-HCl體系(圖13)反應60 min時,堿性條件下在346 nm處有吸收峰,且隨pH增大峰增高;隨著時間的延長,吸收峰持續升高,說明自氧化中間產物持續生成,但均未見自氧化終產物產生。
綜上可知,DOPAC在酸性和中性條件下均不發生自氧化,且在硼酸鹽緩沖體系中,120 min內堿性條件下也未出現自氧化;在磷酸鹽緩沖體系中,在pH 8.0條件下反應60 min已有自氧化跡象,在pH 7.5反應120 min時出現了自氧化中間產物;在Tris-HCl緩沖體系中60 min出現中間產物和終產物,且反應時間越長,兩種產物量均增加,說明在該體系中自氧化易發生。因此,DOPAC在硼酸鹽緩沖體系中穩定性優于磷酸鹽和Tris-HCl體系。

圖10 C在Tris-HCl緩沖體系中反應不同時間自氧化產物的吸收光譜
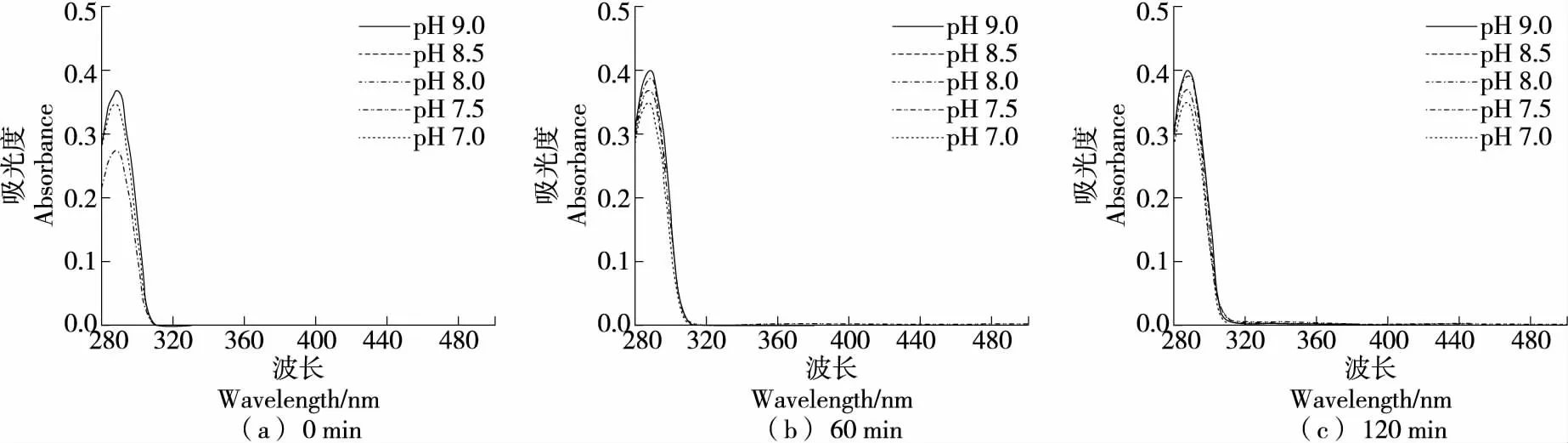
圖11 DOPAC在硼酸鹽緩沖體系中反應不同時間自氧化產物的吸收光譜

圖12 DOPAC在磷酸鹽緩沖體系中反應不同時間自氧化產物的吸收光譜
綜合以上可知,4種多酚在Tris-HCl緩沖體系中自氧化程度均較其他兩種緩沖體系更明顯,因此在探究利用紫外分光光度法檢測多酚對LOX酶活性的影響試驗中,Tris-HCl緩沖體系不適用,而硼酸鹽體系稍優于磷酸鹽體系。為保證多酚的抗氧化性,應選用弱堿體系、中性或酸性體系,而為保證LOX酶的活性則應選擇堿性條件,因此,選取pH 7.5的弱堿體系進行后續研究。
2.3 多酚濃度對LOX酶活的影響
圖14顯示了不同濃度的4種多酚在pH 7.5的硼酸鹽緩沖體系中對LOX酶活性的影響。濃度為0.00~1.00 mmol/L 時,QCT、GA、C的LOX酶活出現先降后增的現象,其中QCT與GA在0.25 mmol/L、C在0.1 mmol/L 時抑制效果最好,且抑制效果為QCT>C>GA。說明多酚在一定濃度范圍內對LOX酶活具有抑制作用,與Cao等[39]的研究結果一致。但多酚濃度過高該抑制作用又會減弱,可能是由于多酚在高濃度條件下自氧化速率增加[30]。在0~1 mmol/L范圍內DOPAC對LOX酶活性的抑制效果逐步增大,在濃度為1 mmol/L時其酶活抑制效果優于0.10 mmol/L的C,但次于0.10 mmol/L 的QCT。具有鄰苯二酚結構的酚類可通過該結構鰲合介導脂質發生過氧化的Cu2+、Fe2+從而發揮抗氧化作用,多酚自身則被氧化成為具有穩定結構的苯醌類產物[40]。Fe2+為LOX的活性中心,被多酚螯合后LOX活性減弱。整體而言,QCT對LOX酶活的抑制效果最強,C次之,再次為GA,DOPAC為最差。

圖13 DOPAC在Tris-HCl緩沖體系中反應不同時間自氧化產物的吸收光譜

不同濃度下的字母不同表示差異顯著(P<0.05)
3 結論
研究發現,pH和緩沖體系對脂氧合酶活性及4種多酚(槲皮素、沒食子酸、兒茶素、3,4-二羥基苯乙酸)自身結構穩定性均有影響。4種多酚在不同緩沖體系的弱堿、中性或酸性條件下自氧化程度小,且pH越小自氧化程度越小,自身結構穩定性越強,能夠更好地發揮自身功能特性。綜合來看,4種多酚在硼酸鹽體系中發生的自氧化程度最小,而Tris-HCl體系中自氧化程度最大。試驗選用的脂氧合酶在堿性條件下活性較強,因此檢測多酚對脂氧合酶酶活影響時選擇弱堿性(pH 7.5)的硼酸鹽緩沖體系。因此,在研究多酚對脂氧合酶活性影響的研究中,應對所選用脂氧合酶適用pH范圍進行檢測,若其最適pH處于酸性范圍內則可以選擇其最適pH作為緩沖pH條件,無需考慮多酚自氧化特性。
在pH 7.5的硼酸鹽緩沖液條件下,利用紫外分光光度法檢測多酚濃度對脂氧合酶酶活的影響發現,在一定濃度范圍內,多酚濃度越大對脂氧合酶酶活的抑制作用越強,但濃度過高時則可能因多酚自氧化速率加快,導致對脂氧合酶酶活的抑制作用減弱。整體而言,槲皮素對脂氧合酶酶活的抑制效果最強,兒茶素次之,再次為沒食子酸,3,4-二羥基苯乙酸為最差。
研究主要對植物多酚的自氧化情況和植物多酚抑制脂氧合酶的效果進行研究探討,后續研究可以從分子結構和蛋白結構層面對不同結構的多酚對脂氧合酶抑制效果差異的機理原因進行深入研究,也可探究多酚應用于復雜體系(例如植物油、動物肉等)中時對脂氧合酶的抑制效果。

