基于二氧化錳納米片和核酸外切酶I構(gòu)建熒光適配體傳感器檢測(cè)氯霉素
馬鵬飛 齊 碩 呂 艷 周 游 王周平
(1. 江南大學(xué)食品國(guó)家重點(diǎn)實(shí)驗(yàn)室,江蘇 無(wú)錫 214122;2. 江南大學(xué)食品學(xué)院,江蘇 無(wú)錫 214122)
氯霉素(Chloramphenicol,CAP)是一種廣譜抗生素,對(duì)革蘭氏陽(yáng)性和陰性菌均有抑制作用,曾被廣泛地應(yīng)用于感染性疾病治療[1-3]。然而氯霉素對(duì)人體有很大的毒副作用,可抑制人體骨髓造血功能從而引起再生性障礙性貧血癥等[4-5]。根據(jù)中華人民共和國(guó)農(nóng)業(yè)農(nóng)村部第250號(hào)公告,氯霉素禁止在食品和動(dòng)物飼料中使用。由于氯霉素低廉的成本和優(yōu)異的抑菌效果,目前仍然有一些氯霉素在蜂蜜、牛奶和水產(chǎn)品中違法使用的報(bào)道。因此,為了保障公眾健康,需要建立一種準(zhǔn)確靈敏的氯霉素檢測(cè)方法。目前廣泛使用的氯霉素檢測(cè)方法有液相色譜—質(zhì)譜法[6]、酶聯(lián)免疫法[7]、超高效液相色譜法[8]等,但是這些方法需要專業(yè)和經(jīng)驗(yàn)豐富的技術(shù)人員,儀器價(jià)格昂貴且檢測(cè)耗時(shí)較長(zhǎng)。近年來(lái),科研人員報(bào)道了一些基于納米材料和核酸適配體的新型氯霉素檢測(cè)方法,包括電化學(xué)法[9]、熒光法[10]和比色法[11]等,為氯霉素的檢測(cè)提供了新思路。
適配體(Aptamer)是通過(guò)指數(shù)富集配體進(jìn)化(SELEX)技術(shù)篩選得到,長(zhǎng)度在10~100個(gè)核苷酸范圍內(nèi)的單鏈DNA或RNA。適配體能夠通過(guò)結(jié)構(gòu)轉(zhuǎn)換、氫鍵和疏水相互作用等與生物小分子、金屬離子、蛋白質(zhì)、細(xì)胞以及細(xì)菌等高效的結(jié)合[12-14]。適配體與抗體相比,具有制備簡(jiǎn)單,易于功能化修飾,穩(wěn)定性好的優(yōu)點(diǎn)[15-18]。適配體的這些優(yōu)點(diǎn)為研制應(yīng)用于食品安全檢測(cè)與控制中的傳感器提供了基礎(chǔ)。如趙旭等[19]研制了一種基于核酸適配體的鎘離子可視化檢測(cè)方法,檢測(cè)的線性范圍為0.1~5.0 ng/mL,檢測(cè)為0.5 ng/mL。許宙等[20]基于磁性納米材料,構(gòu)建了一種酶聯(lián)增敏適配體傳感器檢測(cè)雙酚A,檢測(cè)限低至0.5 pg/mL。
二氧化錳納米片(Manganese dioxide nanosheet,MnO2NS)是一種超薄的二維納米材料,具有優(yōu)良的熒光淬滅能力,在生物傳感,細(xì)胞成像和藥物輸送領(lǐng)域具有廣闊的應(yīng)用前景[21-23],如Wang等[24]基于MnO2NS淬滅有機(jī)染料熒光原理,構(gòu)建了檢測(cè)microRNA的傳感平臺(tái),檢測(cè)限為0.8 nmol/L。核酸外切酶I(Exonuclease I, Exo-I)能夠以3末端到5末端方向降解單鏈DNA,不依賴于特異的核苷酸序列,能夠有效地?cái)U(kuò)增信號(hào)進(jìn)而實(shí)現(xiàn)對(duì)靶標(biāo)的檢測(cè)。
研究擬利用MnO2NS對(duì)核酸適配體的熒光淬滅能力,以及Exo-I的酶促靶標(biāo)循環(huán)放大信號(hào)作用,構(gòu)建一種靈敏的氯霉素?zé)晒鈾z測(cè)新方法。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
牛血清白蛋白(BSA)、醋酸錳、氯化鈉和氯化鉀等:分析純,國(guó)藥集團(tuán)化學(xué)試劑有限公司;
FAM標(biāo)記的氯霉素適配體(5’-FAM-ACTTCAGTGAGTTGTCCCACGGTCGGCGAGTCGGTGGTAG)、核酸外切酶I(Exo-I,20 U/μL):生工生物工程(上海)股份有限公司;
氯霉素、四環(huán)素、土霉素、卡那霉素和甲砜霉素:上海阿拉丁生化科技股份有限公司;
全黑96孔微孔板:美國(guó)康寧公司;
氯霉素酶聯(lián)免疫檢測(cè)試劑盒:百奧森食品安全科技有限公司;
超純水:18.2 MΩ,由Millipore凈水系統(tǒng)制備。
1.1.2 主要儀器設(shè)備
酶標(biāo)儀:BioTek SynergyH1型,美國(guó)BioTek 公司;
透射電鏡:JEM-2100型,日本電子株式會(huì)社;
原子力顯微鏡:Dimension ICON型,德國(guó)布魯克科技有限公司。
1.2 試驗(yàn)方法
1.2.1 MnO2NS的制備 二氧化錳的合成參照Han等[25]的方法并作改進(jìn)。取1 mL質(zhì)量濃度為1 mg/mL的BSA和1 mL質(zhì)量濃度為0.05 g/mL的醋酸錳置于250 mL的燒杯中,并向燒杯中加入98 mL超純水至燒杯內(nèi)溶液總體積為100 mL;將燒杯置于磁力攪拌器上,常溫?cái)嚢杈鶆颍?0 min后,向溶液中加入濃度為1 mol/L的氫氧化鈉溶液,將溶液的pH值調(diào)節(jié)到8.0;將溶液置于磁力攪拌器上繼續(xù)攪拌6 h,得到淺黃色的溶液,溶液經(jīng)離心沉淀后,所得材料沉淀用超純水清洗兩次,在4 ℃冰箱中保存?zhèn)溆谩?/p>
1.2.2 檢測(cè)體系的構(gòu)建 將適配體原液(1 μmol/L)在95 ℃ 加熱5 min后,置于室溫靜置30 min,使適配體形成穩(wěn)定的空間構(gòu)象。在1.5 mL的離心管中加入10 μL的適配體原液和10 μL的MnO2NS原液(1 mg/mL),加入180 μL氯霉素結(jié)合緩沖液(10 mmol/L Tris-HCl,100 mmol/L NaCl,5 mmol/L KCl,5 mmol/L MgCl2,pH 7.4)使得溶液總體積為200 μL。為了使適配體完全被MnO2NS吸附,適配體與MnO2NS在室溫避光條件下,孵育30 min。將5 μL的氯霉素標(biāo)準(zhǔn)品加入到離心管中,同時(shí)加入4 μL的Exo-I,37 ℃下避光孵育50 min。最后將100 μL反應(yīng)液體加入酶標(biāo)板中,置于酶標(biāo)儀中檢測(cè)熒光強(qiáng)度,激發(fā)波長(zhǎng)485 nm,發(fā)射波長(zhǎng)528 nm。
1.2.3 MnO2NS質(zhì)量濃度的優(yōu)化 MnO2NS的質(zhì)量濃度與適配體是否被完全吸附有關(guān),如果溶液中有游離的適配體,會(huì)造成檢測(cè)的熒光背景信號(hào)高,影響檢測(cè)性能。在50 nmol/L適配體濃度下,加入不同體積的MnO2NS,使其終質(zhì)量濃度分別為0.01,0.02,0.05,0.10,0.20,0.30 mg/mL,測(cè)定體系熒光強(qiáng)度。
1.2.4 適配體濃度的優(yōu)化 固定Exo-I的用量和酶切時(shí)間不變,在5 nmol/L氯霉素濃度下,加入不同濃度的適配體,使其終濃度分別為5,10,20,50,100,150,200 nmol/L,測(cè)定體系熒光強(qiáng)度。
1.2.5 Exo-I用量的優(yōu)化 固定適配體濃度,MnO2NS質(zhì)量濃度和酶切時(shí)間不變,在5 nmol/L氯霉素濃度下,加入不同體積的Exo-I,使其在檢測(cè)體系中的用量分別為0.1,0.2,0.3,0.4,0.5,0.6,0.7 U/μL,測(cè)定體系熒光強(qiáng)度。
1.2.6 酶切時(shí)間的優(yōu)化 固定適配體濃度,MnO2NS質(zhì)量和Exo-I用量不變,在5 nmol/L氯霉素濃度下,酶切時(shí)間分別為10,30,50,70,90,110 min,測(cè)定熒光強(qiáng)度。
1.2.7 實(shí)際樣品檢測(cè) 從當(dāng)?shù)爻匈?gòu)買(mǎi)合格的蜂蜜,用氯霉素適配體結(jié)合緩沖液稀釋20倍之后,用0.22 μm 濾膜過(guò)濾稀釋液體。將不同濃度的氯霉素標(biāo)準(zhǔn)品加入濾液,用試驗(yàn)構(gòu)建的檢測(cè)方法進(jìn)行檢測(cè),計(jì)算實(shí)際樣品檢測(cè)加標(biāo)回收率,并與商用酶聯(lián)免疫法進(jìn)行比較。
2 結(jié)果與討論
2.1 檢測(cè)原理
如圖1所示,熒光基團(tuán)FAM標(biāo)記的氯霉素適配體首先被MnO2NS吸附,基于熒光能量共振轉(zhuǎn)移效應(yīng),適配體標(biāo)記的熒光被淬滅。當(dāng)溶液中無(wú)氯霉素時(shí),即使加入Exo-I,由于MnO2NS會(huì)阻礙酶切,Exo-I無(wú)法剪切被二氧化錳吸附的適配體,溶液無(wú)熒光恢復(fù)。當(dāng)溶液中存在氯霉素時(shí),適配體特異性地與氯霉素結(jié)合后,從MnO2NS表面解離,溶液熒光恢復(fù);在有Exo-I存在的條件下,Exo-I剪切溶液中與氯霉素結(jié)合而脫離MnO2NS的適配體。適配體由于被剪切,失去了結(jié)構(gòu)的完整性進(jìn)而無(wú)法與氯霉素結(jié)合,釋放出來(lái)的氯霉素會(huì)再次與被MnO2NS吸附的適配體結(jié)合,使適配體從MnO2NS表面解離,溶液進(jìn)一步恢復(fù)熒光,從而實(shí)現(xiàn)對(duì)氯霉素的檢測(cè)。
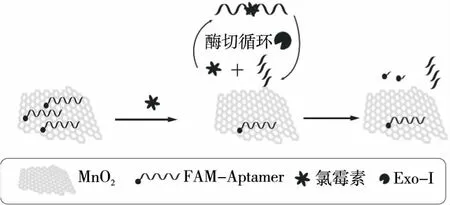
圖1 氯霉素檢測(cè)原理圖
2.2 二氧化錳納米片的表征
圖2為MnO2NS的表征圖。由圖2(a)可知,制備的MnO2NS呈薄片狀結(jié)構(gòu),具有較大的比表面積;由圖2(b)和圖2(c)可知,制備的MnO2NS厚度大約為1.2 nm,是單層MnO2NS。
2.3 試驗(yàn)條件優(yōu)化
2.3.1 MnO2NS質(zhì)量濃度的優(yōu)化 由圖3可知,隨著MnO2NS質(zhì)量濃度的增加,溶液的熒光值減小,當(dāng)MnO2NS 質(zhì)量濃度≥0.05 mg/mL時(shí),溶液中適配體的熒光被完全淬滅,表明適配體完全被MnO2NS吸附,無(wú)游離的,因此選擇0.05 mg/mL為MnO2NS的最佳質(zhì)量濃度。
2.3.2 適配體濃度的優(yōu)化 由圖4可知,隨著適配體濃度的增加,溶液的熒光值增加,當(dāng)適配體的濃度≥50 nmol/L 時(shí),溶液的熒光值基本達(dá)到飽和,說(shuō)明此時(shí)適配體的量已經(jīng)達(dá)到飽和,同時(shí)為了節(jié)約適配體的使用量,增加檢測(cè)的經(jīng)濟(jì)性,選擇50 nmol/L為適配體的最佳濃度。
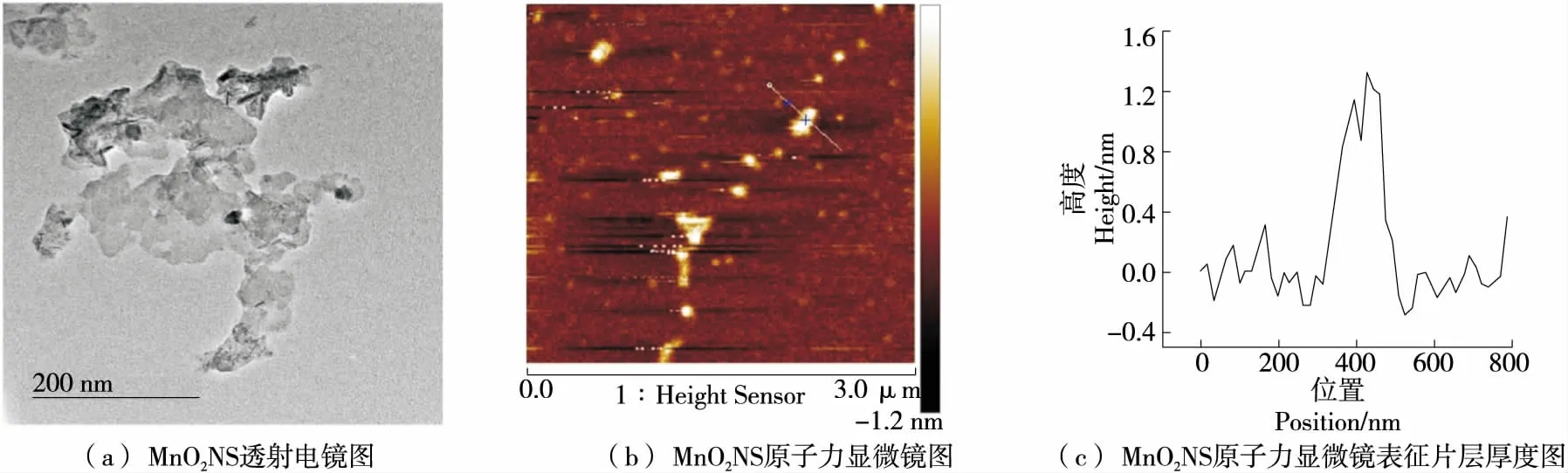
圖2 二氧化錳納米片表征圖
2.3.3 Exo-I用量的優(yōu)化 由圖5可知,隨著Exo-I用量的增加,更多的適配體從MnO2NS解離,溶液熒光強(qiáng)度增大,當(dāng)酶在檢測(cè)體系中的用量≥0.4 U/μL時(shí),溶液熒光強(qiáng)度基本保持不變,說(shuō)明體系中酶的用量達(dá)到飽和,選擇0.4 U/μL作為Exo-I的最佳用量。
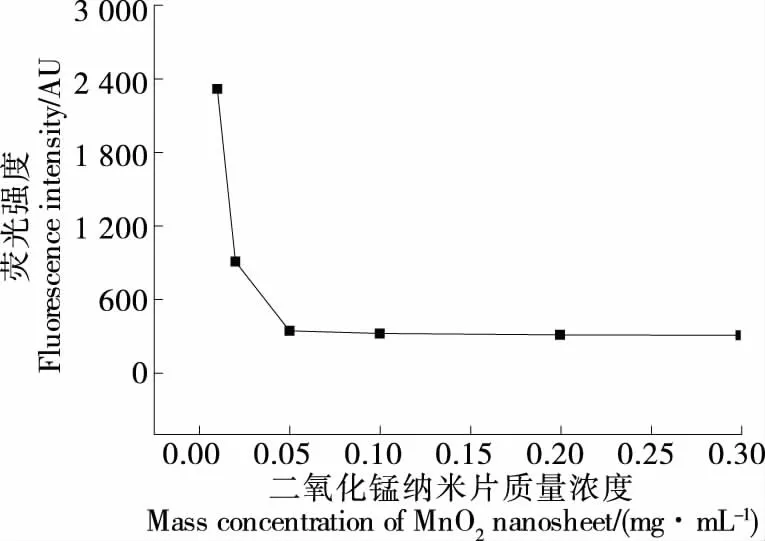
圖3 二氧化錳納米片質(zhì)量濃度的優(yōu)化
2.3.4 酶切時(shí)間的優(yōu)化 由圖6可知,隨著酶切時(shí)間的增加,溶液熒光強(qiáng)度迅速增大,當(dāng)酶切時(shí)間≥40 min時(shí),溶液的熒光值趨于平穩(wěn),說(shuō)明酶切達(dá)到飽和;若酶切不充分,體系熒光弱,將影響檢測(cè)性能;而酶切時(shí)間過(guò)長(zhǎng),將影響檢測(cè)效率,因此選擇50 min作為最佳酶切時(shí)間。
2.4 線性范圍與檢測(cè)限
在最佳的試驗(yàn)條件下,利用構(gòu)建的檢測(cè)方法,對(duì)不同濃度的氯霉素標(biāo)準(zhǔn)品進(jìn)行檢測(cè),由圖7可知,氯霉素的濃度為0.1~80.0 nmol/L時(shí),氯霉素濃度與熒光強(qiáng)度呈良好的線性,校正曲線方程為y=856lgx+1 459(R2=0.995),檢出限為0.08 nmol/L(S/N=3)。
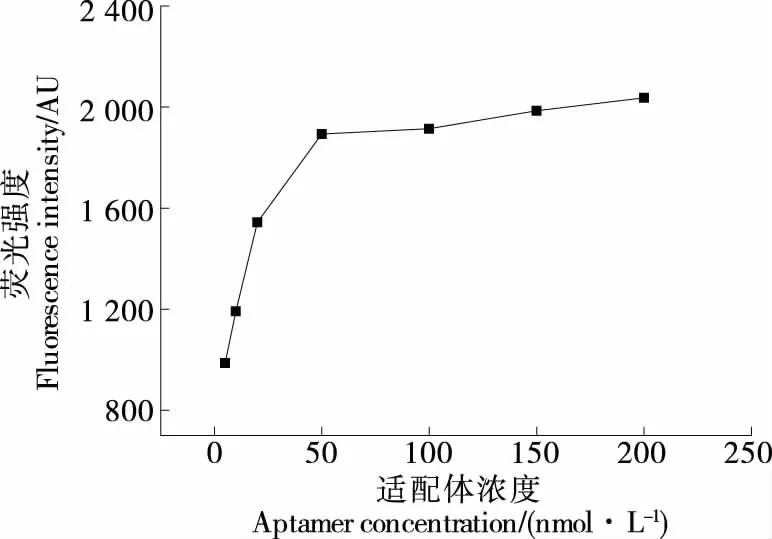
圖4 適配體濃度的優(yōu)化
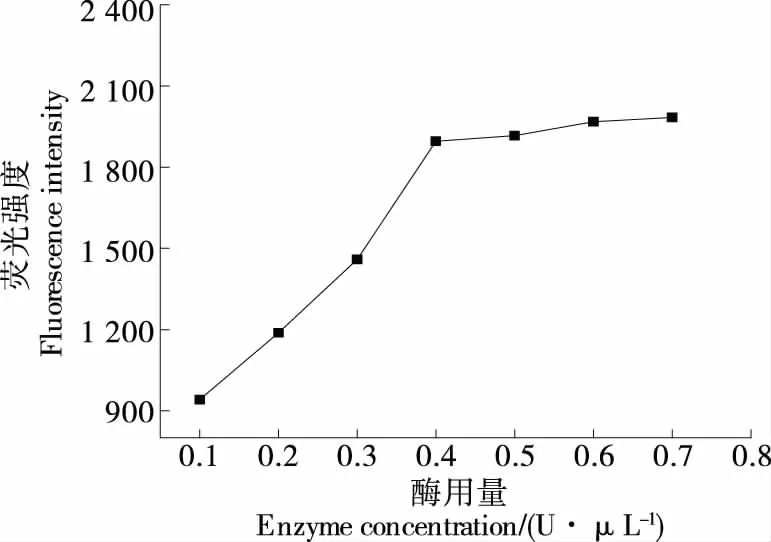
圖5 核酸外切酶I用量的優(yōu)化

圖6 酶切時(shí)間的優(yōu)化
2.5 特異性
為了驗(yàn)證檢測(cè)方法的特異性,在最優(yōu)試驗(yàn)條件下,選擇甲砜霉素、四環(huán)素、土霉素、卡那霉素進(jìn)行分析檢測(cè),濃度均為1 nmol/L。由圖8可知,氯霉素與其他抗生素的熒光強(qiáng)度差距明顯,表明該適配體傳感器具有良好的特異性。
2.6 實(shí)際樣品加標(biāo)回收試驗(yàn)
為了驗(yàn)證所構(gòu)建的適配體傳感器在實(shí)際樣品檢測(cè)中的準(zhǔn)確性,用蜂蜜樣品進(jìn)行加標(biāo)回收試驗(yàn),并將檢測(cè)結(jié)果與酶聯(lián)免疫法進(jìn)行對(duì)比,結(jié)果見(jiàn)表1。由表1可知,加標(biāo)試驗(yàn)回收率為92%~99%,酶聯(lián)免疫法的回收率為91%~103%,表明方法具有良好的準(zhǔn)確性,可用于實(shí)際樣品檢測(cè)。
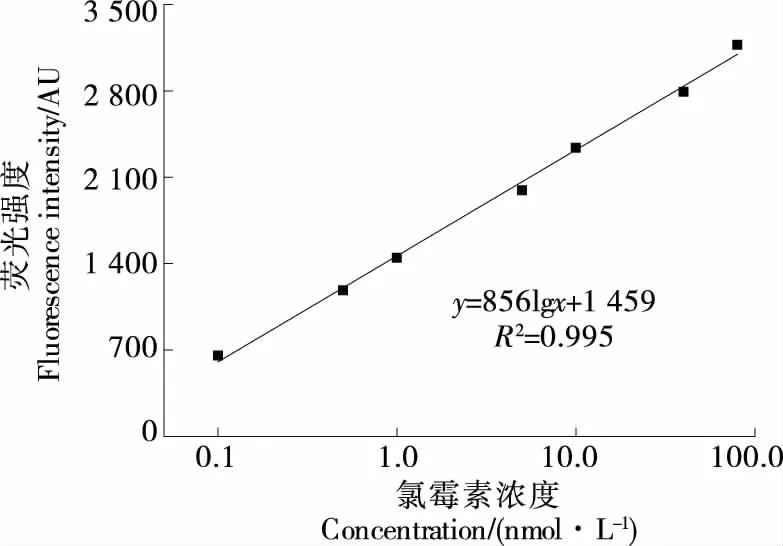
圖7 熒光強(qiáng)度與氯霉素的線性關(guān)系

圖8 特異性分析

表1 氯霉素加標(biāo)回收率
3 結(jié)論
研究構(gòu)建了一種基于MnO2NS和Exo-I酶切擴(kuò)增的方法檢測(cè)氯霉素,在最優(yōu)條件下,檢測(cè)限達(dá)0.08 nmol/L。檢測(cè)方法操作簡(jiǎn)單,特異性好,靈敏度高,在實(shí)際樣品檢測(cè)中加標(biāo)回收率與商用酶聯(lián)免疫試劑盒保持一致,具有較強(qiáng)的實(shí)用性,但酶的活性會(huì)受到溫度的影響,后續(xù)研究可通過(guò)加入一定量的多糖等增強(qiáng)酶的穩(wěn)定性。

