血肌酐與胱抑素C比值在非酒精性脂肪性肝病中的臨床意義
李少博, 楊迪, 葉雅芬, 韓峻峰
(上海交通大學附屬第六人民醫院內分泌代謝科, 上海 200233)
非酒精性脂肪性肝病(NAFLD)是指排除酒精和其他明確損肝因素導致的肝臟脂肪過度堆積為特征的疾病[1],目前人群NAFLD患病率超過25%,代謝綜合征人群中可高達60%~70%。NAFLD與糖脂代謝紊亂乃至心腦血管事件密切相關,并增加肝炎、肝硬化、肝癌風險[2],嚴重危害人類健康,但目前尚無批準用于治療NAFLD的藥物。因此,及早確定NAFLD高風險人群并針對性采取干預措施以預防疾病進展具有重要臨床意義。
最近研究報道, 骨骼肌量與內臟脂肪面積之比降低是中重度肝脂肪變和進展期肝纖維化的獨立危險因素[3]。一些縱向研究進一步表明,相對肌肉量減少與NAFLD風險增加密切相關[4]。肌肉減少會增加胰島素抵抗,并加重內臟脂肪堆積,這些均是導致NAFLD發生的重要危險因素[5],因此量化肌肉量可能是早期篩查NAFLD高風險人群的有效方法。目前可以通過計算機斷層掃描、生物電阻抗等多種手段量化肌肉量,但由于需要特殊的設備且價格昂貴,這些均難以作為臨床常規篩查手段[6]。在此基礎上,血肌酐與胱抑素C比值(creatinine-to-cystatin C ratio,CCR)作為相對肌肉量標志物的有效性得到驗證[7-9]。目前關于CCR與NAFLD的關系國內外尚無報道,本研究旨在探討CCR在早期識別NAFLD高風險人群中的臨床應用價值。
1 資料和方法
1.1 研究對象
回顧性選取2019年5月至2020年9月于上海交通大學附屬第六人民醫院減重代謝科住院并接受腹部超聲檢查的超重或肥胖患者162例(BMI≥24 kg/m2),納入同期正常BMI受試者64例(18.5~24 kg/m2),其中男性78例,女性148例,平均年齡(31.83±9.21)歲。納入標準:年齡>18歲,資料完整,性別不限,種族不限。排除標準:① 腎功能不全(血肌酐高于105 μmol/L或腎小球濾過率低于60 mL/min)或接受血液透析;② 飲酒(男性>140 g/周,女性>70 g/周)、病毒、遺傳、免疫或藥物相關肝病[10];③ 缺少重要的研究數據,例如年齡、性別、血肌酐和半胱氨酸蛋白酶抑制劑C濃度等;④ 妊娠或正在使用免疫抑制劑等特殊藥物;⑤ 惡性腫瘤或重要臟器嚴重疾病者。本研究通過本院倫理委員會批準且所有受試者均已簽署知情同意書。
1.2 研究方法和分組
每名受試者均接受全面的體格檢查和血清學測定。體格檢查包括身高、體重、腰圍、血壓等,身高精確到0.1 cm,體重精確到0.1 kg,腰圍為髂嵴與肋骨之間最小周長,測量精確到0.1 cm,仰臥位休息5 min后水銀血壓計監測血壓。隔夜進食至少10 h后,肘前靜脈抽取血樣,室溫靜置半小時,然后4 000 r/min離心10 min,收集上清液,使用全自動生化分析儀器 (Beckman,美國)檢測血糖、血清脂質、肝酶、腎功能等,電化學發光免疫分析法測定空腹胰島素和C肽濃度,免疫比濁法測定血清胱抑素C水平(參考范圍0.40~1.10 mg/L), 采用肌氨酸氧化酶法檢測血清肌酐含量(參考范圍為53.00~115.00 μmol/L)。
CCR=血清肌酐(μmol/L)/胱抑素C(mg/L)。考慮到既往研究中CCR水平的男女性別差異[11],根據性別分別行三分位分組,其中男性低分位數組(51.67~80.00),中分位數組(80.00~105.00),高分位數組(105.71~170.00);女性低分位數組(43.75~70.00),中分位數組(71.43~97.14),高分位數組(98.00~167.50)。
1.3 NAFLD的診斷
所有受試者均接受肝臟超聲檢查,依據中華醫學會肝臟學分會制定的《非酒精性脂肪性肝病診療指南》中的B超標準[10],具備以下2項及以上即可診斷為脂肪肝:① 肝近場回聲彌漫性增強(“明亮肝”),回聲強于腎臟;② 肝內管道顯示不清,血管模糊;③ 肝遠場回聲逐漸減弱。
1.4 統計學方法
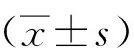
2 結果
2.1 研究對象一般臨床資料
226例入組受試者中,男性78例(34.51%),女性148例(65.49%)。總受試者中NAFLD的患病率為72.12%(163/226),無論男性還是女性NAFLD患者的CCR水平均明顯低于非NAFLD受試者(圖1)。與此一致,CCR低分位數組NAFLD患病率顯著高于中分位數組和高分位數組(P<0.01)。隨著CCR水平的增加,BMI、腰圍、收縮壓、舒張壓、空腹血糖、餐后2 h血糖(2hPG)、糖化血紅蛋白(HbA1c)、空腹C肽、胰島素抵抗指數(HOMA-IR)、三酰甘油、AST、ALT、γ-GT顯著降低,而HDL-C顯著增加,差異均具有統計學意義。見表1。

*:P<0.01,與非NAFLD比較圖1 NAFLD人群與非NAFLD人群CCR均值比較

表1 研究對象按照CCR三分位數分組后的一般臨床資料
2.2 CCR與NAFLD致病因素的相關性分析
無論男女,CCR水平與空腹血糖、HbA1c、HOMA-IR、AST、γ-GT、三酰甘油、尤其BMI(男性:r=-0.584,女性:r=-0.463,P<0.01)及腰圍(男性:r=-0.562,女性:r=-0.514,P<0.01)呈顯著負相關,與HDL-C呈顯著正相關,與年齡、總膽固醇、LDL-C無明顯相關。見表2。

表2 CCR與NAFLD致病因素的相關性分析
2.3 CCR與NAFLD發生風險的Logistic回歸分析
結合表1,以CCR高分位數組作為參照,采用Logistic回歸模型分析不同CCR水平對NAFLD發生的致病風險。結果顯示,在未校正模型中,中分位數組發生NAFLD的OR值4.805(95%CI:2.351~9.820),低分位數組為23.129(95%CI:7.663~69.805)。在分別調整性別、年齡、糖脂代謝指標后(模型3),中分位數組OR值為2.722 (95%CI:1.078~6.875),低分位數組OR值為5.096(95%CI:1.439~18.051),仍有顯著統計學差異(P<0.05)。見表3。以上結果表明CCR低水平是NAFLD發生的重要獨立風險因素。

表3 CCR預測NAFLD發生風險的Logistic回歸分析結果
2.4 CCR用于篩查NAFLD高風險人群的ROC曲線分析
為了明確CCR用于篩查NAFLD高風險人群的切點水平,按照不同性別進行ROC曲線分析,結果如圖2。男性群體曲線下面積(AUC)為0.865 (95%CI: 0.769~0.932,P<0.01), 切點為94.44,敏感度和特異度分別為68.0%和100%;女性人群AUC為0.806(95%CI: 0.733~0.866,P<0.01), 切點為91.43,敏感度和特異度分別為73.1%和79.6%;為提升臨床應用價值,當男性CCR≤58.75或女性CCR≤51.11時,用于篩查NAFLD高風險人群的敏感度可達到95%。

圖2 CCR用于篩查NAFLD高風險人群的ROC曲線分析
3 討論
本研究為探討NAFLD和CCR之間關系的首項中國人群研究,分析結果顯示較低CCR水平的人群NAFLD患病風險顯著增加,即使在調整了與NAFLD有關的血清學指標后這種關聯仍然十分明顯,ROC曲線分析顯示CCR在男性組和女性組的AUC均大于0.8,用于識別NAFLD的男性人群切點為94.44,女性為91.43,約登指數均大于0.5。這表明CCR可以作為篩查NAFLD高風險人群的簡易、廉價、無創的有效血清學指標。
本研究中,CCR與BMI、腰圍、HOMA-IR等肥胖指標顯著負相關,CCR低三分位組的人群表現出最明顯的一系列肥胖代謝特征。既往的研究報道,脂肪組織增加肥胖個體胱抑素C表達,血清分泌水平顯著升高[11],本研究結果與其相一致。胱抑素C表達于所有有核細胞,由腎小球濾過,它不受肌肉量的影響。而肌酐是肌肉分解代謝產物,其生成與肌肉量呈正比,但其血清濃度隨腎功能差異而變化,因此不能在臨床實踐中評估肌肉量[12]。在這種背景下,最近CCR被作為評價相對肌肉量的有效血清學指標,用以反映肌肉和脂肪相對比例,并在2型糖尿病老年人群中篩查肌肉減少癥患者[7]。值得一提的是,在本組病例中并沒有觀察到年齡和CCR的相關性,這與先前的報道不一致[13],這可能是由于人群選擇的異質性,本組病例以中青年人群為主。近年來,一些研究通過生物電阻抗評估身體成分,結果顯示肥胖個體具有較低的骨骼肌質量與內臟脂肪面積之比,同時該比值與BMI、腰圍、HMOA-IR等臨床或代謝指標負相關[3, 14]。這與本研究結果相一致,因此我們推斷CCR可能是反映骨骼肌質量與內臟脂肪面積之比的有效血清學替代指標。
最近來自日本的一項橫斷面研究報道,骨骼肌質量與內臟脂肪面積之比降低可顯著增加中重度脂肪變性和晚期纖維化風險[3]。一些縱向研究進一步表明,該比值增加與肝脂肪堆積和肝損傷改善密切相關[15-16]。類似地,本研究中CCR與AST、γ-GT呈顯著負相關,低水平CCR是NAFLD發生的獨立危險因素,并且可以有力預測NAFLD的發生。對此可能的解釋是CCR的兩個主要因素肌肉和脂肪與能量代謝和胰島素抵抗密切相關[17-18],這與本研究中CCR與HOMA-IR顯著負相關相一致;其次,骨骼肌減少和內臟脂肪增加與慢性炎癥反應、氧化應激和體育活動減少有關[19],這些均是NAFLD的致病機制。值得關注的是,盡管肥胖與NAFLD的發生密切相關,但中國非肥胖人群中五分之一患有NAFLD[20],進一步探究非肥胖NAFLD人群CCR特點可能有助于進一步理解其病理生理學機制。目前,飲食與運動相結合的生活方式干預仍然是NAFLD的主要治療方法[21],需要進一步研究生活方式干預與CCR之間的關系。
相比MRI、CT、生物電阻抗等技術手段,本研究通過血液采樣獲得的CCR指標可以更低成本地評估相對肌肉含量,這對于重復監測患者NAFLD風險變化具有重要意義。然而,本研究仍存在一些局限性。首先,本研究基于橫斷面分析,只是提供了有價值的線索,尚不能確定CCR水平與NAFLD發生的因果關系,將來可進行前瞻性研究證實。其次,肉類食物攝入、運動習慣以及服用西咪替丁等藥物[22],可能會增加肌酐水平。但對CCR影響輕微,不足以改變研究結果。最后,盡管診斷NAFLD的金標準是肝活檢,但為有創性檢查,不能反復進行,且獲取組織的代表性有限。而超聲作為臨床廣泛使用的篩查工具,積累了豐富的經驗,特別是對于中重度脂肪變性具有很高的敏感性和特異性,也得到了相關指南的推薦。
總之,較低的CCR水平與NAFLD風險增加獨立相關,可以作為早期識別NAFLD高風險人群的新型血清學指標。此外,本研究為明晰“肌肉在NAFLD發生中的作用”提供了新的證據,深入挖掘該領域的參與分子,有助于揭示NAFLD的潛在預防和治療措施。

