核苷磷酸化酶酶活力檢測方法的建立
唐艷,吳濤,2*,王成,孟月
(1.通遼梅花生物科技有限公司,內蒙古 通遼 028024;2.廊坊梅花生物技術開發有限公司, 河北 廊坊 065001)
肌苷(inosine),又名次黃苷、次黃嘌呤核苷,是由次黃嘌呤與核糖結合而成的核苷類物質。生產方法有兩種;一種是以枯草芽孢桿菌發酵法制備[1],另一種是以腺嘌呤及硫胺素雙重營養缺陷型的變異芽孢桿菌株,發酵制備得到肌苷[2-3]。肌苷能參與體內物質代謝和能量代謝,具有良好的藥用功效[4-5],可治療視網膜炎、視神經萎縮、抑郁癥[6]、糖尿病[7],可保肝、護肝,也可搶救肝昏迷[8]。肌苷酸由化學合成、酶法合成[9]、發酵法制得[10],具有獨特的增鮮風味[11-13],能有效地增強口感和食欲。
核苷磷酸化酶在最適宜的條件下[14-15]具有與肌苷、鳥苷共同作用的能力,生成肌苷酸二鈉、鳥苷酸二鈉、呈味核苷酸二鈉,通過高效液相色譜方法測定其含量[16-17]。核苷酸常用作食品添加劑和醫藥中間體,其中,嘌呤核苷[18]如肌苷和鳥苷,可通過發酵及核苷的磷酸化法大規模地生產核苷酸。目前,主要有兩種磷酸化方法[19-20];一種是化學磷酸化法,使用磷酸酰氯(POCl3);另一種是酶磷酸化法,使用大腸桿菌的肌苷激酶。化學磷酸化的過程相對復雜,需要兩個反應器,用于發酵和化學反應;酶的磷酸化過程比較簡單,在同一個反應器中進行發酵。酶的磷酸化法替代化學磷酸化法生產核苷酸是目前的趨勢,污染小,成本低,可營造健康的生產作業環境。因此,核苷磷酸化酶產品質量的判定十分重要,是生產工序的判定依據,酶活力檢測具有十分重要的意義,本文詳細地介紹了酶活力檢測的方法。
1 材料與方法
1.1 材料與儀器
1.1.1 藥材
肌苷、鳥苷、磷酸、三聚磷酸鈉、肌苷酸二鈉標準品(Sigma 優級純)、鳥苷酸二鈉標準品(Sigma優級純)、磷酸、乙腈(色譜純)、磷酸二氫鉀(分析純)。
1.1.2 器材
1200高效液相色譜儀 Agilent Technologies公司;電子天平(精度±0.00001 g)、pH計 梅特勒-托利多公司;Milli-Q超純水機、水浴鍋等。
1.2 實驗方法
1.2.1 酶解水浴反應
1.2.1.1 底物配制
稱取5 g肌苷(鳥苷)、5 g三聚磷酸鈉,完全溶解,用水定容至500 mL,配成10 g/L溶液,并用磷酸調pH至 4.50,作為底物。
1.2.1.2 體系預熱
分別吸取10 mL底物于試管中,置于35 ℃水浴中,預熱15 min。
1.2.1.3 酶液制備
將發酵液以10000 r/min離心5 min,去除清液與表面雜質,將菌體配成100 g/L 酶液。
1.2.1.4 水浴操作
向試管中分別移取一定體積酶液,與底物充分混勻,進行水浴反應,操作要迅速。
1.2.1.5 計算肌苷酸二鈉(鳥苷酸二鈉)生成量
每10 min取樣,100 ℃滅活5 min,冷卻后稀釋25倍,進行液相檢測,計算肌苷酸二鈉(鳥苷酸二鈉)的生成量。
1.2.2 液相檢測
1.2.2.1 流動相配制
流動相A:0.02 mol/L磷酸二氫鉀溶液(pH為4.5±0.01),稱取2.7218 g磷酸二氫鉀,置于1000 mL燒杯中,加入1000 mL超純水,在磁力攪拌器上攪拌至磷酸二氫鉀完全溶解,然后用磷酸調節pH 至4.5,過濾,待用。
流動相B:乙腈。
1.2.2.2 色譜條件
色譜柱:Polaris 5 C18-A (250 mm×4.6 mm),流動相A∶流動相B為99.5∶0.5(V/V),等度洗脫,柱溫:40 ℃,流速:1 mL/min,紫外檢測器(λ=254 nm),進樣量:2 μL。
1.2.2.3 前處理
a.標品配制
配制一系列不同濃度的肌苷酸二鈉、鳥苷酸二鈉標準溶液:濃度分別為0.1,0.2,0.4,0.6,0.8,1.0 g/L。
b.樣品處理
將滅活的反應液冷卻至室溫,稀釋25倍,用0.22 μm濾膜過濾,上機檢測IMP(GMP)含量。
1.2.2.4 測定
將處理好的待測樣品及不同濃度的標準品上機測序列,進行色譜分離測定IMP(GMP)含量。
1.2.3 酶活計算
根據不同濃度的肌苷酸二鈉標品及峰面積制作標準曲線方程,將樣品的峰面積帶入標準曲線中,計算(IMP)的含量(g/L),根據外標法測定IMP含量值,進而計算出磷酸化酶的活力。
酶活單位:用單位時間內單位體積中底物的減少量或產物的增加量來表示。在特定條件下,1 min內轉化1 μmol底物(或產物增加)所需的酶量為一個活力單位(U)。
2 結果與分析
2.1 酶反應條件考察
分別以10 g/L肌苷和10 g/L鳥苷為底物,同時考察酶反應時間及加酶量。
2.1.1 磷酸化酶水解肌苷結果
以10 g/L肌苷為底物,酶添加量分別為0.5,1,2 mL,反應60 min,檢測肌苷酸二鈉含量,見表1。
由表1可知,底物濃度為10 g/L,0.5 mL反應最佳,在60 min時沒有逆反應,此酶具有可逆反應,酶添加量為2 mL時,逆反應迅速,見圖1。
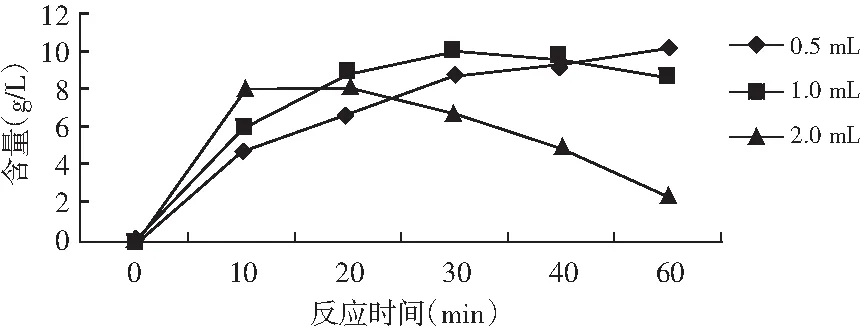
圖1 IMP含量趨勢圖Fig.1 The trendgram of IMP content
2.1.2 磷酸化酶水解鳥苷結果
底物10 g/L鳥苷替換肌苷,酶添加量為0.5,1,2 mL,反應30 min,測定鳥苷酸二鈉(GMP)含量,見表2。
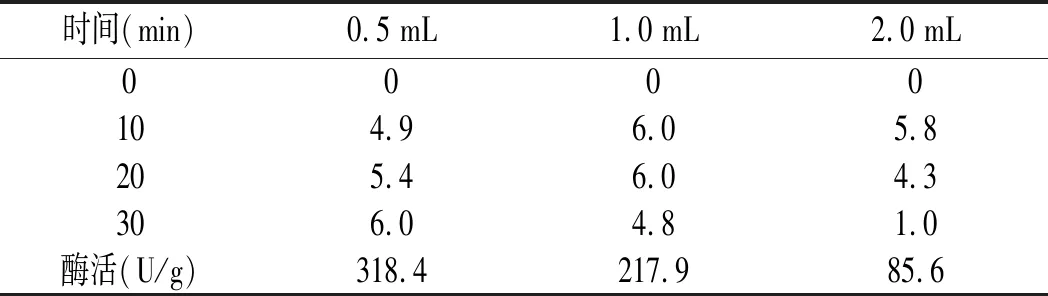
表2 酶活力結果-GMP含量(g/L)Table 2 The results of enzyme activity-GMP content (g/L)
由表2可知,底物濃度為10 g/L,0.5 mL酶液反應30 min結束,此酶與鳥苷底物反應時,1 mL酶液在20 min開始有逆反應,酶添加量為2 mL時,在10 min有逆反應且反應迅速,見圖2。
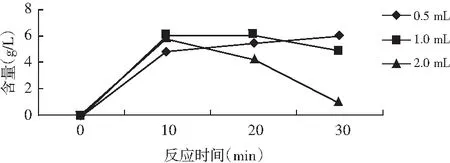
圖2 GMP含量趨勢圖Fig.2 The trendgram of GMP content
考慮底物濃度的影響,鳥苷溶解度低,10 g/L底物不能完全溶解,在水解過程中容易產生底物濃度不均勻,影響檢測結果,將底物濃度下降為5 g/L,酶添加量分別為0.5,1,2 mL,測定GMP含量,見表3。
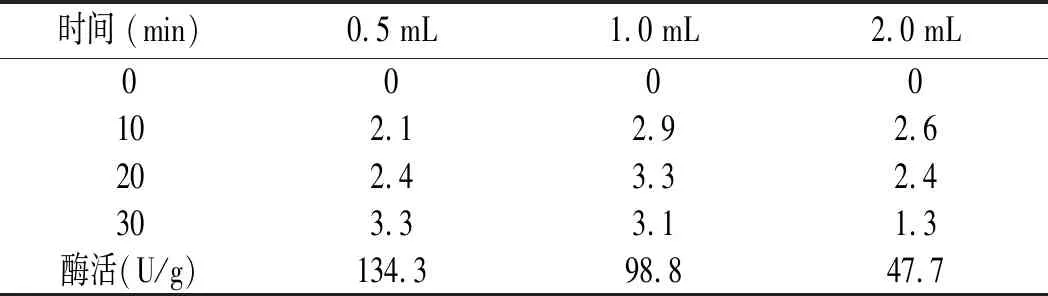
表3 酶活力結果-GMP含量(g/L)Table 3 The results of enzyme activity-GMP content (g/L)
由表3可知,0.5 mL酶液反應30 min結束,此酶與鳥苷底物反應時,2 mL酶液10 min已經有逆反應且明顯,見圖3。
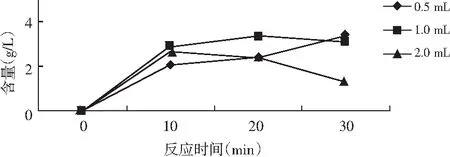
圖3 GMP含量趨勢圖Fig.3 The trendgram of GMP content
通過以上實驗,考慮鳥苷比肌苷溶解度差,檢測結果存在不穩定性,逆反應劇烈。可判定選用肌苷為底物,酶解水浴反應比鳥苷效果好,溶解迅速,結果準確。水解條件:底物濃度為10 g/L肌苷,為保證無逆反應,確定酶添加量為0.5 mL,反應時間10 min。
2.2 菌體狀態實驗考察
發酵菌體用水溶解制成酶液后,發現有黏稠、細胞裂解現象,因此采用增大溶液離子濃度,控制細胞裂解,為不引入其他離子,用三聚磷酸鈉溶液增大離子濃度。保持與底物濃度一致,不破壞反應體系,采用10 g/L的三聚磷酸鈉溶液配制酶液。選取5組實驗進行對比研究,測定酶活,見表4。

表4 菌體狀態及酶活力結果Table 4 The results of bacterial status and enzyme activity
增大酶液中的離子濃度,避免了細胞裂解,酶液的狀態很好,無黏稠現象,酶活明顯增加,可有效地避免細胞裂解現象,使酶反應充分表達,有效地提升酶液質量,提高酶液活力。因此用10 g/L的三聚磷酸鈉溶解菌體替代水溶解菌體方案,可解決菌體黏稠現象、細胞裂解問題。
2.3 液相條件考察
2.3.1 色譜柱選擇
采用ZORBAX Eclipse XDB-C18色譜柱測定核苷酸含量,新色譜柱測定峰圖正常,由于色譜柱不耐高水相,50針后柱子逐漸塌陷,出峰異常,見圖4。
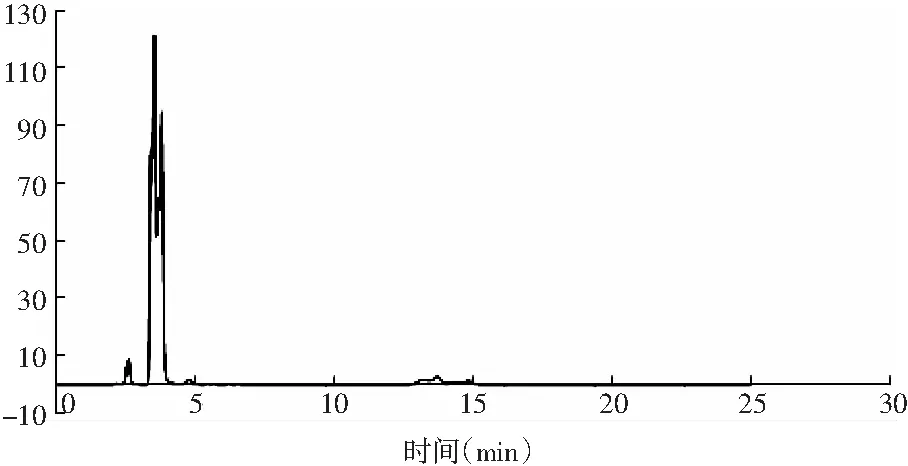
圖4 ZORBAX Eclipse XDB-C18 色譜峰圖Fig.4 The chromatogram of ZORBAX Eclipse XDB-C18注:鳥苷酸二鈉、肌苷酸二鈉、肌苷、鳥苷分不開。
更換色譜柱Polaris 5 C18-A(250 mm×4.6 mm),色譜柱耐高水相,已使用2000針左右,測定核苷酸峰圖依然正常,峰形好,耐用,見圖5。
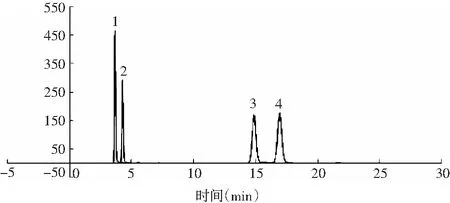
圖5 Polaris 5 C18-A 色譜峰圖Fig.5 The chromatogram of Polaris 5 C18-A注:1為鳥苷酸二鈉,2為肌苷酸二鈉,3為肌苷,4為鳥苷。
2.3.2 檢測波長的選擇
采用紫外分光光度計,在波長190~400 nm范圍內,對肌苷、鳥苷、肌苷酸、鳥苷酸進行掃描,最終判定檢測波長為254 nm。
2.3.3 稀釋倍數的選擇
將酶解液稀釋10,25,50,100倍上機測定,由于標準曲線中間點為500 mg/L,酶解反應產物肌苷酸二鈉稀釋濃度在曲線中間點,最終判定稀釋倍數為25倍,無論酶液質量如何,產物均在標準曲線范圍內。
2.3.4 線性及檢出限
將肌苷酸二鈉標準品配成不同濃度0,0.1,0.2,0.4,0.6,0.8,1.0 g/L,采用此色譜條件進行色譜分離測定。結果表明:曲線為y=4237.5x-0.6885,相關線性R2=0.9999,可以看出此方法測定肌苷酸二鈉具有較好的線性相關性,見圖6,最小檢出限為0.4 mg/L。
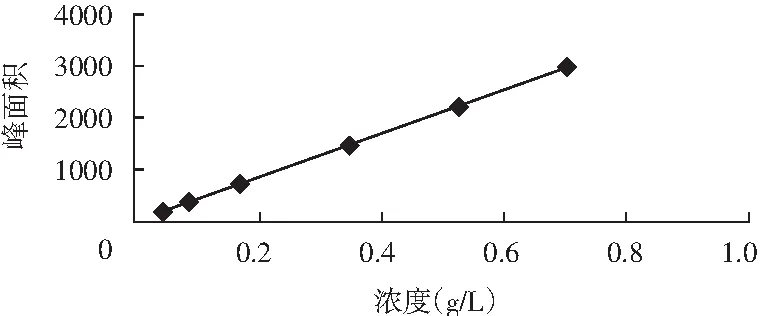
圖6 標準曲線圖Fig.6 The standard curve
2.3.5 精密度
取5組酶解液,每組連續進樣10次,測定IMP含量。結果表明:RSD在0.5%以內,說明此方法測定IMP具有較高的精密度,具體結果見表5。
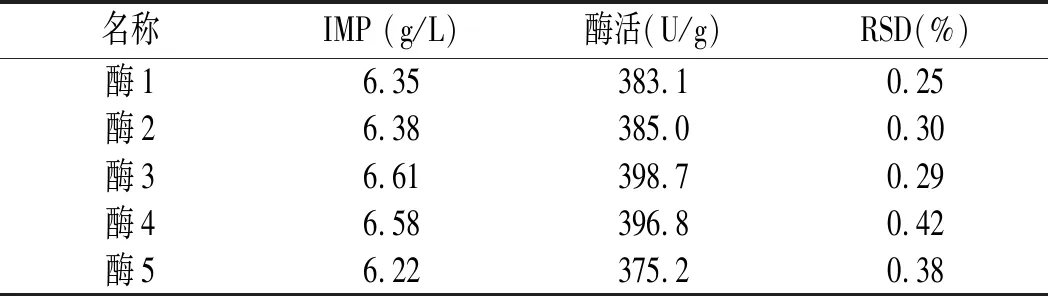
表5 精密度實驗結果Table 5 The results of precision test
2.3.6 加標回收率及準確度
取5組酶解反應終止的稀釋液各0.5 mL,分別向其中加入0.5 g/L的IMP標準溶液0.5 mL,混勻上機檢測IMP含量,同時測定加標前樣液的IMP含量及0.5 g/L的IMP標準品含量,并計算酶活。結果表明:加標回收率在99.6%~100%之間,0.5 g/L標準品測定結果為0.5001 g/L。結果顯示:此方法具有較高的加標回收率及準確度,能準確地測定肌苷酸二鈉含量,具體結果見表6。
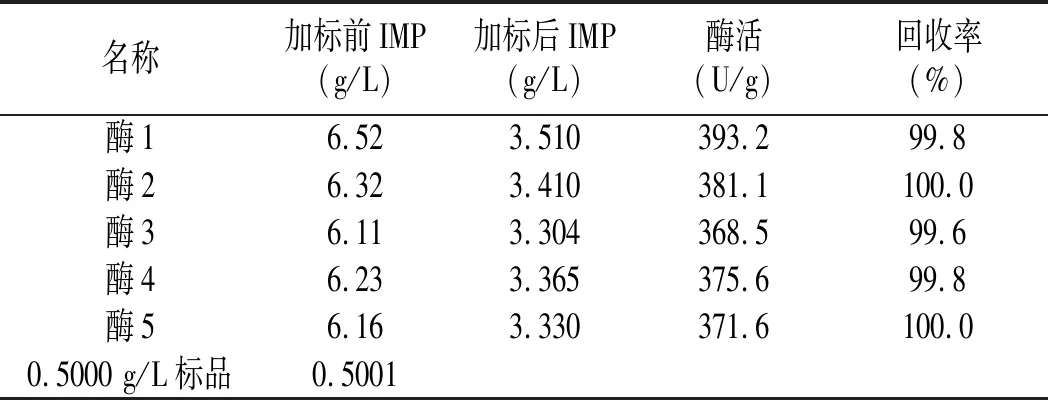
表6 加標回收率及準確度實驗結果Table 6 The results of recovery rates and accuracy test
3 結論
核苷磷酸化酶可與肌苷、鳥苷作用生成IMP、GMP,但反應后期出現逆反應,生成的產物能轉化為底物肌苷、鳥苷。工藝控制時,酶的添加量及反應時間的控制非常重要,加酶量少,反應不徹底;加酶量大,產生逆反應,終點判定至關重要。通過上述實驗得出最佳酶反應條件:溫度35 ℃,pH 4.50,加酶量0.5 mL,反應時間10 min,底物濃度10 g/L,菌體濃度100 g/L(10 g/L三聚磷酸鈉溶解菌體),最優液相色譜方法,采用Polaris 5 C18-A (250 mm×4.6 mm)色譜柱,以0.02 mol/L磷酸二氫鉀∶乙腈為99.5∶0.5(V/V)為流動相,1 mL/min等度洗脫,紫外檢測器(λ=254 nm),進樣量2 μL。此方法測定結果準確,回收率>99.5%,重復性好,RSD<0.5%,是一種有效測定磷酸化酶活力的檢測方法。核苷磷酸化酶酶活力檢測方法的建立解決了酶磷酸化工藝制取鮮味劑終點判定問題,能準確地判定酶液產品質量,應用于生產,可創造更高價值。

