血清HMGB1、LTBP2、AGE/RAGEs水平與特發性肺纖維化患者肺功能及預后的關系
丁麗麗,蔡暖暖,陳麗瑾,吳海洪,謝甜
特發性肺纖維化(idiopathic pulmonary fibrosis,IPF)是一種不明原因導致的進行性肺間質纖維化疾病,病理特征以彌漫性肺細胞炎、肺泡結構紊亂為主,患者肺功能呈限制性通氣功能障礙,氣體交換下降,臨床缺乏有效的救治手段,預后極差,病死率高,多數患者確診后2~5年內死亡[1]。了解與IPF預后相關指標有助于早期預測患者預后,改進治療措施。高遷移率族蛋白B1(high mobility group protein B1,HMGB1)是人體重要的促炎細胞因子,近期研究顯示,HMGB1異常激活與肺纖維化發病機制有關[2]。潛在轉化生長因子結合蛋白2(latent transforming growth factor β-binding protein-2,LTBP2)是一種細胞外基質糖蛋白,在胚胎發生、修復動脈損傷、細胞黏附及彈性纖維凝聚等過程中發揮重要作用,被認為是纖維化失調相關基因蛋白[3]。晚期糖基化終末產物(advanced glycation end product,AGE)通過促使細胞外基質分泌,致纖維化相關細胞因子表達,參與多種組織纖維化過程,AGE及其受體(RAGEs)參與肺纖維化進程[4]。現分析IPF患者血清HMGB1、LTBP2、AGE/RAGEs與肺功能和預后的關系,旨在為臨床診治提供參考,報道如下。
1 資料與方法
1.1 臨床資料 選取2017年5月—2018年3月海南省人民醫院呼吸與危重癥醫學科收治IPF患者102例(IPF組),男62例,女40例,年齡57~73 (64.51±5.57)歲;病程6~25 (15.41±2.81)個月;合并呼吸衰竭21例;體質量指數(BMI)20.41~28.12 (24.84±3.01)kg/m2;吸煙史46例,飲酒史38例;改良版英國醫學研究會呼吸困難量表(MMRC)分級[5]:2級38例,3級41例,4級23例;有IPF家族史19例;均無明顯誘因。另選擇門診體檢健康者93例為健康對照組,均排除肺部感染、全身系統性疾病,男43例,女50例,年齡57~75 (64.68±5.43)歲;BMI 20.76~27.83 (24.06±2.97)kg/m2;吸煙史21例,飲酒史28例。2組受試者年齡、BMI、飲酒史比例比較差異無統計學意義(P>0.05),IPF組男性、吸煙史比例高于健康對照組(P<0.05)。本研究獲得醫院倫理委員會批準,受試者或其直系親屬均知曉本研究目的及內容并簽署同意書。
1.2 病例選擇標準 (1)納入標準:①符合“特發性肺纖維化診斷和治療中國專家共識”診斷標準[6];②首次確診IPF;③無肺部外傷史、結核史。(2)排除標準:①合并支氣管擴張、肺部感染、肺氣腫、肺癌者;②合并其他系統嚴重功能障礙;③IPF急性加重;④不配合隨訪,失訪者。
1.3 觀測指標與方法
1.3.1 血清HMGB1、LTBP2、AGE、RAGEs檢測:IPF患者入院24 h內、健康對照組體檢當日采集空腹肘靜脈血3~5 ml,TDZ4-WS低速自動平衡離心機(長沙湘智離心機儀器有限公司)離心取血清保存于-80℃超低溫冰箱(Thermo Fisher公司)。采用意大利BIOBASE2000型全自動酶免分析儀,以酶聯免疫吸附試驗檢測血清HMGB1、LTBP2、AGE、RAGEs 水平,試劑盒購自美國Epitope Diagnostics公司,計算AGE/RAGEs比值。
1.3.2 肺功能指標檢測:以Master Screen肺功能儀檢測第1秒用力呼氣容積(FEV1)和用力肺活量(FVC),計算FEV1/FVC、FEV1占預計值百分數(FEV1%pred),1 min最大自主通氣量(MVV)、最大自主通氣量占預計值百分比(MVV%pred)、肺一氧化碳彌散量(DLco),上述指標測量3次,取最大值。
1.3.3 預后情況:所有IPF患者均采用電話或微信隨訪,隨訪至2020年3月,確診時間為起點,隨訪截止時間為終點。統計隨訪期間IPF急性加重、肺并發癥(肺動脈高壓、肺氣腫、呼吸衰竭等)、死亡事件發生情況,發生以上情況患者歸為預后不良亞組,未發生者歸為預后良好亞組。
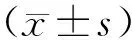
2 結 果
2.1 2組血清HMGB1、LTBP2、AGE、RAGEs、AGE/RAGEs水平比較 IPF組血清HMGB1、LTBP2、AGE、AGE/RAGEs比值高于健康對照組(P<0.01),RAGEs低于健康對照組(P<0.01),見表1。
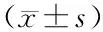
表1 2組受試者血清HMGB1、LTBP2、AGE、RAGEs、AGE/RAGEs水平比較
2.2 2組肺功能指標比較 IPF組FEV1、FEV1/FVC、FEV1%pred、MVV、MVV%pred、DLco低于健康對照組(P<0.01),見表2。
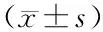
表2 2組受試者肺功能指標比較
2.3 IPF患者2亞組血清HMGB1、LTBP2、AGE、RAGEs、AGE/RAGEs水平比較 截止末次隨訪,IPF患者發生IPF急性加重18例,肺動脈高壓12例,肺氣腫15例,呼吸衰竭3例,死亡2例。預后不良亞組血清HMGB1、LTBP2、AGE、AGE/RAGEs比值高于預后良好亞組(P<0.05),RAGEs低于預后良好亞組(P<0.01),見表3。
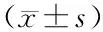
表3 2亞組患者血清HMGB1、LTBP2、AGE、RAGEs、AGE/RAGEs水平比較
2.4 IPF患者血清HMGB1、LTBP2、AGE/RAGEs 水平與肺功能相關性 IPF患者血清HMGB1、LTBP2、AGE/RAGEs水平與FEV1、FEV1/FVC、FEV1%pred、MVV、MVV%pred、DLco呈負相關(P<0.05),見表4。

表4 IPF患者血清HMGB1、LTBP2、AGE/RAGEs水平與肺功能相關性
2.5 血清HMGB1、LTBP2、AGE/RAGEs預測IPF預后的效能 ROC分析血清HMGB1、LTBP2、AGE/RAGEs預測IPF預后的曲線下面積(AUC)分別為0.744(95%CI0.576~0.960)、0.706(95%CI0.547~0.911)、0.691(95%CI0.490~0.975),聯合血清HMGB1、LTBP2、AGE/RAGEs可提高對IPF預后的預測效能,AUC為0.802(95%CI0.664~0.969),大于血清HMGB1、LTBP2、AGE/RAGEs單獨預測,見圖1。血清HMGB1、LTBP2、AGE/RAGEs預測IPF預后的Cut-off值、AUC、敏感度、特異度、陽性預測值、陰性預測值見表5。

表5 血清HMGB1、LTBP2、AGE/RAGEs預測IPF預后的效能

圖1 HMGB1、LTBP2、AGE/RAGEs預測IPF預后的ROC分析
3 討 論
IPF是一種慢性、進行性、纖維化性肺部疾病,全球范圍約300萬IPF患者,發病率隨年齡升高顯著增加[7]。由于肺正常組織被細胞外基質取代,肺泡結構破壞,肺順應性下降,氣體交換中斷,患者可逐漸出現呼吸衰竭和死亡[8-10]。IPF病因和發病機制尚不清楚,目前公認的機制包括反復的肺泡上皮損傷,轉換生長因子(transforming growth factor,TGF)、血小板衍化生長因子、堿性成纖維細胞生長因子等促纖維化細胞因子的調節,成纖維細胞活化和增殖,成纖維細胞向肌成纖維細胞分化,導致細胞外基質蛋白過量產生,發生異常纖維化。與肺纖維化相關的分子生物標志物可能反映疾病活動度,有望為IPF早期診斷、預后評估、個性化治療提供參考[11-12]。目前缺乏IPF預后評估的有效方法和指標,肺部CT在IPF診斷中具有一定價值,但無法早期發現IPF微小病變,對預后評估價值不大,血清學指標無創,可重復檢測,在IPF預后評估中頗具前景。
HMGB1是一種DNA結合蛋白,通過與DNA結合發揮調節基因轉錄、穩定細胞結構等生理功能,當細胞損傷時炎性介質被激活,HMGB1通過活化主動分泌或壞死細胞被動釋放形式從細胞核中進入外周血循環,發揮刺激炎性反應、趨化、調節免疫應答、代謝等功能[13-15]。Chirico等[16]報道,血清HMGB1水平在肺纖維化患者中明顯升高,并且HMGB1水平越高,肺功能下降越快。本研究結果表明,IPF患者血清HMGB1水平顯著升高,而肺通氣和彌散功能指標降低,說明血清HMGB1水平能夠反映IPF肺功能實質損害進展。本研究通過隨訪發現,IPF預后不良者血清HMGB1水平高于預后良好者,提示HMGB1可作為IPF預后評估的潛在生物學指標。HMGB1參與IPF的機制可能為:HMGB1通過與晚期糖基化終產物受體、Toll樣受體結合激活核因子-κB通路,誘導氧化應激反應,加劇炎性反應,介導肺損傷過程[17]。動物研究顯示,敲除HMGB1后,致纖維化因子TGF誘導的小鼠肺纖維化模型平滑肌肌動蛋白、Ⅰ型膠原蛋白表達受到抑制,HMGB1表達受miR-627調控,miR-627通過與HMGB1的3′未翻譯區結合抑制HMGB1表達,miR-627/ HMGB1/ NF-κB/TGF-β1信號通路參與肺纖維化進程[18]。
LTBP2 是TGF小分子結合蛋白,在肺、皮膚和大血管中表達,作為TGF-β潛在復合物在細胞黏附、損傷修復、彈性纖維凝聚等病理生理過程中發揮重要作用,參與多個器官纖維化或組織重塑[19]。LTBP2在肺纖維化中的作用機制尚不明確,本研究發現,IPF患者血清LTBP2水平升高,LTBP2與肺通氣和彌散功能指標呈負相關,說明LTBP2表達與IPF肺功能惡性進展有關。Enomoto 等[20]報道顯示,肺纖維化組織中LTBP2表達上調,IPF急性加重時增生間質平滑肌細胞和非成纖維細胞灶肌纖維母細胞LTBP2表達進一步升高,LTBP2與IPF患者FVC呈負相關,可預測IPF患者呼吸事件相關死亡風險。本研究發現,LTBP2在IPF不同預后患者中差異顯著,說明LTBP2可作為IPF患者預后的預測因子。一項體外研究顯示,LTBP2通過與纖顫蛋白1結合與LTBP1競爭,間接參與了促纖維化生長因子的存儲和激活[21]。LTBP2可直接上調TGF- 271表達,誘導成纖維細胞增殖,成纖維細胞與纖維連接蛋白黏附,導致肺纖維化[22]。提示LTBP2可作為IPF持續纖維化和急性加重的風險指標。
RAGE是一種免疫球蛋白超家族蛋白,在肺組織中高表達,通過細胞外基質(extracellular matrix,ECM)跨膜區直接分泌到ECM,參與維持肺泡結構、Ⅰ型肺泡細胞的生存發育和分化。AGE是還原糖單糖與蛋白游離氨基非酶反應的產物,通過作用于細胞和ECM蛋白交聯信號通路促使創面異常愈合,改變膠原纖維理化性質和組織硬度[23]。RAGE與AGE結合后阻斷AGE細胞信號通路,減弱RAGE作用,AGE/RAGE信號通路參與上皮間質轉化過程[24]。本研究結果顯示,IPF患者中存在AGE/RAGEs失衡,AGE水平升高,RAGEs降低,提示RAGE作用受到抑制。本研究結果表明,AGE/RAGEs與肺功能同樣存在顯著相關性,AGE/RAGEs過度增高可能導致IPF持續肺纖維化和肺功能下降進程。RAGE可阻斷TGF-β誘導的Smad2、ERK和JNK信號激活,抑制上皮—間質轉化進程[4],提示RAGE表達缺失可能介導上皮—間質轉化過程,導致纖維化。HMGB1作為RAGE配體,通過激活磷酸化的絲分裂原活化蛋白激酶1/2、磷酸化的胞外信號調節激酶1/2和pc-Jun信號通路,刺激肝臟星狀細胞遷移,通過RAGE信號上調Ⅰ型膠原表達和沉積,促使肝纖維化進程[25]。各種病理生理條件下肺組織RAGE及其配體AGE、HMGB1相互作用,介導了炎性反應和氧化應激反應,導致了IPF、急性肺損傷、囊性纖維化的發生[26]。
ROC分析結果顯示,血清HMGB1、LTBP2、AGE/RAGEs預測IPF患者預后均具有一定價值,聯合3項指標可提高預測準確性,其預測的敏感度和特異度均較高,提示三者聯合檢測可以較為準確地評估IPF患者預后。
綜上,IPF患者血清HMGB1、LTBP2、AGE/RAGEs水平升高,高HMGB1、LTBP2、AGE/RAGEs水平與IPF患者肺功能低下有關。血清HMGB1、LTBP2、AGE/RAGEs持續升高可能導致IPF病情進展,可為IPF患者預后評估提供參考。
利益沖突:所有作者聲明無利益沖突
作者貢獻聲明
丁麗麗:設計研究方案,實施研究過程,論文撰寫;蔡暖暖、陳麗瑾:實施研究過程,資料搜集整理,論文修改;吳海洪:提出研究思路,分析試驗數據,論文審核;謝甜:進行統計學分析

