超聲波輔助酶解法提取北蟲草菌素及其降血糖活性研究
符群,鄶濱,鐘明旭,吳小杰
1(東北林業大學 林學院,黑龍江 哈爾濱,150040)2(黑龍江省森林食品資源利用重點實驗室(東北林業大學),黑龍江 哈爾濱,150040)
北蟲草(Cordycepsmilitaris,Link)又名北冬蟲夏草、蛹蟲草,與冬蟲夏草屬于同屬真菌,是一種常見的藥食同源真菌[1]。北蟲草營養豐富,與冬蟲夏草的化學成分與藥用功能相似[2],特別是蟲草素含量是野生冬蟲夏草的數倍。冬蟲夏草培養條件復雜,價格高昂,無法實現商業化培育,而北蟲草人工培養技術成熟,現已實現人工大規模生產,因此,北蟲草作為冬蟲夏草替代品的研究開發具有重要現實意義[3-4]。蟲草素即3’-脫氧腺苷(3’-deoxyadenosine),是一種核苷類似物[5],也是北蟲草中重要的活性成分,具有抗菌、抗腫瘤、調節免疫、降血糖等多種藥理作用,及治療代謝紊亂、氧化損傷等多種疾病的潛能[6-8]。
胰島素抵抗(insulin resistance,IR)是指某些因素誘使胰島素促進葡萄糖攝取和利用率降低,使機體大量分泌胰島素以維持血糖的穩定,從而產生高胰島素血癥。目前認為,IR產生的主要部位是肝臟及外周組織,可誘發多種代謝相關疾病,更是Ⅱ型糖尿病的發病基礎[9]。HepG2細胞是一種表型與肝細胞極為相似的肝胚胎瘤細胞株,胰島素水平和刺激持續的時間與HepG2細胞表面胰島素受體數目有關,因此構建胰島素抵抗HepG2細胞模型是對IR相關疾病研究的重要途徑[10]。
近年來,隨著分離技術水平的提高,國內外學者對北蟲草菌素的研究漸多[11],蟲草素的提取目前多采用單一的方式,如熱回流法、超高壓法、超聲提取法、微波提取法等[12-15],其提取效率偏低,能耗大且費時。而對于北蟲草中降糖活性成分的研究主要集中在蟲草多糖,蟲草素的降糖作用少有報道。與其他研究文獻提取蟲草素方法不同,本研究采用超聲-酶解聯合法提取,纖維素酶可去除部分初生胞壁和表面雜質,降解胞間鏈接物,使胞內物質溶出[16],聯合超聲波特有的空化作用、機械效應及熱效應可加快提取物的溶解[17-19]。建立IR模型,考察蟲草素對胰島素抵抗HepG2細胞葡萄糖消耗量的影響,以評價其降血糖活性,為北蟲草資源的深入研究及產業化推進提供參考,對治療糖尿病藥物的研發具有探索意義。
1 材料與方法
1.1 材料與儀器
北蟲草花,沈陽新民市種植基地,2019年;人肝癌細胞系(HepG2),中科院上海細胞庫提供。
試劑:蟲草素標品(≥98%),上海源葉生物科技有限公司;纖維素酶(≥100 U/mg),上海藍季生物有限公司;甲醇(色譜純),天津星馬克科技發展有限公司;牛胰島素、DMEM培養基(含雙抗)、胎牛血清、胰蛋白酶,美國Solarbio公司;噻唑蘭(thiazolyl blue tetrazolium bromide,MTT),美國Amresco公司;二甲基亞砜(dimethyl sulfoxide,DMSO),美國Sigma公司;葡萄糖測定試劑盒,南京建成生物公司。
儀器:AL—1041C分析天平,METTLER TOLEDO公司;1260 Infinity I液相色譜儀,美國安捷倫科技有限公司;JY96-IIN超聲波破碎儀,寧波新芝生物科技股份有限公司;EPOCH12酶標分析儀,BioTek Instruments,Inc.;CKX41倒置顯微鏡,OLYMPUS;T6紫外可見分光光度計,北京普析通用儀器有限責任公司。
1.2 實驗方法
1.2.1 蟲草素標準曲線的繪制
準確稱取2.00 mg蟲草素標準品于10 mL容量瓶中,超純水定容至刻度,搖勻,配制質量濃度為0.2 g/L的蟲草素標準品儲備液。分別量取1、2、4、6、8 mL儲備液于10 mL容量瓶中,超純水定容至刻度,搖勻,0.22 μm微孔濾膜過濾,得到質量濃度為0.02、0.04、0.06、0.08、0.10 g/L的蟲草素標準液。
色譜柱Kromasil C18(4.6 mm ×150 mm,3 μm);柱溫:35 ℃;檢測器:紫外檢測器;檢測波長:260 nm;流動相:V(甲醇)∶V(水)=15∶85,等度洗脫;進樣量:10 μL;流速:1 mL/min。
在此條件下,取上述不同質量濃度蟲草素標準液進行測定。以蟲草素標準溶液質量濃度(g/L)為橫坐標(X),峰面積為縱坐標(Y),繪制標準曲線,得到線性回歸方程:Y=25.415X+0.662 7,R2=0.999 1,結果表明,蟲草素標準溶液質量濃度在0.02~0.10 g/L范圍內與峰面積呈良好線性關系。
1.2.2 蟲草素含量測定及得率計算
準確量取適量北蟲草提取液,過0.22 μm微孔濾膜,按照1.2.1小節中高效液相色譜(high performance liquid chromatography,HPLC)方法檢測,峰面積帶入線性回歸方程,求出樣品溶液中蟲草素質量濃度,按公式(1)計算蟲草素得率:
(1)
式中:ω,蟲草素得率,mg/g;ρ,提取液的質量濃度,g/L;V,提取液的體積,mL;m,北蟲草的質量,g。
1.2.3 超聲波輔助酶解法優化試驗
北蟲草花去雜,50 ℃烘干,粉碎后過100目篩,稱取2.00 g北蟲草花粉末于三角瓶中,分別加入40 mL檸檬酸-檸檬酸鈉緩沖液。在前期預實驗基礎上,選取對提取得率影響顯著的因素進行單因素試驗,固定料液比為1∶20(g∶mL),超聲功率為400 W。分別選取pH值(4.0、4.5、5.0、5.5、6.0)、纖維素酶添加量(1.0%、1.5%、2.0%、2.5%、3.0%,質量分數)、酶解時間(30、45、60、75、90 min)、超聲溫度(30、40、50、60、70 ℃)進行提取,每個因素水平條件平行3次,滅酶活力后減壓抽濾,得到北蟲草提取液,優選各因素最優水平。在單因素試驗的基礎上,采用中心組合Box-Behnken Design優化設計方案,建立回歸模型,得到最佳蟲草素提取工藝。
蟲草素提取物經D101大孔樹脂純化后收集洗脫液,洗脫液經真空濃縮凍干后備用,采用HPLC法按照1.2.1小節色譜條件對蟲草素進行純度鑒定。
1.3 蟲草素對HepG2細胞胰島素抵抗的改善作用
1.3.1 細胞培養
用DMEM高糖培養基與胎牛血清以體積比為9∶1的比例配制的完全培養基,在37 ℃,體積分數5%CO2條件下培養第2代HepG2細胞,待細胞長滿培養瓶瓶底后,經胰蛋白酶消化制成單細胞懸液,細胞計數108個/mL,按1∶2傳代,取第5代細胞進行后續實驗[20]。
1.3.2 細胞活性測定
將HepG2細胞制成單細胞懸液,每孔按3×104個細胞接種于96孔細胞板內,待細胞完全貼壁后棄去培養液,PBS溶液清洗2次,分別加入含有0.01、0.05、0.10、0.50、1.00、1.50和2.50 g/L蟲草素提取物的培養液100 μL,同時設定空白對照組(正常培養細胞),每組5個復孔,于37 ℃培養24 h后,每孔加入10 μL 5 g/L MTT溶液,繼續培養4 h后,吸出上清液,每孔加入100 μL DMSO,使紫色甲瓚結晶充分溶解,采用酶標儀于490 nm處測定吸光值,按公式(2)計算細胞存活率,以確定安全給藥范圍:

(2)
1.3.3 IR模型的建立
將HepG2細胞制成單細胞懸液,每孔按3×104個細胞接種于96孔細胞板內,待細胞完全貼壁后棄去培養液,用PBS溶液清洗2次,分別加入新鮮配制含有102、10、1、10-1、10-2和10-3μmol/L的胰島素培養液100 μL,同時設定對照組(正常培養細胞)和空白組(不含細胞只含培養液),分別培養12、24、36、48 h,每組5個復孔,依據葡萄糖測定試劑盒的說明測定各組細胞上清液中葡萄糖的含量,按公式(3)計算葡萄糖消耗量[21]:
葡萄糖消耗量/(mmol·L-1)=空白組葡萄糖含量-樣品組葡萄糖含量
(3)
1.3.4 蟲草素對IR-HepG2細胞葡萄糖消耗量及細胞活性的影響
采用1.3.3小節中建立的IR模型作為模型組,同時設定空白對照組(正常培養細胞)、樣品組(0.01、0.05、0.10、0.50、0.75 g/L蟲草素)、陽性對照組(0.05 g/L二甲雙胍),每組5個復孔,分別培養12、24、36 h,測定蟲草素干預后不同時間各組IR-HepG2細胞上清液中葡萄糖的含量,計算各組細胞存活率及葡萄糖消耗量,評價蟲草素改善胰島素抵抗能力。
1.4 統計學分析
2 結果與分析
2.1 單因素提取工藝實驗結果
由圖1可知,纖維素酶最適pH值為5.5;當酶添加量為1.5%(質量分數)時,蟲草素得率達到最大值,底物得到最大程度分解;隨著酶解時間的延長,蟲草菌素溶出量逐漸增加,當酶解時間達到60 min時,得率為初始條件下的1.13倍,而后蟲草素得率開始下降,分析原因可能是長時間的超聲波效應聯合酶解作用,有效促進提取的同時,也使北蟲草細胞中可溶物與不溶物進入提取液,影響蟲草素的溶出,因此,超聲時間選擇60 min;隨著超聲溫度的升高,分子運動逐漸加快,蟲草素溶出更徹底,但長時間的高溫可能導致纖維素酶失活,或蟲草素結構被部分破壞,因此,超聲溫度選擇50 ℃。

a-pH值及酶添加量對蟲草素得率的影響;b-酶解時間及超聲溫度對蟲草素得率的影響圖1 各因素對蟲草素得率的影響Fig.1 Effects of various factors on the yield of cordycepin注:不同字母表示差異顯著(P<0.05)(下同)
2.2 響應面分析優化工藝
2.2.1 響應面設計及結果分析
根據單因素試驗結果,運用Design-Expert 8.0.6軟件程序根據Box-Behnken中心組合試驗設計原理,以蟲草素得率為響應值,設計pH值(A),酶添加量(B),酶解時間(C),超聲溫度(D)四因素三水平試驗,試驗設計水平與結果見表1。
利用Design-Expert軟件進行優化,pH值(A)、酶添加量(B)、酶解時間(C)、超聲溫度(D)二次多項式回歸擬合,得到蟲草素得率對4個因素的回歸方程為:
Y=8.15-0.094A+0.024B+0.075C+0.18D+0.11AB+0.081AC+0.079AD+0.10BC+0.011BD-0.12CD-0.28A2-0.20B2-0.21C2-0.20D2
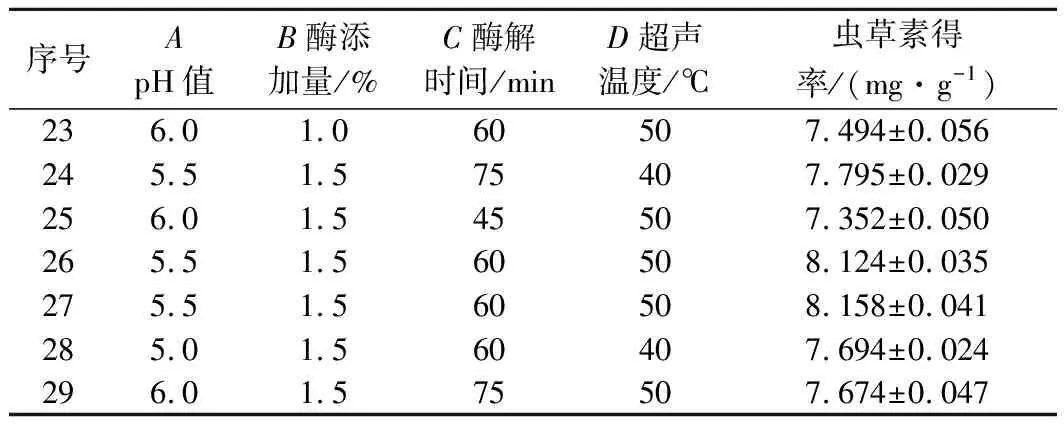
續表1
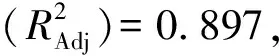
2.2.2 響應面和等高曲線分析圖
由圖2可知,pH值和酶解時間、pH值和超聲溫度、酶添加量和超聲溫度的等高線較密集,響應面坡度較陡峭,說明交互作用顯著,與方差分析的結果基本吻合。

表2 回歸模型方差分析Table 2 Analysis of variance in regression model
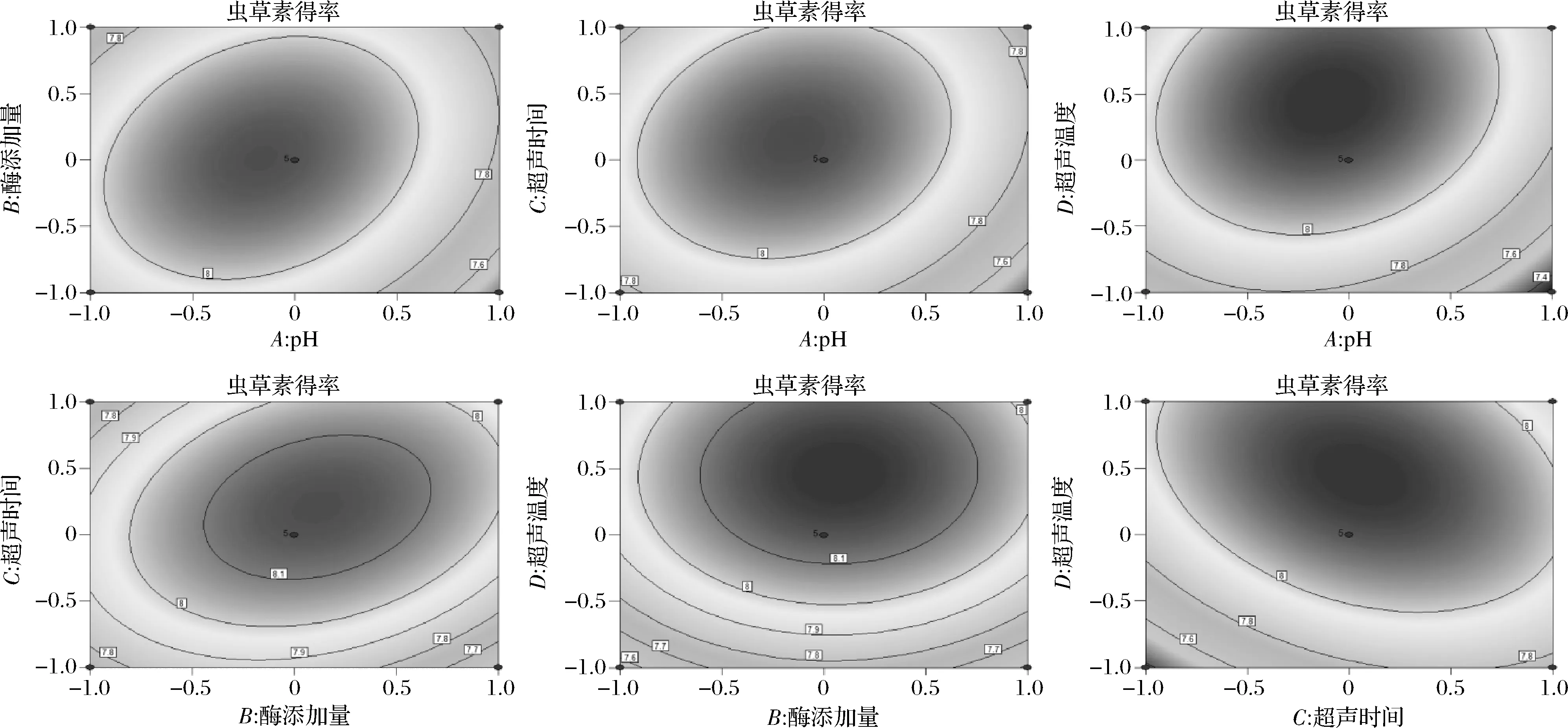
圖2 各因素交互作用對蟲草素得率影響的等高線圖Fig.2 Contour map of the influence of interaction of various factors on the yield of cordycepin
2.3 最佳條件確定和回歸模型驗證試驗結果
通過響應面分析得到超聲波輔助酶解法提取北蟲草菌素最佳工藝條件為:pH值為5.31,酶添加量質量分數為1.56%,酶解時間為60.03 min,超聲波功率400 W,超聲波溫度為54.4 ℃。在此條件下蟲草素得率為(8.192±0.033)mg/g。
為更便于產業化控制,調整最佳工藝為:pH值為5.30,酶添加量質量分數為1.60%,酶解時間為60 min,超聲功率為400 W,超聲溫度為55 ℃。在此條件下進行結果驗證,計算得出得率為(8.097±0.028)mg/g,與理論值接近。
2.4 對比不同提取方法的蟲草素得率
根據優化結果,分別使用單一酶解法,按照pH值5.30,纖維素酶酶添加量1.60%(質量分數),酶解時間60 min,酶解溫度55 ℃條件進行提取;單一超聲法按照超聲時間60 min,超聲溫度55 ℃,超聲功率400 W條件進行提取。實驗平行3次,計算2組蟲草素得率。結果如圖3所示,采用超聲波輔助酶解法提取蟲草素得率有顯著提升(P<0.01),較單一超聲法提高15.85%,較單一酶解法提高72.35%。不同提取方法提取蟲草素得率的大小為:超聲輔助酶解法>單一超聲法>單一酶解法。
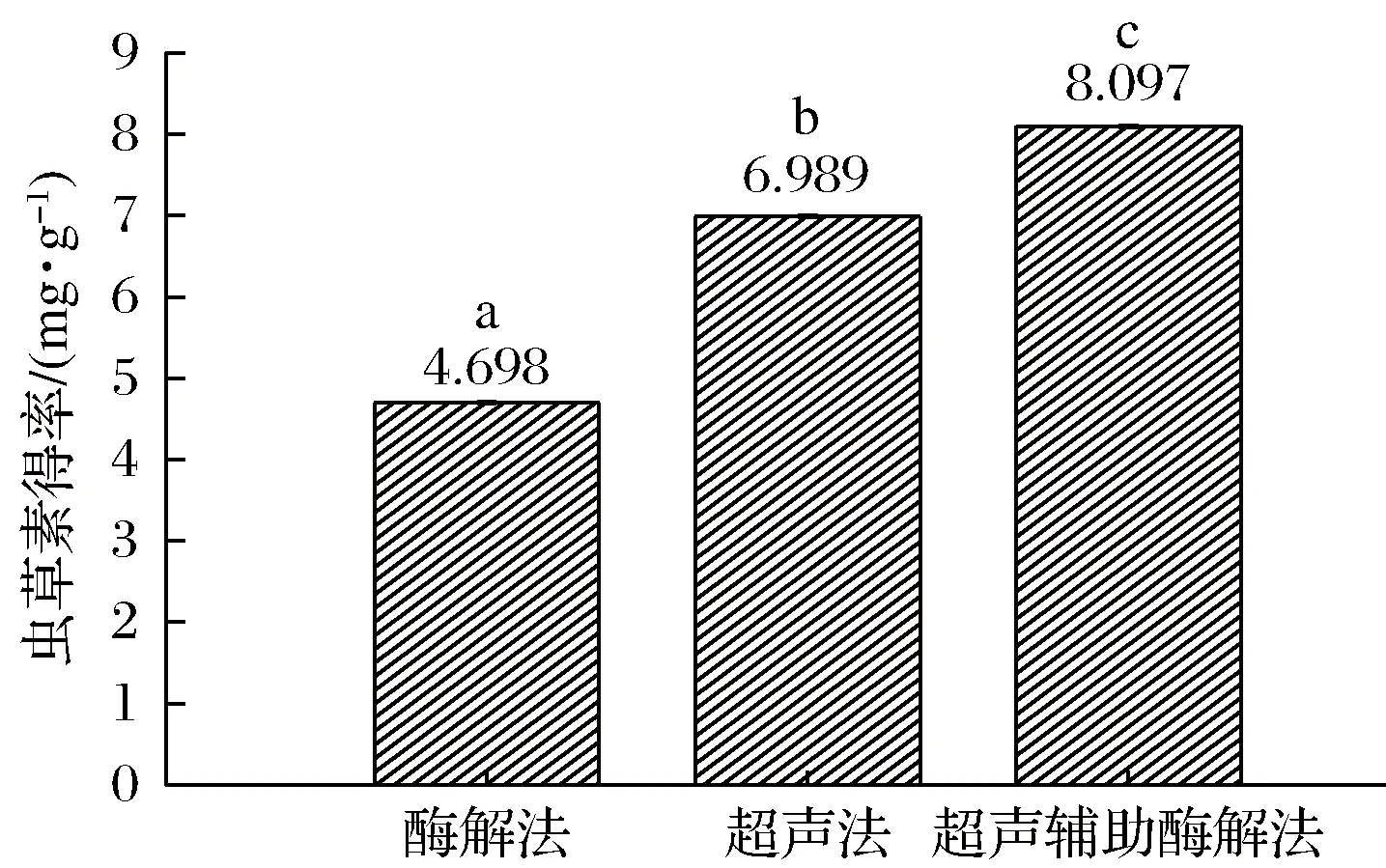
圖3 三種提取方式的蟲草素得率比較Fig.3 Comparison of cordycepin yield of three extraction methods
2.5 蟲草素純度鑒定
圖4為蟲草菌素及北蟲草提取物純化前后的HPLC圖。其中圖譜a顯示,蟲草素在當前液相色譜條件下,保留時間為8.02 min。圖譜b及圖譜c分別為相同條件下北蟲草提取物及純化物的HPLC譜,圖中蟲草素成分峰的峰型穩定,分離度高,與蟲草素標準品的保留時間基本一致。通過純化前后的兩圖對比可知,成分種類及構成無顯著變化,經面積歸一法計算,蟲草素的純度由(17.80±1.12)%提高至(34.89±1.09)%。
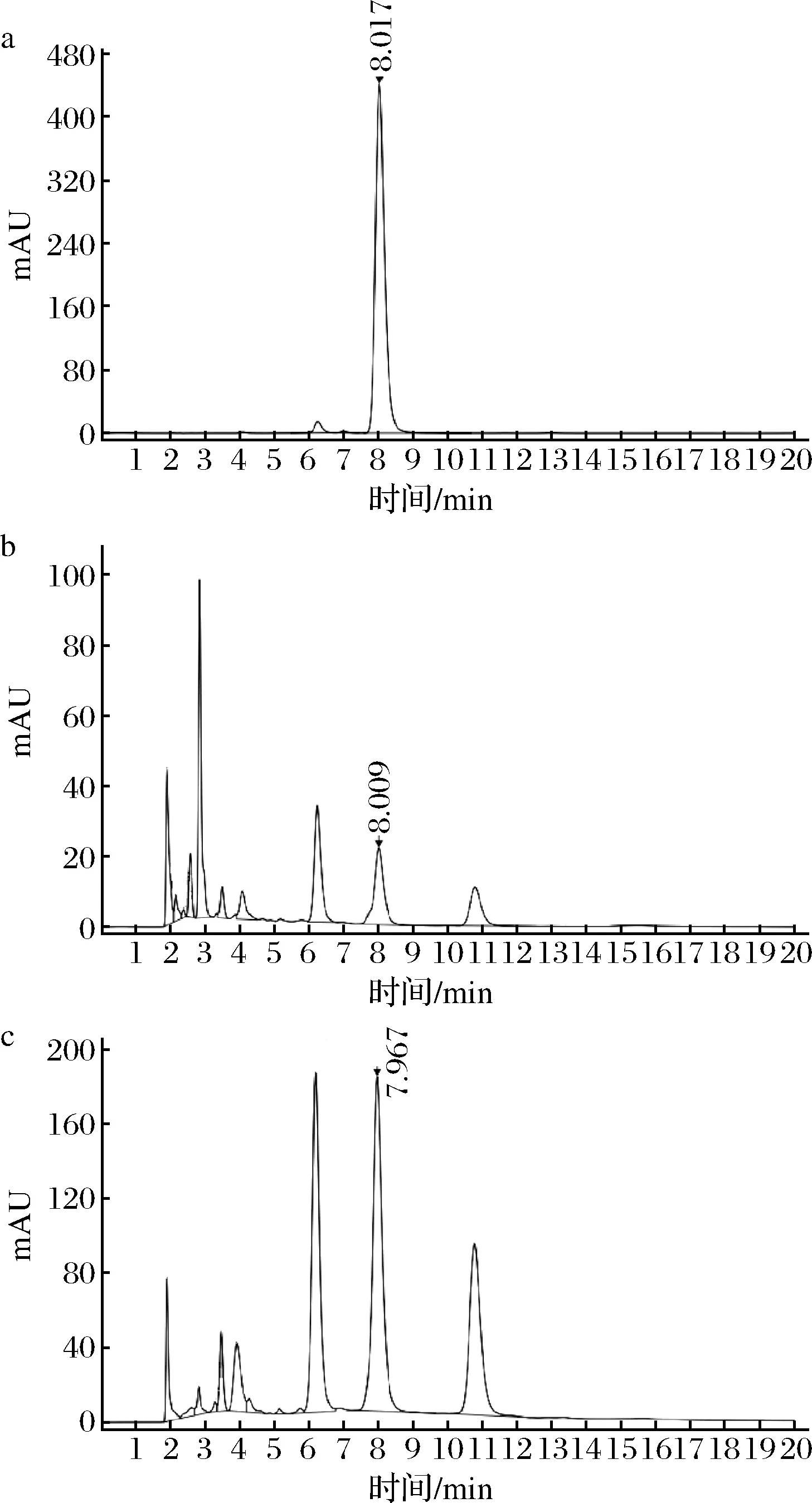
a-蟲草素標準品;b-北蟲草提取物;c-北蟲草純化物圖4 北蟲草提取物純化前后對比的HPLC圖譜Fig.4 Comparison of HPLC profiles of Cordyceps militaris extract before and after purification
2.6 蟲草素質量濃度對細胞活性的影響
由表3 可知,與空白對照組相比,當蟲草素質量濃度在0.01~0.50 g/L時,細胞存活率均大于80%,隨著蟲草素質量濃度的繼續增加,對細胞活性影響極顯著(P<0.01),當蟲草素質量濃度在0.75~2.50 g/L 時,細胞存活率開始驟降,當蟲草素質量濃度大于1.50 g/L時,細胞存活率均低于50 %,故低質量濃度的蟲草素對細胞生長繁殖基本無影響,因此選擇0.01~0.75 g/L蟲草素進行后續研究。
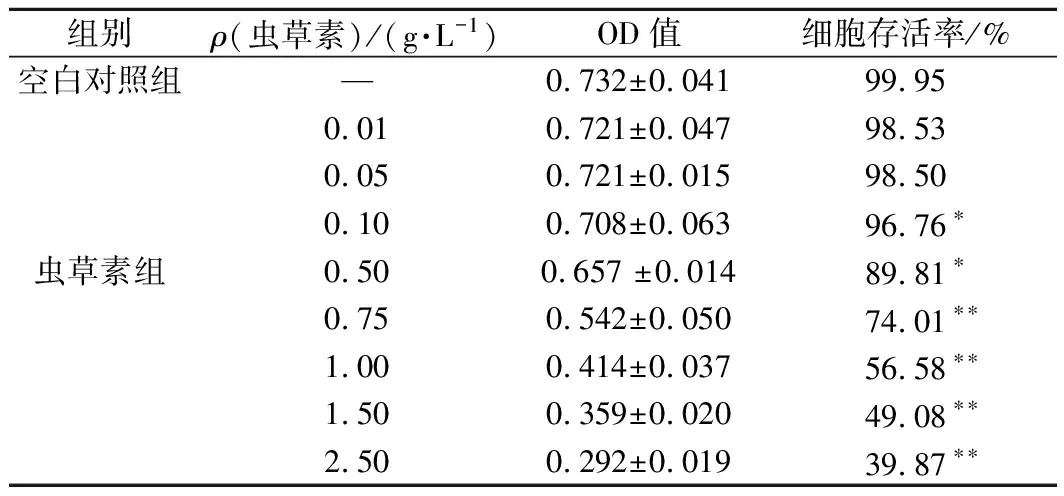
表3 蟲草素濃度對HepG2細胞活性的影響Table 3 Effect of cordycepin concentration on HepG2 cell survival rate
2.7 胰島素抵抗細胞模型(IR-HepG2)的建立
由圖5可知,胰島素濃度相同時,隨著誘導時間的延長,細胞葡萄糖消耗量逐漸增加,誘導時間為12 h時葡萄糖消耗量最低,48 h時葡萄糖消耗量最高。當胰島素濃度在10~100 μmol/L范圍時,誘導24、36 h,葡萄糖消耗量與空白對照組相比無顯著性差異,誘導12、48 h時,葡萄糖消耗量與空白對照組相比呈顯著上升趨勢(P<0.05)。當胰島素濃度為1.0 μmol/L時,不同誘導時間下的萄萄糖消耗量均為最低值,與相同誘導時間下的空白對照組相比均有顯著性差異(P<0.05)。隨著胰島素濃度的繼續降低,不同誘導時間下的葡萄糖消耗量整體呈大幅上升而后下降趨勢。分析原因可能是低濃度的胰島素對HepG2細胞的糖代謝有促進作用,無法誘導HepG2細胞產生胰島素抵抗,而高濃度的胰島素則可誘導HepG2細胞出現胰島素抵抗狀態,隨著胰島素作用于HepG2細胞時間的延長,細胞減少了對胰島素底物的降解作用,代謝葡萄糖能力下降,導致葡萄糖消耗量開始回升[22]。因此確定1.0 μmol/L胰島素誘導HepG2細胞12 h為最佳胰IR模型。

圖5 胰島素對HepG2細胞葡萄糖消耗量的影響Fig.5 Effects of the insulin to the glucose consumption of HepG2 cells
2.8 蟲草素對IR-HepG2細胞葡萄糖消耗量及細胞活性的影響
2.8.1 蟲草素對IR-HepG2細胞葡萄糖消耗量的影響
由圖6可知,模型組IR-HepG2細胞葡萄糖的消耗量明顯低于正常組細胞,模型組IR-HepG2細胞在加入不同質量濃度的蟲草素干預后,葡萄糖消耗能力均有一定程度的提高,說明對胰島素抵抗狀態有所改善。葡萄糖消耗量隨著蟲草素質量濃度的增加而增加,當蟲草素質量濃度超過0.25 g/L時,萄萄糖消耗量趨于平緩。藥物作用于細胞24 h時,葡萄糖消耗量整體最高。當蟲草素質量濃度在0.10~0.75 g/L范圍內時,葡萄糖消耗量顯著高于模型組(P<0.05),蟲草素質量濃度為0.25 g/L,作用24 h時葡萄糖消耗量最高為(4.554±0.008)mmol/L,消耗率可達 22.75%,可見蟲草素能夠改善胰島素抵抗狀態。
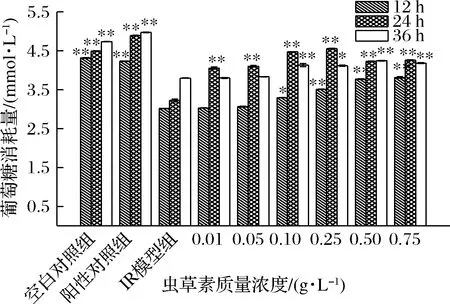
圖6 蟲草素對IR-HepG2細胞葡萄糖消耗量的影響Fig.6 Effects of cordycepin on glucose consumption of IR-HepG2 cells
2.8.2 蟲草素對IR-HepG2細胞活性的影響
由表4可得,蟲草素質量濃度在0.01~0.75 g/L 范圍內,隨質量濃度升高和培養時間的延長,細胞存活率降低。相同質量濃度下,培養24 h時,細胞活性最高,細胞存活率均大于80 %,說明蟲草素可保持IR-HepG2細胞活性,最佳作用時間為24 h。
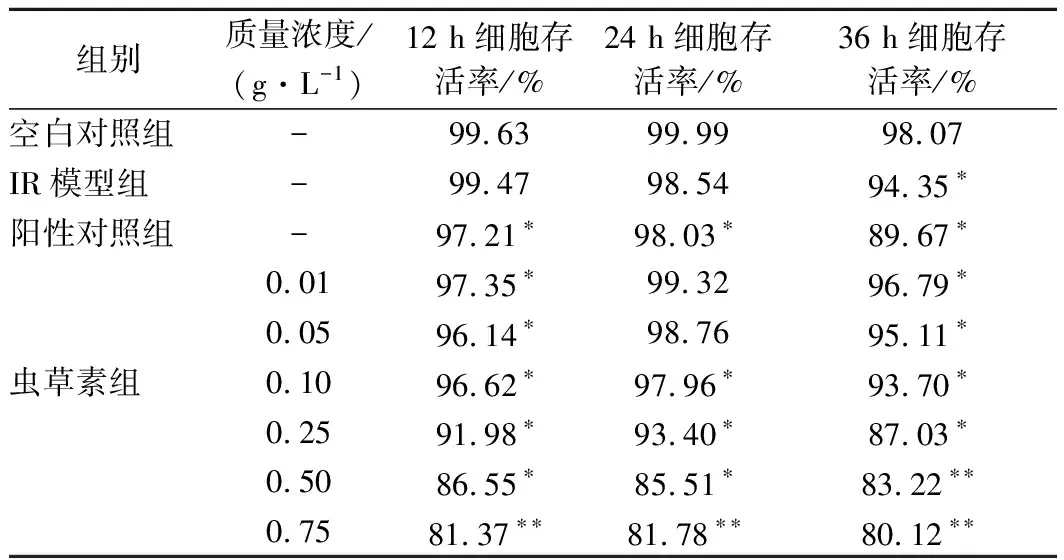
表4 蟲草素對IR-HepG2細胞的影響Table 4 Effect of cordycepin on IR-HepG2 cells survival rate
3 結論與討論
本研究采用超聲波輔助酶解法提取北蟲草菌素,得率可達到(8.097±0.028)mg/g,較單一超聲波法提高15.85%,較單一酶解法提高72.35%,與目前研究文獻的平均得率相比,提取得率具備顯著優勢。該法與傳統單一提取方法相比,高效,省時,溶劑對環境友好,設備常規,成本低,適宜產業化推廣。
胰島素抵抗為Ⅱ型糖尿病的主要發病機制之一,通過有效成分干預從而改善胰島素抵抗狀態,是治療Ⅱ型糖尿病的良好途徑之一。本研究表明,蟲草素質量濃度在0.25 g/L條件下,作用24 h時IR-HepG2細胞的葡萄糖消耗量最高為(4.554±0.008)mmol/L,消耗率可達 22.75%。與現有文獻中萜類、皂苷類、多肽類降血糖成分相比,蟲草素降糖效果明顯,作用溫和,無明顯的毒副作用,且原料資源豐富,開發成本低于冬蟲夏草、靈芝、松茸等其他食用菌。
研究結果顯示,超聲波輔助酶解法可高效提高蟲草素得率,且提取物可改善胰島素抵抗狀態,豐富了北蟲草研究領域,提高了天然產物的綜合利用率,對降糖藥物的探索和Ⅱ型糖尿病的治療提供參考,對蟲草屬植物產業鏈延長、高值化產品推廣應用具有指導意義。

