黃絲藻提取物及2 種微藻多糖的抑菌活性分析
劉 哲,張 莉,李潤植,崔紅利
(山西農業大學農學院,山西太谷030801)
自20 世紀40 年代以來,人們從海洋生物中發現許多抗細菌和抗真菌的物質,但是多數研究都集中在大型海藻,關于微藻抑菌活性的研究仍然較少[1]。與大型海藻相比,微藻培養條件、生物量、微藻種質純度等都能較好控制,微藻培養更易在實驗室進行,具有很強的潛在工業生產價值[2]。
常見的人工抗菌方式是噴施化學農藥和生物農藥,化學農藥殘留多,對土壤、河流和生物鏈中的生物會造成不可逆轉的危害。生物農藥多是利用生防菌物質做殺菌劑,成本高,易產生二次危害。已有研究表明,微藻提取物含有某些有效成分,具有一定的殺菌效果,可以直接用于抑制某些細菌和真菌的生長,亦可用作刺激物誘導植物產生對病原菌的抗性,增強植物抵抗病菌能力。例如,微藻體內的脂類、多糖類、酚類、萜類、含硫化合物、鹵化物等,對革蘭氏陽性菌、真菌具有良好的抑菌效果[3]。不同藻類的萃取物對不同菌的抑菌效果不同[4-6]。已有研究從常見的小球藻、螺旋藻、鹽藻[7]、藍藻[8]等具有抗污染、抗逆能力強、生長速度快等特性的微藻中篩選出抑菌物質[9]。
黃絲藻(Tribonemasp.)是一種絲狀微藻,它在淡水及海水中均能快速繁殖,適應力極強。對黃絲藻的研究大多集中在黃絲藻引起的污染治理的方法探究方面[8]。有研究表明,黃絲藻的主要代謝產物包含有機酸、氨基酸、醇類、糖類等物質[10]。紫球藻(Porphyrodium cruentum)胞外多糖具有很強的抗氧化性,并且對細菌的生長具有一定的抑制作用[11-13]。
本試驗主要研究黃絲藻水提物、5 種有機試劑提取物以及黃絲藻多糖和紫球藻胞外多糖對于大腸桿菌、解淀粉芽孢桿菌、金黃色葡萄球菌、涅斯捷連科氏菌、海桿菌、鹽單胞菌6 種受試菌種的抑菌效應,旨在為研制高效生物抑菌劑提供科學參考。
1 材料和方法
1.1 試驗材料
供試微藻黃絲藻(Tribonemasp.) 和紫球藻(Porphyrodium cruentum)來源于山西農業大學分子農業與生物能源研究所。
1.2 試驗方法
本試驗微藻培養方式為一次培養,用BG11 培養基培養黃絲藻,將生長至對數期的微藻懸浮液經7 000 r/min 離心8 min,棄去上清得藻泥,所得藻泥加適量蒸餾水洗滌2~3 次,冷凍干燥后獲得黃絲藻干藻。用人工海水培養基培養紫球藻,在其生長至對數期收集藻液,離心后的上清液用于胞外多糖的制備。
1.2.1 提取物的制備
1.2.1.1 水提物的制備 采用反復凍融法[14]提取。黃絲藻藻泥冷凍干燥后,用液氮反復研磨3 次得黃絲藻藻粉。稱取5 g 黃絲藻藻粉,加入10 mL 蒸餾水,置于-20 ℃冰箱中冷凍30 min。凍藻粉經室溫融解5 min,再研磨,反復6 次。加入蒸餾水至體積達100 mL,60 ℃水浴1 h 后,在6 000 r/min 下離心10 min,收集上清液并真空干燥得水提物。收集的水提物用滅菌水復溶,過0.22 μm 的水相除菌膜,置于已經滅菌的1.5 mL 離心管中,保存于4 ℃冰箱中備用。
1.2.1.2 不同溶劑提取物的制備 采用浸提法[15]。稱取2 g 黃絲藻藻粉,加入40 mL 各有機溶劑(甲醇、乙醇、丙酮、乙酸乙酯、甲醇/甲苯(體積比3∶1)),搖勻2 h。樣品經5 000 r/min 離心10 min,獲得上清液。有機提取物經真空濃縮至浸膏后冷凍干燥至粉末。將有機提取物用二甲基亞砜充分溶解,然后過0.22 μm 的有機相除菌膜,置于已經滅菌的1.5 mL 離心管中,保存于4 ℃冰箱中備用。
1.2.2 抗生素的配制 精確稱取100 mg 青霉素溶于1 mL 滅菌水中,并過0.22 μm 的水相除菌膜,置于已經滅菌的1.5 mL 離心管中,作為陽性對照保存于4 ℃冰箱中備用。
1.2.3 黃絲藻多糖的制備 按照陳靜[16]的方法提取黃絲藻多糖,并稍作修改。稱取烘干的黃絲藻干藻10 g,用4%氫氧化鈉料液比1∶20(m/V)充分混合后,于80 ℃水浴3 h。加入200 mL 的20%三氯乙酸溶液,充分混勻后放在4 ℃冰箱中靜置過夜。樣品經5 000 r/min 離心5~10 min,取上清液加3 倍體積95%乙醇,4 ℃冰箱中靜置過夜。5 000 r/min 離心5~10 min,取沉淀,沉淀用無水乙醇洗滌1 次,用真空干燥箱80 ℃干燥后得黃絲藻多糖固體。用研缽充分研磨黃絲藻多糖,溶于滅菌水中,過0.22 μm的水相除菌膜,置于已經滅菌的1.5 mL 離心管中,保存于4 ℃冰箱中備用。
1.2.4 紫球藻胞外多糖的制備 按照孫利芹[17]的方法提取紫球藻胞外多糖。
1.2.5 抑菌試驗
1.2.5.1 受試菌種及培養基 本試驗受試菌為大腸桿菌(Escherichia coli)、金黃色葡萄球菌(Staphylococcus aureus)、涅斯捷連科氏菌(Klebsiella nesterensis)、鹽單胞菌(Halomonas)、海桿菌(Maris bacilli)、解淀粉芽孢桿菌(Bacillus amyloliquefaciens),菌種均來自于山西農業大學分子農業與生物能源研究所。
1.2.5.2 抑菌試驗方法 所有菌種從-80 ℃冰箱中取出解凍后,取200 μL 菌種于5 mL 培養基中擴培,再于100 mL 錐形瓶中擴培12 h。
采用稀釋法[18],并進行改良。用15 mL 離心管裝5 mL 培養基,每管分別加30 μL 已經制備好的水相提取物及有機相提取物,再加5 μL 對應的菌種。其中,大腸桿菌需要再加5 μL 卡納抗生素。置于培養箱中培養12 h 后進行OD 值的測定(大腸桿菌和金黃色葡萄球菌37 ℃,其他菌種30 ℃),并設置空白對照(不加提取物)作為陰性對照。以上所有操作需在無菌條件下進行。所有試驗操作重復3 次。
1.3 數據分析
數據采用Mictosoft Excel 2010 進行統計分析;采用Origin 9.1 軟件繪圖;采用SPSS 18.0 軟件進行差異顯著性分析(P<0.05)。
2 結果與分析
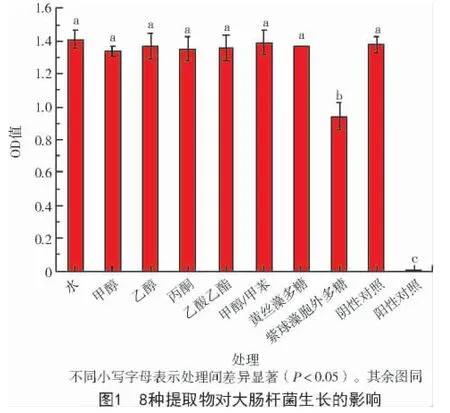
2.1 提取物對大腸桿菌的抑制作用
從圖1 可以看出,與大腸桿菌的陰性對照相比,紫球藻胞外多糖對大腸桿菌的生長具有明顯的抑制作用,其他7 種提取物對大腸桿菌的生長均無明顯影響。
2.2 提取物對鹽單胞菌的抑制作用
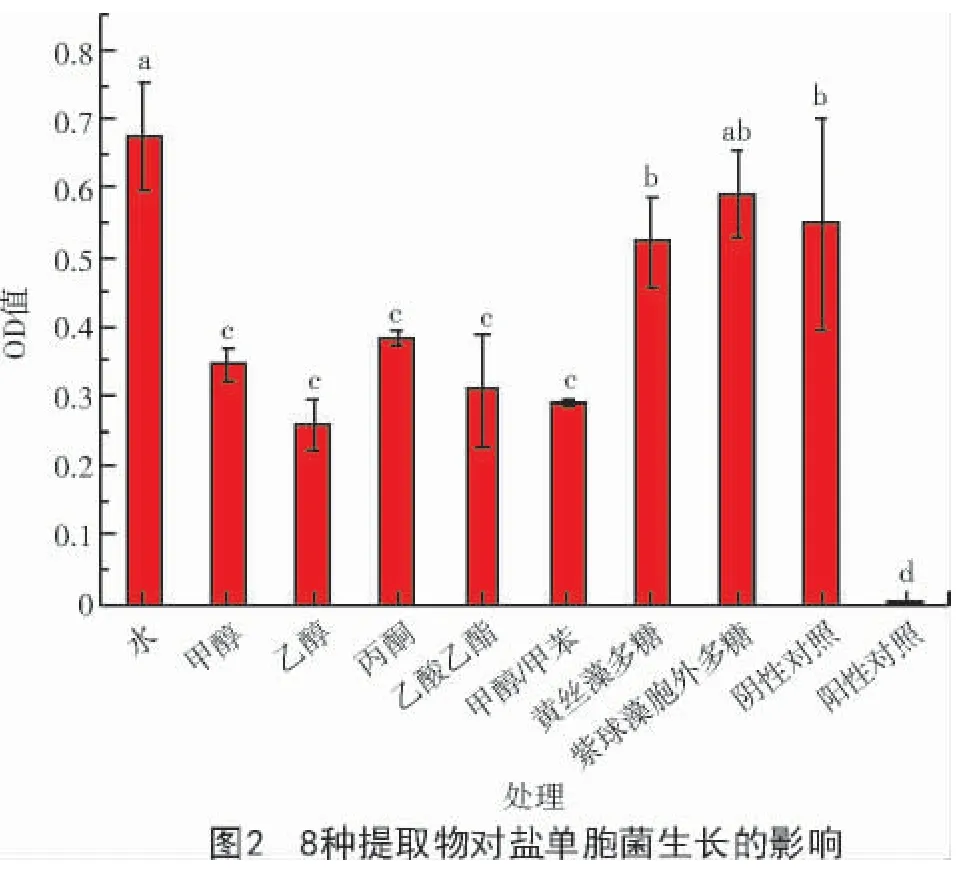
由圖2 可知,與鹽單胞菌的陰性對照相比,黃絲藻的水提物與紫球藻胞外多糖促進了鹽單胞菌的生長。黃絲藻多糖對鹽單胞菌生長的影響并不明顯。黃絲藻的甲醇提取物、乙醇提取物、丙酮提取物、乙酸乙酯提取物和甲醇/甲苯(體積比3∶1)提取物對鹽單胞菌的生長均具有明顯抑制作用,其中,乙醇提取物對鹽單胞菌生長的抑制作用最強。
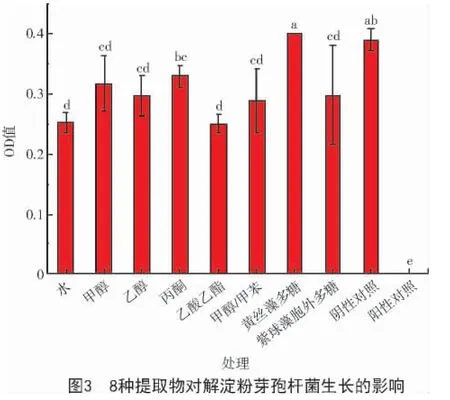
2.3 提取物對解淀粉芽孢桿菌的抑制作用
由圖3 可知,與解淀粉芽孢桿菌的陰性對照相比,黃絲藻丙酮提取物與黃絲藻多糖對解淀粉芽孢桿菌生長的影響并不明顯。黃絲藻的甲醇提取物、乙醇提取物、甲醇/甲苯(體積比3∶1)提取物和紫球藻胞外多糖對解淀粉芽孢桿菌的生長均具有一定的抑制作用,但并不顯著。黃絲藻的水提物、乙酸乙酯提取物對解淀粉芽孢桿菌生長具有顯著的抑制作用。
2.4 提取物對金黃色葡萄球菌的抑制作用
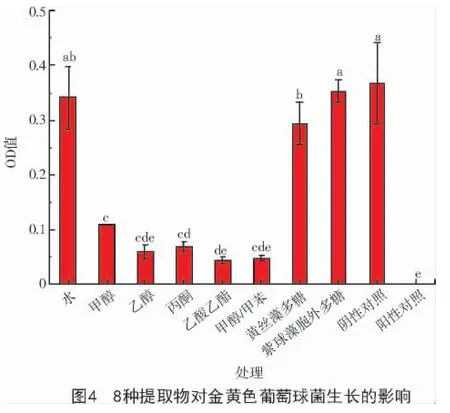
由圖4 可知,與金黃色葡萄球菌的陰性對照相比,黃絲藻水提物和紫球藻胞外多糖對金黃色葡萄球菌的生長無明顯影響。黃絲藻多糖、黃絲藻的甲醇提取物、乙醇提取物、丙酮提取物、乙酸乙酯提取物和甲醇/甲苯(體積比3∶1)提取物對金黃色葡萄球菌生長具有顯著的抑制作用。
2.5 提取物對涅斯捷連科氏菌的抑制作用
由圖5 可知,與涅斯捷連科氏菌的陰性對照相比,黃絲藻的甲醇提取物、乙醇提取物、丙酮提取物、乙酸乙酯提取物和甲醇/甲苯(體積比3∶1)提取物均促進了涅斯捷連科氏菌的生長。黃絲藻水提物、黃絲藻多糖和紫球藻胞外多糖對涅斯捷連科氏菌的生長具有顯著的抑制作用。
2.6 提取物對海桿菌的抑制作用
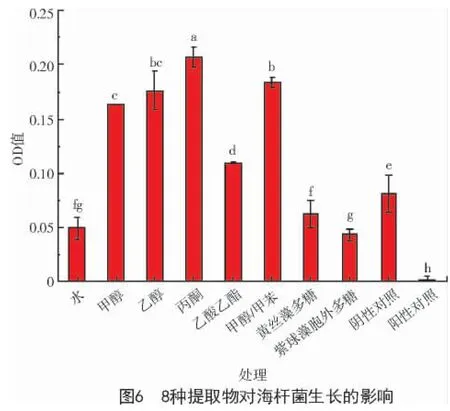
由圖6 可知,與海桿菌的陰性對照相比,黃絲藻甲醇提取物、乙醇提取物、丙酮提取物、乙酸乙酯提取物和甲醇/甲苯(體積比3∶1)提取物均對海桿菌生長具有積極的作用。黃絲藻水提物、黃絲藻多糖和紫球藻胞外多糖對海桿菌的生長具有一定的消極作用。
3 結論與討論
近年來,關于微藻提取物的研究越來越多,但是主要集中在小球藻、螺旋藻、紫球藻等比較常見的微藻[19]。用不同的化學試劑提取微藻所得的活性物質,其活性成分不同,抑菌效果和種類也有差異[20]。羅愛國等[21]用凍融法和回流法提取了7 種可食藻的活性成分,將其水提物和醇提物應用于7 種食品致病菌,結果表明,其中6 種藻類的提取物對供試菌種均有一定的抑制作用。席波等[22]研究表明,海水小球藻、螺旋藻、紫球藻等10 種微藻多糖對4 種細菌和真菌的生長均有明顯的抑制作用。江紅霞等[23]研究發現,4 種微藻提取物對3 種植物病原菌都具有一定的抗菌活性。
有研究表明,這是相似相溶的原理[24],不同的有機溶劑萃取出與其相似的活性物質,而不同的活性物質可能具有不同的抑菌效果。以往研究表明,微藻提取物具有抗菌的效果,微藻提取物可用于制備高效、安全的生物抑制劑。從微藻中提取出的具有抗菌效果的活性物質,可進一步開發成新的藥物或用于農業生物防治的更安全的化合物,同時也可解析微藻與其他微生物的相互作用機制[25]。本研究表明,黃絲藻中具有多種抑菌性能較強的水溶性物質及可溶于有機試劑的活性物質,黃絲藻多糖及紫球藻胞外多糖均可用于制備活性較強的生物抑菌劑。
本研究首先用浸提法獲得了黃絲藻的6 種提取物并提取了2 種微藻多糖。其次,通過提取物對6 種受試菌種生長活性影響的比較,明確了黃絲藻提取物以及黃絲藻和紫球藻多糖對6 種細菌的生長分別具有一定的抑制作用,尤其是黃絲藻的有機試劑提取液對金黃色葡萄球菌的抗菌活性很明顯;黃絲藻水提物及2 種微藻多糖對涅斯捷連科氏菌的抗菌活性最強。但具體的抗菌有效活性成分還不明確,需要進一步的分離、鑒定研究。

