痰液生物標志物在慢性阻塞性肺疾病診治中的研究進展
馬青松,劉凌,趙芝煥
生物標志物是一種能夠客觀測量和評價正常生物學過程、致病過程及對干預措施藥物學反應的指標[1]。慢性阻塞性肺疾病(COPD)是一種復雜異質性疾病,具有多種表型,近年來進行了很多關于生物標志物研究,如:鑒別COPD、哮喘、支氣管擴張等疾病的診斷生物標志物,識別具有頻繁急性加重表型COPD患者的預后生物標志物,確定最有可能在特定干預或治療中獲益(或有害)COPD亞群的預測生物標志物[2]。痰液主要來源于中央大氣道,含有這些部位的生化物質。通過分析痰液生物標志物與臨床指標、各種評分量表的關系,提出新的輔助診斷、病情評估指標及治療靶點,可在一定程度上指導臨床診療。但目前大多數生物標志物尚停留于研究階段,并未在臨床上得到應用。本文就痰液中生物標志物在評估COPD氣道炎癥、輔助診斷、預測急性加重、指導治療等方面做一綜述,為未來更深入研究提供思路。
1 評估氣道炎癥
近年來部分研究發現,COPD患者血清和痰液中某些生物標志物相關性較差[3-4]。PROBOSZCZ等[5]學者的一項回顧性研究發現,在未使用糖皮質激素的輕-中度COPD穩定期患者中,痰液與血液中嗜酸粒細胞計數無相關性,外周血液嗜酸粒細胞不能反映痰液中嗜酸粒細胞。HASTIE等[6]的一項多中心觀察性研究,納入SPIROMICS隊列分析中2 737例患者,根據痰液和血液嗜酸粒細胞水平將患者分組,發現高水平痰液嗜酸粒細胞比高水平血液嗜酸粒細胞更能識別具有頻繁惡化、嚴重肺氣腫的重度COPD亞組,血液嗜酸粒細胞計數與痰液嗜酸粒細胞計數呈弱相關,存在較高假陽性率(72%)。Nú?EZ等[7]納入133例患者,評估同一患者痰液和血清中各種炎性遞質相關性,以及炎性遞質與肺功能指標之間的關系,發現COPD穩定期患者肺部和全身炎癥之間無相關性,全身炎癥與肺功能變量之間亦無相關性,可能導致兩個部位炎癥致病機制不同。綜上,痰液較血液更好地反應氣道炎癥,COPD全身炎癥與氣道炎癥之間的聯系尚不清楚,目前并未發現能解釋兩個部位炎癥聯系的標志物及炎性通路,有待進一步研究。
COPD患者痰液中以中性粒細胞為主,20%~40%嗜酸粒細胞增高[5,8]。GAO等[9]的一項前瞻性研究納入慢性阻塞性肺疾病急性加重期(AECOPD)患者83例,根據痰液中炎性細胞計數將其分為中性粒細胞型、嗜酸粒細胞型、混合粒細胞型、粒細胞缺乏型四個亞組,在14個月隨訪中,從急性加重期至穩定期,痰液炎性細胞亞型分類具有穩定性。表明AECOPD炎性反應具有異質性,這種亞型分類具有穩定性,痰液中炎性細胞分布可以作為AECOPD分類有價值的生物標志物。
2 輔助診斷和鑒別診斷
目前主要以吸入支氣管擴張劑后第1秒用力呼氣末容積與用力肺活量百分比(FEV1/FVC)<70%為標準來診斷COPD。而隨年齡增長,健康者肺功能指標會有所下降,以上述標準來診斷COPD會導致年輕者診斷不足,年長者診斷過度,故對于COPD診斷需要新手段或特異標志物。WU等[10]研究納入5例COPD患者和5例健康者,評估外周血中性粒細胞對COPD患者痰上清液的趨化性,發現中性粒細胞對COPD患者痰上清液趨化性更高,且與COPD診斷標準(FEV1/FVC)有關,中性粒細胞趨化性可能具有作為COPD診斷生物標志物的潛力。但該研究納入樣本量有限,需要更多大型臨床試驗加以證實。
哮喘和COPD均是以氣流受限為特征的慢性氣道炎性疾病,有時在臨床上卻很難進行鑒別。GHEBRE等[11]納入86例中重度哮喘和75例COPD患者,對二者痰液中18種細胞因子進行聚類分析確定生物亞群,分為3類:(1)哮喘為主,具有嗜酸粒細胞炎癥和高Th2細胞因子濃度;(2)哮喘合并COPD,具有細菌定植引起中性粒細胞炎癥和高白介素(IL)-1β水平;(3)COPD為主,具有混合粒細胞炎癥和高IL-6水平。并在166例單純重度哮喘和85例單純COPD患者中進行驗證,發現驗證組和研究組相同亞群痰細胞、細胞因子分布相似。GóRSKA等[3]的一項前瞻性研究發現,痰液嗜酸粒細胞和中性粒細胞百分比對于二者鑒別有較高準確性〔ROC曲線下面積(AUC)分別為0.79、0.75〕,但均顯示中等或低靈敏度和特異度。根據痰液嗜酸粒細胞百分比、中性粒細胞百分比、IL-6、中性粒細胞彈性蛋白酶(NE)、基質金屬蛋白酶(MMP)-9水平和臨床指標對患者進行聚類分析,可分為單純哮喘、哮喘合并COPD聚類。BAI等[12]研究發現,通過檢測痰液中炎性細胞因子〔IL-5、IL-9、IL-13、IL-6、IL-1β、腫瘤壞死因子(TNF)-α〕、T淋巴細胞亞群(CD4/CD8)有助于鑒別哮喘和COPD。因此,基于單一細胞因子區分兩種疾病是有困難的,若能確定痰液炎性細胞、炎性因子譜的分布特點,提出更具體的亞群分類,將有助于鑒別二者,進一步個性化治療。
3 判斷氣流受限的嚴重程度
COPD氣流受限嚴重程度評估主要依據臨床表現、肺功能及相關評分量表,易受評判者主觀性及患者文化程度、回憶偏倚、操作耐受性的影響,故需要易于檢測、客觀的指標。一項納入218例穩定期COPD患者的橫斷面研究,探索痰細胞類型與臨床癥狀的關系,發現呼吸困難組患者痰液嗜酸粒細胞比例更高,而咳嗽組患者痰液中性粒細胞比例更高,嗜酸粒細胞對呼吸困難型COPD診斷率為83.1%,中性粒細胞對咳嗽型COPD診斷率為72.4%,表明痰液炎性細胞類型確實與COPD臨床表現不同類型相關[13]。近年研究指出,中性粒細胞表型意味著更嚴重氣道阻塞和肺氣腫[3],嗜酸粒細胞表型與疾病惡化嚴重程度有關[14],痰液嗜酸粒細胞陽離子蛋白表達與COPD評估測試(CAT)的癥狀嚴重程度呈負相關[15]。CHOU等[16]的一項回顧性研究發現,吸入支氣管擴張劑后FEV1增加0.4 L或15%可以預測痰液嗜酸粒細胞增多,二者存在相關性。因此,痰液炎性細胞學分類可以評估氣流受限嚴重程度,但痰液嗜酸粒細胞增多是否可以說明氣流受限具有可逆性,且各種炎性細胞增多的閾值尚不清楚,均需進一步研究。
近年來發現一些能夠評估COPD氣流受限的生物標志物。CAO等[17]研究發現,COPD患者痰液中組織蛋白酶E(CatE)水平較高,且與第1秒用力呼氣末容積占預計值百分比(FEV1% pred)呈負相關,隨著慢性阻塞性肺疾病全球倡議(GOLD)肺功能分級增加(Ⅰ~Ⅳ級),CatE水平逐漸升高,表明痰CatE與氣流受限嚴重程度相關。KAWAMOTO等[18]指出痰戊糖素水平與FEV1% pred、FEV1/FVC呈負相關,而痰血管內皮生長因子(VEGF)水平則與之呈正相關;隨著肺氣腫嚴重程度的增加,痰戊糖素水平逐漸增加,痰VEGF水平逐漸下降,表明痰戊糖素、VEGF水平可用于評估氣流阻塞和肺氣腫嚴重程度。WELLS等[19]研究發現,痰液中乙酰基-脯氨酸-甘氨酸-脯氨酸(ACPGP)濃度與FEV1/FVC、GOLD分級、疾病嚴重惡化風險相關,高濃度痰ACPGP意味著距離首次嚴重惡化時間較短,表明COPD患者痰液中ACPGP濃度與氣流受限及疾病惡化風險有關。LAI等[20]研究發現,COPD患者痰肝素結合表皮生長因子(HB-EGF)水平與CAT評分呈正相關。綜上,痰液來源于氣道,通過分析各種生物標志物與臨床指標相關性,有助于探索新的病情評估指標。
4 預測急性加重風險
目前COPD主要通過既往年急性加重次數來預測未來急性加重風險,缺乏能夠檢測的指標。ELTBOLI等[14]研究指出,痰液嗜酸粒細胞增多與COPD急性加重發作頻率呈正相關。FU等[21]研究發現,頻繁急性加重COPD患者痰液中IL-1β基因表達水平明顯升高,既往急性加重通過激活IL-1β全身炎性軸從而介導未來急性加重,IL-1β基因表達水平升高能預測未來1年頻繁急性加重,可能介導COPD既往和未來頻繁加重之間的惡性循環。BAINES等[22]研究在上述基礎上,進一步探索IL-1途徑生物標志物基因表達與頻繁急性加重的關系,發現IL-1通路遞質〔包括信號分子白細胞介素1受體關聯激酶2(IRAK2)、白細胞介素1受體關聯激酶3(IRAK3)、PELI1蛋白和信號受體白細胞介素1受體1型(IL1R1)〕表達與未來加重次數和嚴重程度有關。意味著,痰液嗜酸粒細胞增多,IL-1β基因及IL-1通路遞質表達水平增加,可能識別出具有頻繁急性加重表型的COPD患者。
AECOPD多由細菌、病毒感染所引起,探索相關易感性指標,有助于預測COPD急性加重風險。病原體分子成分可被氣道中細胞表達分子模式識別受體(PRR)識別,從而引發炎癥過程[23]。KINOSE等[24]一項前瞻性研究發現,有頻繁急性加重史患者痰液中性粒細胞百分比、Toll樣受體3(TLR3)基因表達增加,二者均與COPD急性加重相關;經多元Logistic回歸分析后結果顯示,TLR3基因表達不能作為COPD急性加重獨立預測因子,但可能增加COPD惡化易感性。MALLIA等[25]研究發現,在COPD穩定期和急性加重期痰液中葡萄糖濃度均增加,且后者升高明顯。痰液中葡萄糖濃度與炎性標志物、病毒載量和細菌負荷之間存在顯著相關性。氣道葡萄糖濃度升高可能導致COPD對氣道感染易感性增加,這為開發預防和治療COPD細菌感染非抗生素策略提供重要依據。因此,無論從病原微生物、還是從COPD氣道環境角度出發,進一步探索疾病惡化易感性因素,有助于預測急性加重風險,開發新的治療策略延緩疾病進展。
5 指導治療
近年研究表明,通過痰細胞學分類確定氣道炎癥類型以便采取針對性治療。嗜酸粒細胞為主型可能對皮質類固醇或Th2細胞因子(如:IL-4、IL-5、IL-13)治療有反應,中性粒細胞為主型可能適用于抗生素或靶向中性粒細胞募集途徑治療,混合粒細胞為主型中Toll樣受體和IL-6家族細胞因子可能是潛在治療靶點,粒細胞缺乏型可能不需要抗感染治療[26]。HO等[27]研究指出,在觀察性和單中心對照試驗中,基于痰細胞學分類治療優于當前基于指南的建議,可預防未來病情加重和住院治療,具有更好的預后和成本效益。在同一患者連續發作期間,氣道炎癥性質會發生變化,每次急性加重通過痰細胞學分類重新評估氣道炎癥性質,對于選擇合適治療方法有重要意義[28]。因此,結合痰細胞學分類可以一定程度指導治療。
激素是目前主要抗炎藥物,但在COPD患者中療效各異,了解與激素抵抗相關細胞和分子機制,尋找特異標志物,識別對其抵抗患者,從而減少停藥或長期用藥帶來的問題[29],如吸入型糖皮質激素(ICS)與小劑量茶堿聯合治療可減輕COPD氣道炎癥并逆轉糖皮質激素抵抗,痰液中較低硫化氫水平能夠識別出從二者聯合治療中獲益最大患者[30]。目前已確定的激素抵抗機制包括皮質類固醇受體磷酸化和修飾、組蛋白脫乙酰基酶2活性表達缺失[31]。MILARA等[32]研究發現,黏蛋白胞質尾(MUC1-CT)基因表達對于皮質類固醇療效有調節作用。INUI等[33]研究發現,COPD患者吸入ICS不會影響痰CXC趨化因子配體(CXCL)1水平,卻影響痰CXCL8水平,體外實驗證實,抗炎藥最小程度影響肺上皮細胞CXCL1產生,卻明顯抑制CXCL8產生。CXCL1介導中性粒細胞炎癥可能對激素及其他抗炎藥物作用不敏感。通過檢測COPD患者生物樣本中皮質類固醇受體改變及組蛋白脫乙酰基酶2、CXCL1的表達可能有望識別出對激素不敏感患者,同時針對激素抵抗或療效調節機制提出新的治療靶點,對于COPD的治療將會更進一步。近年來,針對各種細胞因子的靶向治療亦進行了相關研究(見表1)。
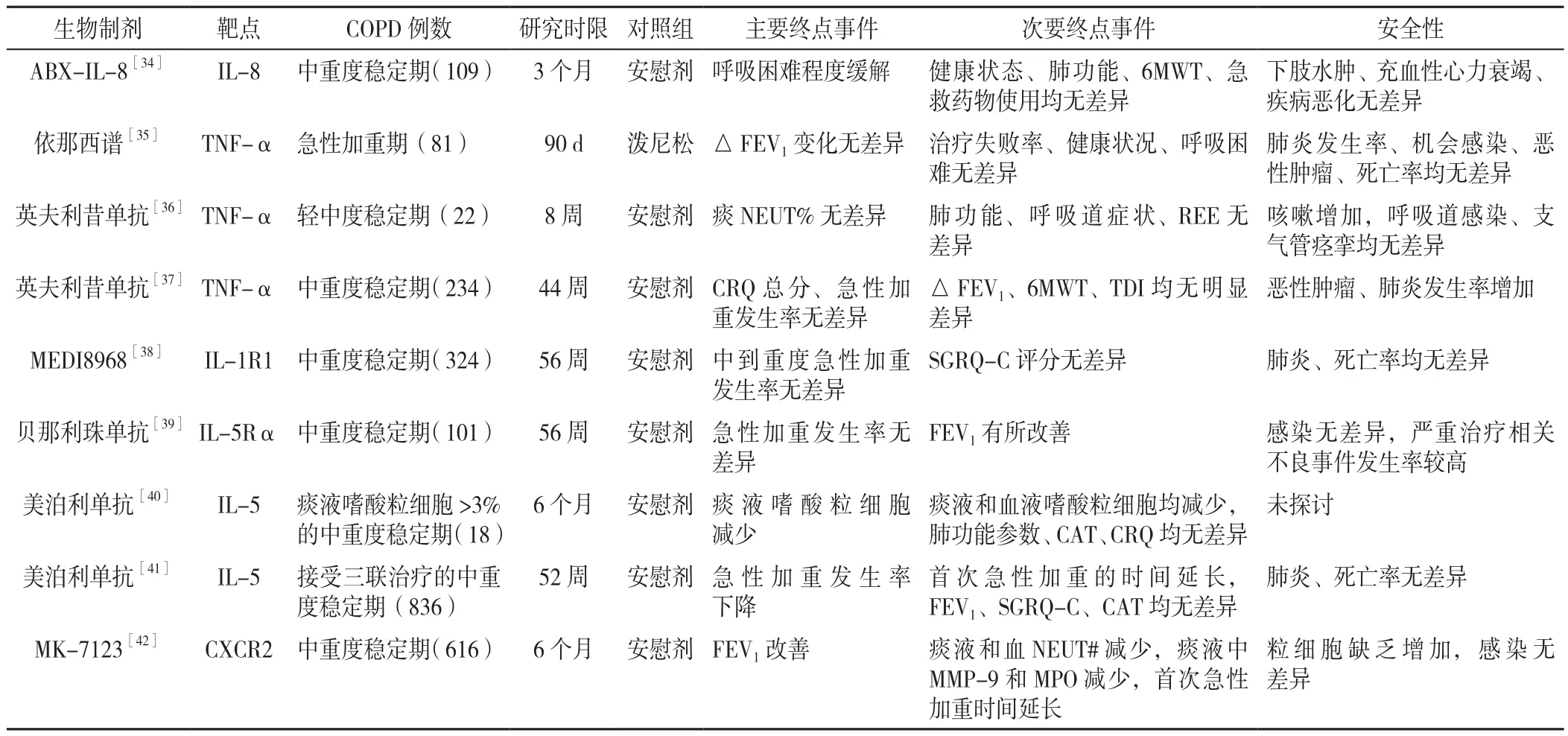
表1 COPD的生物制劑治療研究Table 1 Studies on the treatment of COPD with biological agents
綜上,COPD中性粒細胞炎癥生物制劑治療療效并不顯著,且可能出現粒細胞缺乏、感染、腫瘤等不良反應,而嗜酸粒細胞炎癥生物制劑治療則可能降低急性發作頻率、改善肺功能,且未明顯增加不良反應。對激素抵抗或逆轉抵抗的治療靶點可能是新的研究方向。
6 總結與展望
痰液是一種易獲取且能反應氣道細胞和生化物質成分水平的生物樣本,痰細胞學分類作為目前確定氣道炎癥表型的最佳方法,將COPD分為四種炎癥表型,以中性粒細胞型和嗜酸粒細胞型為主。通過痰液炎性細胞、炎性因子檢測,應用聚類分析等方法提出更加具體亞群分類方法,能更好鑒別COPD和哮喘,有利于對二者重疊部分機制研究;進一步分析痰液生物標志物與各種臨床指標、評分量表相關性,提出新的病情評估指標。探索介導COPD頻繁急性發作炎癥通路,以及細菌、病毒易感性增加的生物標志物,有望識別出具有頻繁急性加重表型患者,提出新的治療靶點。近年來,進行了多項COPD中性粒細胞炎癥和嗜酸粒細胞炎癥生物制劑研究,但未應用于臨床實踐,氣道局部炎癥與全身炎癥相關性尚不清楚,用藥安全性及療程均未得到證實,是否可通過氣道局部用藥獲得療效并減少全身不良反應也未可知。缺乏各種生物標志物在正常人群中的參考范圍。因此,以上均期待未來進行更深入的研究以指導臨床干預和治療決策。
作者貢獻:馬青松進行文章的構思與設計,文章的可行性分析,文獻/資料收集、整理,撰寫論文;劉凌進行論文的修訂,英文的修訂;趙芝煥負責文章的質量控制及審校,對文章整體負責,監督管理。
本文無利益沖突。

