抗稻瘟病生防細菌的分離與篩選
衛甜 呂敏 劉懷阿 朱錦磊 蘇建坤
摘要:由病原真菌Magnaporthe oryzae引起的稻瘟病是水稻生產上的一種毀滅性病害。從稻瘟病發病嚴重的田塊分別采集健康株和病株,從14個不同生境(土壤、根莖葉圍、根莖葉內)中共分離得到304株潛在生防細菌。通過對各細菌胞外產酶活性(葡聚糖酶、纖維素酶、蛋白酶)及產吲哚乙酸活性進行測定,并根據不同指標對細菌進行賦值,最終選擇評分≥3分的114株細菌進行稻瘟病菌的平板拮抗試驗,從中篩選得到15株對稻瘟病病菌有明顯拮抗作用的生防細菌。最終根據賦值評分結果及平板拮抗試驗在實驗室條件下對篩選出的17株具有防治稻瘟病潛在能力的生防細菌進行16S rDNA鑒定,鑒定結果表明,有15株為芽孢桿菌,1株為糖霉菌,另1株為水庫桿菌。本研究以此建立一個針對稻瘟病生防細菌篩選的系統,得到的生防細菌可以為田間防治稻瘟病并最終應用于實際生產提供理論基礎。
關鍵詞:稻瘟病;細菌篩選;酶活性測定;平板拮抗;生防細菌
中圖分類號: S435.111.4+1文獻標志碼: A
文章編號:1002-1302(2021)07-0106-05
收稿日期:2020-06-04
基金項目:江蘇里下河地區農業科學研究所專項基金[編號:SJ(17)103]。
作者簡介:衛 甜(1990—),女,山西運城人,碩士,助理研究員,主要從事植物病害的生物防治工作。Tel:(0514)87302229;E-mail:weitian900128 @163.com。
通信作者:蘇建坤,碩士,研究員,主要從事植物病蟲害的綠色防控工作。Tel:(0514)87302325;E-mail:yzsujk@163.com。
水稻(Oryza sativa)是草本稻屬中的一種,全球近50%的人口以此為主糧[1]。2019年全球水稻種植面積約為1.63億hm2,其中我國水稻種植面積約占全球的18.57%。由病原真菌稻瘟病病菌(Magnaporthe oryzae)引起的稻瘟病是水稻生產上的一種毀滅性病害,被列為水稻三大病害之首,每年可造成10%~20%的產量損失,危害嚴重的地區損失達到40%~50%[2]。抗病育種、化學防治是目前針對稻瘟病防治的主要手段。
在抗病育種方面,由于稻瘟病病原真菌變異分化速度快、多樣性程度高及新的生理小種層出不窮,但常規育種方法選育周期長,育出的抗病品種抗性單一,并且抗性喪失比較快,使抗病品種的廣譜抗性和持久抗性難以實現,育種行業發展舉步維艱[3]。在化學防治方面,相繼出現了一些防治稻瘟病效果較好的化學農藥。據相關報道,0.2% 苯丙烯菌酮微乳劑、30% 戊唑·嘧菌酯懸浮劑、9%吡唑醚菌酯(稻清)微囊懸浮劑等均對稻瘟病的防效可達到60%~90%[4-6]。化學農藥的出現雖在一定程度上解決了稻瘟病防治難的問題,但隨著公眾食品安全意識的提高,其過量使用帶來了病原菌抗性增強、環境污染加重、稻米農藥殘留等新問題。化學防治帶來了植物抗藥性及食品安全問題,而傳統的農業防治又難達到預期的控制效果。在這種形式下,利用有益微生物來防治該病成為一種新的防治方向。
本研究通過篩選生防菌對稻瘟病進行防治,最終篩選得到17株具有生防潛力的細菌,以此為基礎,建立防治稻瘟病快速篩選、評估體系,以期為生物農藥田間防控稻瘟病提供理論基礎。
1 材料與方法
1.1 稻瘟病生防細菌的采集與分離
細菌采集:于2018年9月在江蘇省揚州市廣陵區灣頭水稻試驗基地稻瘟病發病嚴重的地塊,采用5點取樣法分別采集健康植株和發病植株及其根圍土壤。將采集后的樣品迅速裝入寫好編號的塑料袋中帶回實驗室進行分離,植株體表及體內細菌的分離方法分別參照Berg等的方法[7-8]。
細菌編號:B表示病株,J表示健康株;土壤分離的細菌用T表示;根圍細菌用GW表示,根內細菌用GN表示;莖圍細菌用JW表示,莖內細菌用JN表示;葉圍細菌用YW表示,葉內細菌用YN表示;阿拉伯數字連續表示每次保留的細菌數量。如:細菌編號為BGW11,表示從發病植株根圍分離保留的第11株細菌,以此類推。
1.2 產酶和代謝產物活性測定
產纖維素酶活性的測定:將待鑒定的菌落用牙簽轉移到纖維素酶活性測定平板,28 ℃條件下培養 48 h,用1 g/L的剛果紅溶液染1 h后,倒掉染液,用1 mmol/L的NaCl溶液浸泡1 h[9];產蛋白酶活性的測定采用同樣的方法,將待鑒定的菌落轉移到蛋白培養基于28 ℃培養箱中培養3 d[10];產β-1,3-葡聚糖酶活性的測定:將待鑒定的菌落用牙簽轉移到葡聚糖平板上,28 ℃培養48 h。以上均須觀察透明圈有無,并記錄透明圈大小。產吲哚乙酸活性的測定,完全參照Sawar 等的方法[11]。
1.3 細菌的賦值評估
潛在生防細菌賦值評估,評分如下:產蛋白酶、纖維素酶活性各3分,其中酶活透明圈半徑為0~3 mm 賦1分,3~6 mm 賦2分,>6 mm賦3分;產吲哚乙酸和葡聚糖酶活性各賦1分,共計8分。
1.4 細菌對稻瘟病菌的平板拮抗
采用對峙培養法,將保存于4 ℃冰箱中的稻瘟病病菌斜面用接種針接種到馬鈴薯葡萄糖瓊脂(PDA)培養基平板上活化,待菌絲長滿平板后用滅菌的打孔器從菌落外邊緣均勻地打成直徑為8 mm的圓形菌塊。將菌絲塊接種在PDA平板的中心,在其四周距中心約35 mm處分別接種1株待測定的細菌。25 ℃條件下培養至菌絲長滿平板后,分別記錄各抑菌圈的半徑(cm),重復4次。
1.5 細菌的16S rDNA鑒定
引物采用細菌16S rDNA擴增通用引物U8-27、L1494-1514,測序由通用生物系統(安徽)有限公司完成。獲得的16S rDNA序列在Basic Local Alignment Search Tool(BLAST)中進行比對,取得鑒定結果。
2 結果與分析
2.1 不同生境中生防菌的分離結果
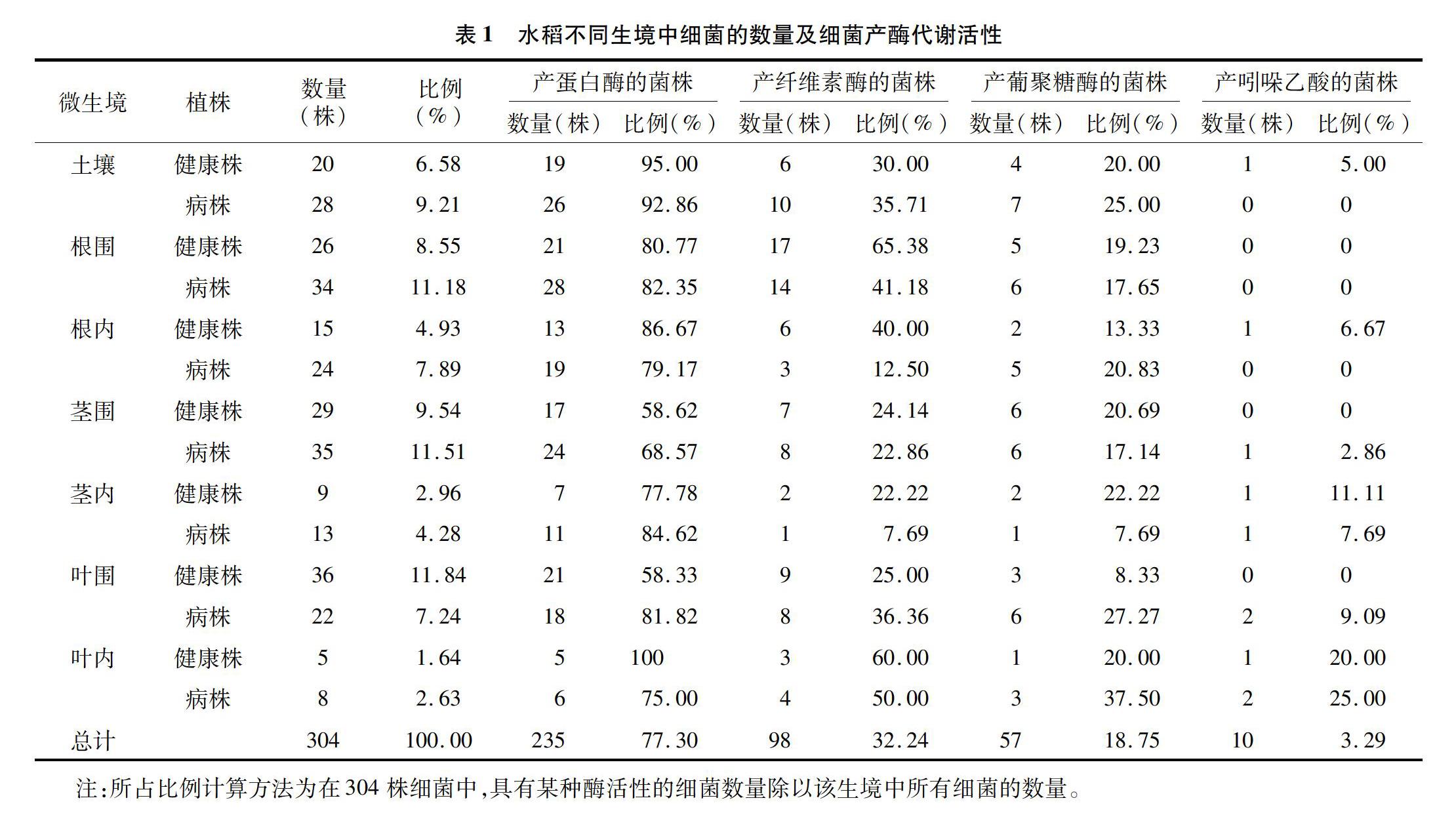
本次試驗共從水稻14個不同生境(分別是健康株和病株的根莖葉圍、根莖葉內以及土壤等)中分離得到304株生防細菌(表1)。其中從健康株和病株不同生境中分離得到的細菌數量分別為140、164株,分別占總分離菌數的46.05%、53.95%,總體相差不大。而從健康株葉圍、病株莖圍以及病株根圍分離得到的細菌數量最多,分別為36、35、34株,共占總菌數的34.54%。葉內分離到的細菌總數為13株,只占總菌數的4.28%。整體來說,本研究通過對水稻稻瘟病健康株各個生境進行細菌分離,初步獲得了數量比較豐富的潛在生防菌。
2.2 細菌產酶活性測定結果
研究發現,生防細菌產生的某些次生代謝產物如水解酶蛋白酶、纖維素酶以及胞壁降解酶β-1,
3-葡聚糖酶會幫助增強寄主植物的競爭力;吲哚乙酸作為一種生長激素,會影響植物細胞的分裂、伸長、分化和種子萌發、根系的發育以及營養生長過程。為此,對從不同生境中分離得到的304株細菌分別進行胞外酶活性及產吲哚乙酸活性測定,結果(表1)表明,在304株潛在生防菌中,具有蛋白酶活性的細菌最多,共計235株,占總菌數的77.30%;其次是纖維素酶(98株)、葡聚糖酶(57株),分別占總菌數的32.24%、18.75%;產吲哚乙酸的生防細菌最少(10株),只占3.29%。
具體分析各種酶活性發現,在健康株中,產蛋白酶活性高的細菌來源于葉內,高達100%,產纖維素酶活性高的細菌來源于根圍(65.38%),產葡聚糖酶活性高的細菌來源于莖內(22.22%),產吲哚乙酸活性高的細菌來源于葉內(20.00%);在病株中,產蛋白酶活性高的細菌來源于根圍(82.35%),產纖維素酶活性高的細菌來源于葉內(50.00%),產葡聚糖酶活性高的細菌來源于葉內(37.50%),產吲哚乙酸活性高的細菌來源于葉內(25.00%)。總之,在不同植株生境中分離得到的細菌產酶活性和產吲哚乙酸能力差異較大,從病株不同生境中分離得到的細菌數量明顯高于健康株生境。無論是健康或發病植株,從葉圍和根圍中分離得到的細菌普遍具有較高的產酶活性。
2.3 細菌中酶活性賦值得分結果
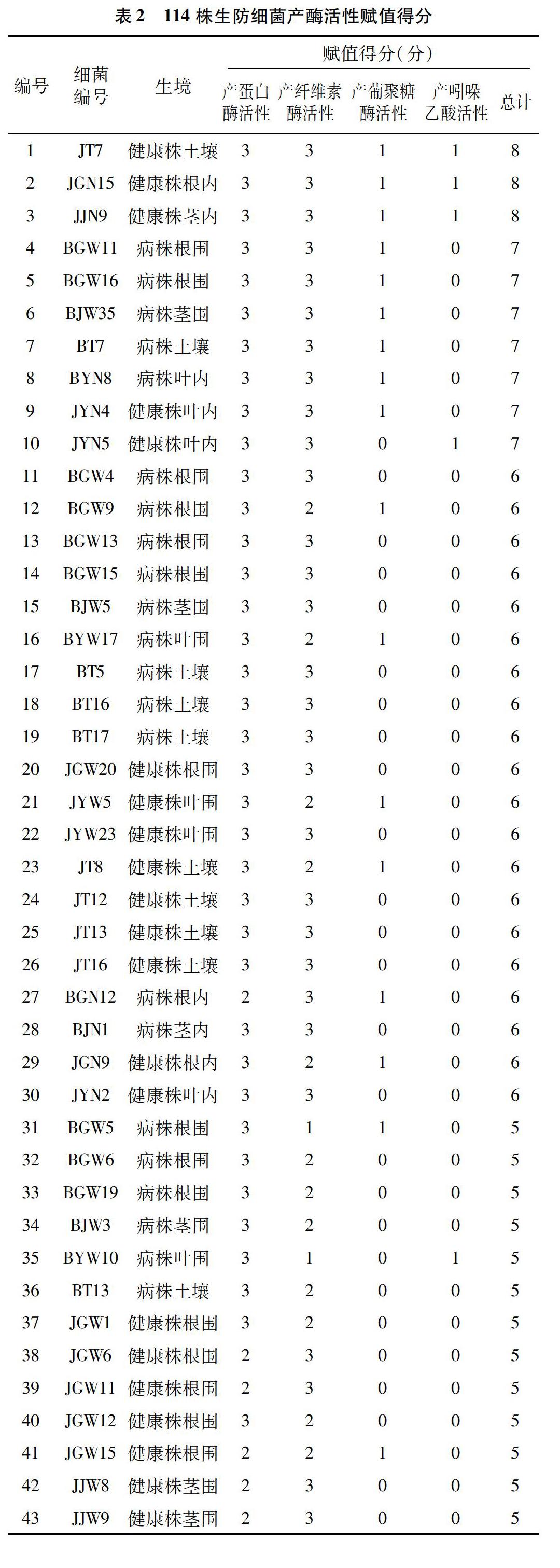
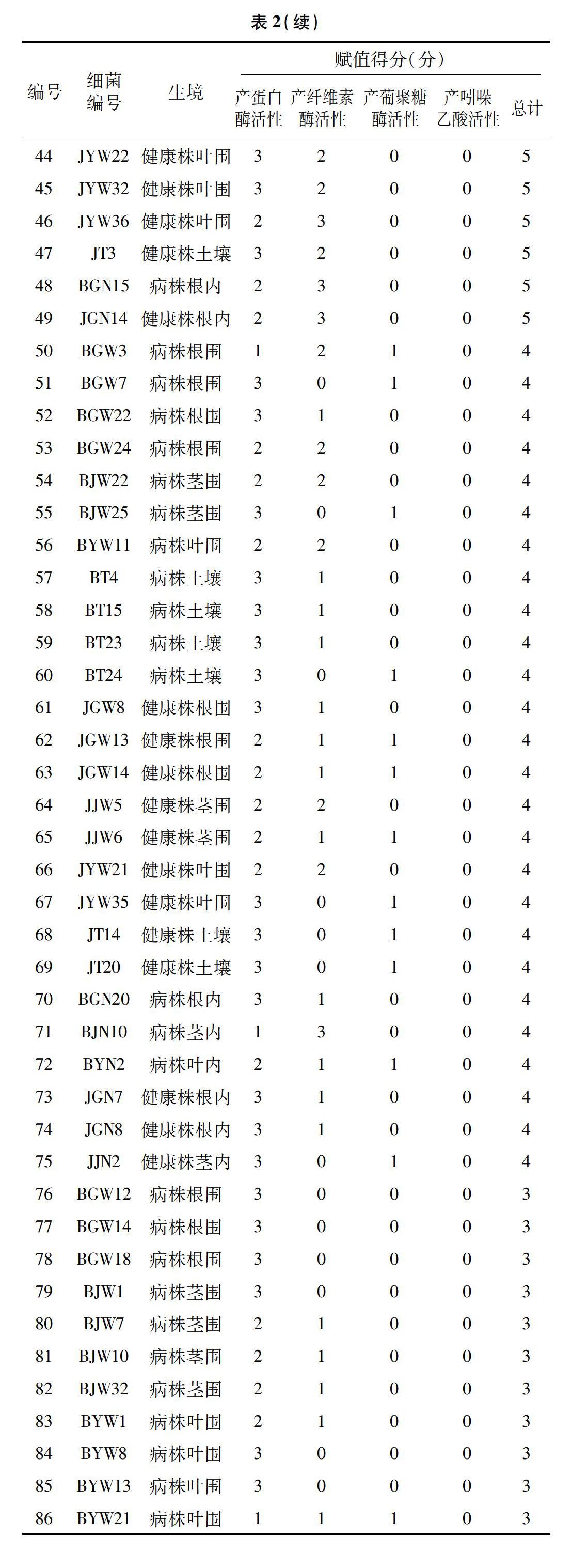
對分離得到的304株潛在生防細菌進行賦值評估,評分較高的說明防治稻瘟病效果好的可能性高。在304株細菌中,有256株細菌至少具有1種活性,其中有3株細菌同時具有4種活性,有23株細菌具有3種活性,有91株細菌具有2種活性。具有4種活性的3株生防細菌全部來自健康植株內,賦予最高分值8分。7株生防菌評分為7分,大多數來自病株。根據賦值評分結果,選取賦值評分≥3分的細菌對稻瘟病病菌進行平板拮抗試驗,共計114株(表2)。
2.4 細菌對稻瘟病病菌的平板拮抗結果
通過114株細菌對稻瘟病病菌的平板拮抗試驗,發現共15株對稻瘟病病菌具有不同程度的抑制效果,占總測定菌數的13.16%。抑菌率在50%以上的有10株,其中7株來源于病株,3株來源于健康株(表3)。來自健康株葉圍的JYW21對稻瘟病病菌的抑制率最高,達78.25%。
2.5 生防菌的鑒定結果
結合表2的酶活測定結果,選取賦值評估為8分,外加15株對稻瘟病具有明顯拮抗作用的生防細菌,本次共初步得到17株潛在生防細菌。根據16S rDNA基因序列的測序結果,與BLAST數據庫的比對結果(表4)顯示,篩選出的17株細菌中有1株為糖霉菌屬(Glycomyces)細菌,1株為水庫桿菌屬(Piscinibacter)細菌,另外15株均為芽孢桿菌屬(Bacillus sp.)細菌,其中4株為蠟質芽孢桿菌(Bacillus cereus),4株為高地芽孢桿菌(Bacillus altitudinis),2株為枯草芽孢桿菌(Bacillus subtilis)。
3 結論與討論
本研究在對防治稻瘟病生防細菌的酶活篩選、平板拮抗及賦值評估體系時發現,在植株不同生境中分離得到的細菌產酶活性和產吲哚乙酸能力差異較大,從病株不同生境中分離得到的具有產酶活性和產吲哚乙酸能力的細菌數量明顯高于健康株生境,可能是由于在稻瘟病病菌侵染的情況下,更能激發植株體內的防御反應,分離得到的細菌產生防御酶活性也相對更高。對稻瘟病病菌的平板拮抗是建立在酶活篩選基礎上的,因為有些細菌酶活評分很高但對稻瘟病病菌并未表現出明顯的拮抗效果(如來源于健康土壤內的JT7),分析可能是由于該細菌對稻瘟病的防治并不會直接殺死病原菌,而是通過誘導抗病性。在分離得到的細菌田間防效指標未知的情況下,評估生防細菌潛能應該是取兩者之和更為客觀科學。因此,該體系可以作為針對稻瘟病篩選生防細菌的基礎,為大規模篩選生防菌體系的建立提供參考。
本研究以此體系為基礎最終得到具有防治稻瘟病潛在能力的17株生防細菌,并且其中9株來源于健康株,分析可能是此時植株生境有益生菌能保護植物,抑制病原菌發生發展,而益生菌也會相應發展成為優勢菌群,但最終得到的17株細菌也不能說對稻瘟病的防治會有絕對的效果,后期仍須進行溫室及田間試驗等研究,主要由于當這些細菌實際應用于水稻時,其防效必將會受到田間土壤、氣候、溫濕度、土壤微生物等諸多因素的綜合影響。
芽孢桿菌屬(Bacillus)的細菌早已在國內外得到了廣泛的關注,應用潛力最大[12]。其廣泛受關注的原因是芽孢桿菌易于分離和純化,同時能產生耐熱、抗逆性強的芽孢,且制劑穩定、抑菌能力強、施用方便、便于運輸[13]。針對稻瘟病的生物防治,早有研究報道,從水稻根際篩選的208 株細菌對稻瘟病病菌有較好的拮抗作用,其中包括蠟狀芽孢桿菌和枯草芽孢桿菌在內的一些芽孢桿菌防效可達50%以上[14];枯草芽孢桿菌 IK-1080的培養濾液,當芽孢濃度在1×108、5×108CFU/mL時,明顯可以抑制稻瘟病病菌分生孢子萌發和菌絲生長,葉瘟的發生率分別減輕13.8%、7.7%,產量損失減少522%、735%[15];從水稻根系土壤中分離得到的枯草芽孢桿菌 T492對稻瘟病病菌的抑制率達 626%[16]。本次試驗初步得到17株生防細菌,經過鑒定絕大多數為芽孢桿菌,相信對稻瘟病的生物防治具有重要意義,后續將專門對芽孢桿菌的生防效果進行系統評價并且研究其抗病機制,從理論及實際應用為稻瘟病的生物防治提供基礎。
參考文獻:
[1]Ju C X,Buresh R J,Wang Z Q,et al. Root and shoot traits for rice varieties with higher grain yield and higher nitrogen use efficiency at lower nitrogen rates application[J]. Field Crops Reserch,2015,175:47-55.
[2]王巧蘭,郭 剛. 水稻稻瘟病生物防治研究進展[J]. 河南農業科學,2005(10):10-13.
[3]王丹,沙 巖,胡俊峰,等. 抗稻瘟病基因的克隆及其分子育種研究進展[J]. 分子植物育種,2019,17(14):4661-4666.
[4]陳婷婷,向禮波,龔雙軍,等. 0.2%苯丙烯菌酮微乳劑防治水稻稻瘟病田間藥效試驗[J]. 湖北植保,2019(5):4-6.
[5]周柏超. 30%戊唑·嘧菌酯懸浮劑防治水稻紋枯病和稻瘟病試驗總結[J]. 現代農業,2019(8):30.
[6]馮春水,張再仁,陳文化. 水稻稻瘟病防治藥劑篩選研究[J].湖北農業科學,2019,58(22):108-110.
[7]Berg G,Kurze S,Buchner A,et al. Successful strategy for the selection of new strawberry-associated rhizobacteria antagonistic to Verticillium wilts[J]. Canadian Journal of Microbiology,2000,46(12):1128-1137.
[8]Krechel A,Faupel A,Hallmann J,et al. Potato-associated bacteria and their antagonistic potential towards plant-pathogenic fungi and the plant-parasitic nematode Meloidogyne incognita(Kofoid & White) Chitwood[J]. Canadian Journal of Microbiology,2002,48(9):772-786.
[9]Ghose T K. Measurement of cellulase activities[J]. Pure and Applied Chemistry,1987,59(2):257-268.
[10]Yang J H,Liu H X,Zhu G M,et al. Diversity analysis of antagonists from rice associated bacteria and their application in biocontrol of rice diseases[J]. Journal of Applied Microbiology,2008,104(1):91-104.
[11]Sarwar M,Kremer R J. Determination of bacterially derived auxins using a microplate method[J]. Letters in Applied Microbiology,1995,20(5):282-285.
[12]孔令春,魏松紅,王海寧,等. 抗稻瘟病的生防細菌篩選與鑒定[J]. 沈陽農業大學學報,2018,49(6):655-660.
[13]朱玥妍,劉 姣,杜春梅. 芽孢桿菌生物防治植物病害研究進展[J]. 安徽農業科學,2012,40(34):16635-16658.
[14]彭化賢,劉波微,陳小娟,等. 水稻稻瘟病拮抗細菌的篩選與防治初探[J].中國生物防治,2002,18(1):25-27.
[15]Taguchi Y,Hyakumachi M,Horinouchi H,et al. Biological control of rice blast disease by Bacillus subitilis IK-1080[J]. Japanese Journal of Phytopathology,2003,69(2):85-9
[16]張 芬. 水稻稻瘟病和白葉枯病拮抗細菌的篩選及防治作用研究[D]. 南京:南京農業大學,2011.

