木脂素類植物雌激素對ERα及ERβ結合親和力的分子動力學研究
王 婷,王云飛,欒 鋒,趙春燕
(1.煙臺大學化學化工學院,山東 煙臺 264005;2.蘭州大學藥學院,甘肅 蘭州 730000)
植物雌激素(Phytoestrogen,PE)是一類存在于植物中,能結合并激活哺乳動物或人體內雌激素受體(Estrogen Receptor,ER)從而發揮雌激素樣和抗雌激素雙重作用的植物成分。它們分為四大類:木脂素類、異黃酮類、香豆素類以及二苯乙烯類[1]。其中,木脂素類主要是通過P-羥基苯乙烯單體氧化耦合產生的一類小分子量次生代謝產物,其主要以游離狀態存在于如夾竹桃科、爵床科、馬兜鈴科等植物中[2],其廣泛分布于植物的根、根狀莖、莖、葉、花、果實、種子以及木質部和樹脂等部位[3]。根據木脂素的來源[4]可以將其分為植物木脂素和動物木脂素。植物木脂素中含量最多的兩種木脂素是開環異落葉松脂酚(secoisolarlciresinol,SECO)和羅漢松脂酚(matairesinol,MAT)。動物木脂素是植物木脂素在哺乳動物的腸道菌群[5]作用下產生的代謝產物,它們分布于動物的血清、血漿、尿液和糞便中,主要含腸二醇(enteroldiol,END)和腸內脂(enteroctone,ENL)。
不論是植物還是動物木脂素的結構都與雌激素(如雌二醇)的結構相似,它們對預防及治療與雌激素有關的疾病如骨組織疏松癥、心血管疾病、前列腺疾病以及冠心病等[6-9]有重要作用。據文獻調研,針對木脂素類植物雌激素與雌激素受體之間起作用的結合親和力研究未見報道,因此,本課題選擇分子動力學模擬方法探究兩種常見的植物木脂素(羅漢松脂酚和開環異落葉松脂酚)和兩種動物木脂素(腸內脂和腸二醇)分別與雌激素受體之間的結合親和力以及產生的相互作用,以期為研究植物雌激素的類激素作用提供幫助。配體結構式如圖1所示。
1 實驗部分
1.1 受體蛋白與配體的準備
雌激素受體ERα(PDB ID∶1GWR)和ERβ(PDB ID∶3OLS)的晶體結構是從RCSB Protein Data Bank[10]中獲得的,并從該結構中得到ERα和ERβ的配體結合域。受體蛋白的準備是在Schrodinger 2015-2軟件中的Protein Preparation Wizard模塊[11]中,用OPLS-2005力場[12]對結構進行預處理所得。圖1中四種木脂素類植物雌激素作為小分子配體,其初始結構從Pubchem數據庫[13]中得到。配體的準備過程是在Schrodinger 2015-2軟件的LigPrep模塊中[14],對配體進行能量優化處理。無論是蛋白還是配體的初始結構都將被用于后續的分子對接過程中。
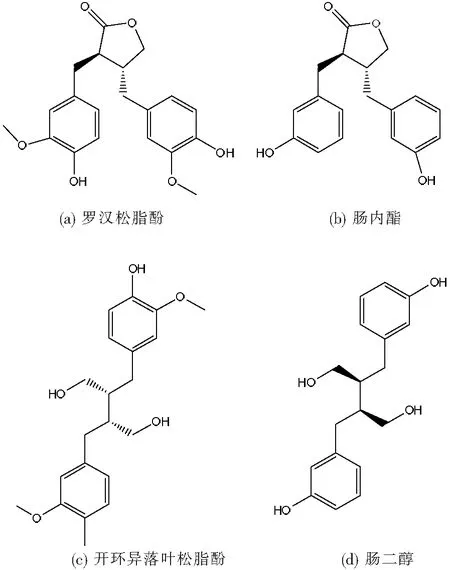
圖1 配體結構式
1.2 分子對接
配體與蛋白的對接過程如下:首先,以配體為中心,與周圍氨基酸殘基形成一個立體空間;其次,將準備好的配體與受體蛋白進行對接,并對對接結果進行打分評估;最后,將對接產生的蛋白-配體復合物以PDB的格式輸出,用于下一步的分子動力學模擬過程。該分子對接過程采用Schrodinger 2015-2軟件中的Glide6.7對接程序[15-16]完成。
1.3 分子動力學模擬過程
分子動力學模擬過程采用軟件Amber14[17]進行。受體蛋白和配體的分子參數分別采用FF03立場和GAFF立場[18-19]。復合物需要進行加氫處理,并且在體系周圍加上1 nm的TIP3P型的立方體水盒子進行溶劑化;分別在ERα體系添加5個鈉離子,ERβ體系添加2個鈉離子,來中和負電荷使體系呈電中性。其中參數截斷距離[20]設為1 nm,積分步程設為2 fs。
分子動力學模擬過程:首先對體系進行溶劑能量最小化、約束抗衡離子能量最小化以及無限制整體能量最小化,每次能量最小化都先進行3000步的最陡下降法優化,然后再進行2000步的共軛梯度法優化;其次運行升溫動力學模擬,在50 ps內將體系溫度從0 K升至300 K;最后在300 K及恒壓的NPT系統中進行100 ns的平衡分子動力學模擬。
1.4 結合自由能的計算及分解
結合自由能的計算是使用Amber14軟件從MD模擬后的復合物的動力學軌跡的最后10 ns中按固定間隔提取出1000個瞬時結構進行計算的。其計算公式如下:
ΔGbind=ΔGcomp-ΔGpro-ΔGlig=
ΔGMM+ΔGsol-TΔS,
ΔGMM=ΔGint+ΔGele+ΔGvdw,
ΔGsol=ΔGpol+ΔGnopol。
其中,ΔGbind是結合自由能,由復合物(ΔGcomp)、受體蛋白(ΔGpro)和配體(ΔGlig)的能量組成。ΔGMM是由內能(ΔGint)、靜電相互作用能(ΔGele)和范德華能(ΔGvdw)組成的氣相結合能,其中由于模擬中使用單軌跡方案,配體與受體結合的構象重組能部分被忽略,即ΔGint=0,ΔGsol是由極性(ΔGpol)和非極性(ΔGnopol)溶劑化能組成的溶劑化自由能。由于熵變的計算過程復雜,在本研究中忽略熵變對結合自由能的影響。
結合自由能分解是應用Amber14軟件中的MM/GBSA自由能分解模塊進行的[21]。該過程主要是計算每個氨基酸殘基在配體與受體結合過程中對總結合自由能的貢獻,并通過對自由能的分解來考察如范德華能、靜電相互作用能以及溶劑化能等各部分能量對結合自由能的貢獻大小。
2 結果和討論
2.1 動力學軌跡分析
針對小分子配體與受體蛋白對接后形成的復合物進行了100 ns的分子動力學模擬,并計算了各體系的均方根偏差(Root Mean Square Deviation, RMSD),結果如圖2。圖2中所有體系在30 ns的模擬之后RMSD值基本穩定(ERα體系RMSD=0.11~0.22 nm;ERβ體系RMSD=0.14~0.20 nm)。所有體系的RMSD波動值均在0.30 nm以下,處于合理范圍內,這說明所有體系經過模擬后均達到平衡,可以進一步分析模擬結果。
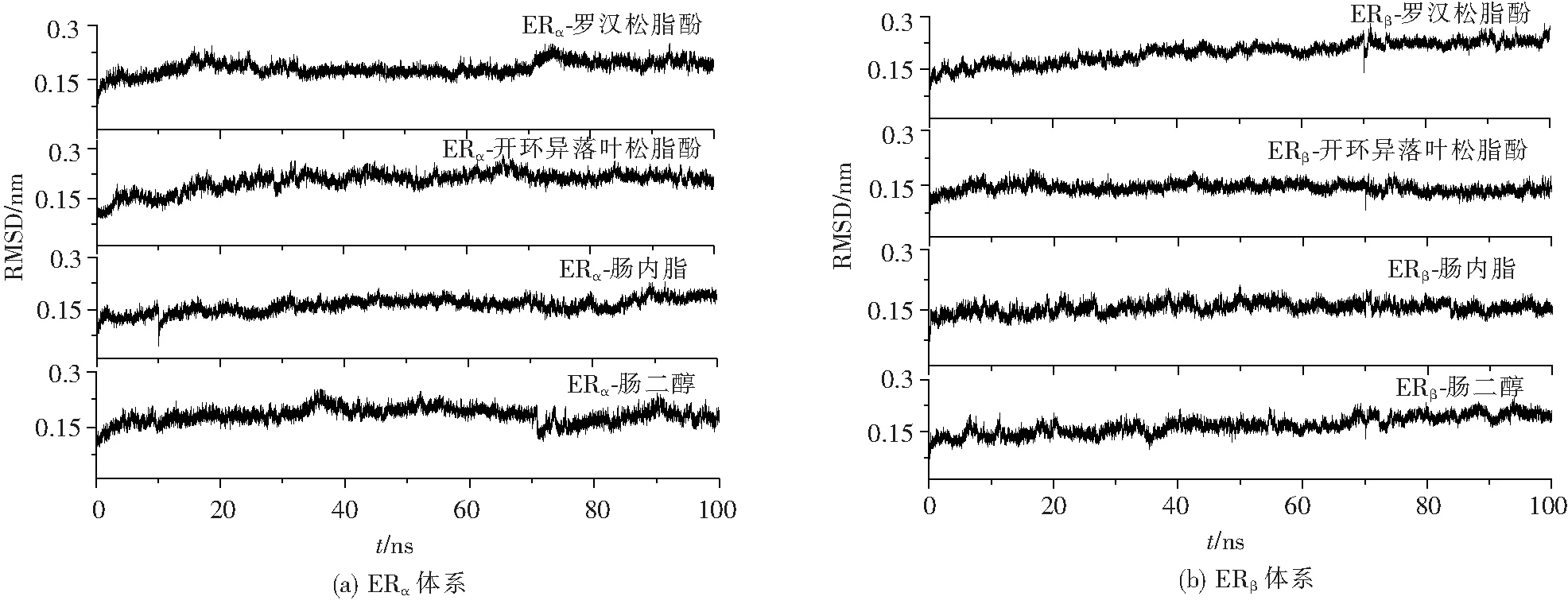
圖2 ERα和ERβ體系中復合物在100 ns模擬過程中的RMSD值
針對體系中各個配體在模擬過程中的狀態變化,分別計算了各體系中配體的RMSD值,結果如圖3。圖3中所有配體的RMSD值均在0.25 nm以下,處于平衡狀態,說明配體在復合物形成過程中起到一定的穩定作用。
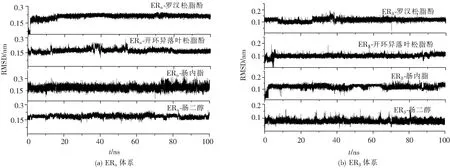
圖3 ERα和ERβ體系中配體在100 ns模擬過程中的RMSD值
接著計算了復合物中每個氨基酸的均方根波動值(Root Mean Square Fluctuation, RMSF),以分析各個體系中受體蛋白的構象變化,如圖4所示。圖中ERα及ERβ兩個體系中的RMSF曲線波動趨勢基本相似,即氨基酸在結合過程中的波動相似,說明同一體系中的復合物的結合過程相似。ERα體系中的復合物在氨基酸PRO19、GLU41、LEU75、PRO94、ILE139、ASP172、HIE212和LEU229的周圍均有相似的波動。這些氨基酸的RMSF值較小,說明其波動較小,對復合物的穩定起到一定作用。在ERβ體系中也有相同的體現,即復合物在氨基酸PRO15、LEU36、LEU77、PHE94、PHE115、ILE142、LEU158和HIE203的周圍波動較小。
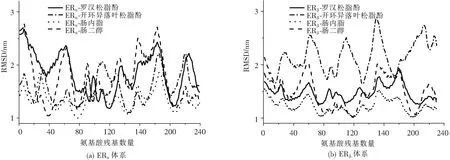
圖4 ERα和ERβ體系中復合物在100 ns模擬過程中的RMSF值
2.2 氫鍵相互作用分析
針對對接后復合物的構象進行氫鍵相互作用分析,四種木脂素類植物雌激素與ERα及ERβ之間產生氫鍵作用如圖5。氫鍵相互作用是穩定配體與受體結合的主要力量之一,就ERα與ERβ兩個體系而言,ERβ體系中產生的氫鍵作用大于ERα體系(ERβ體系中氫鍵個數為2、3、3、2,ERα體系中為3、2、2、1),表明木脂素類植物雌激素對ERβ的結合親和力強于對ERα的。此外,形成的氫鍵位于配體兩端的結構更有利于復合物的穩定,因此,植物木脂素(羅漢松脂酚和開環異落葉松脂酚)對ERα與ERβ的結合親和力都強于兩種動物木脂素(腸內脂和腸二醇)。
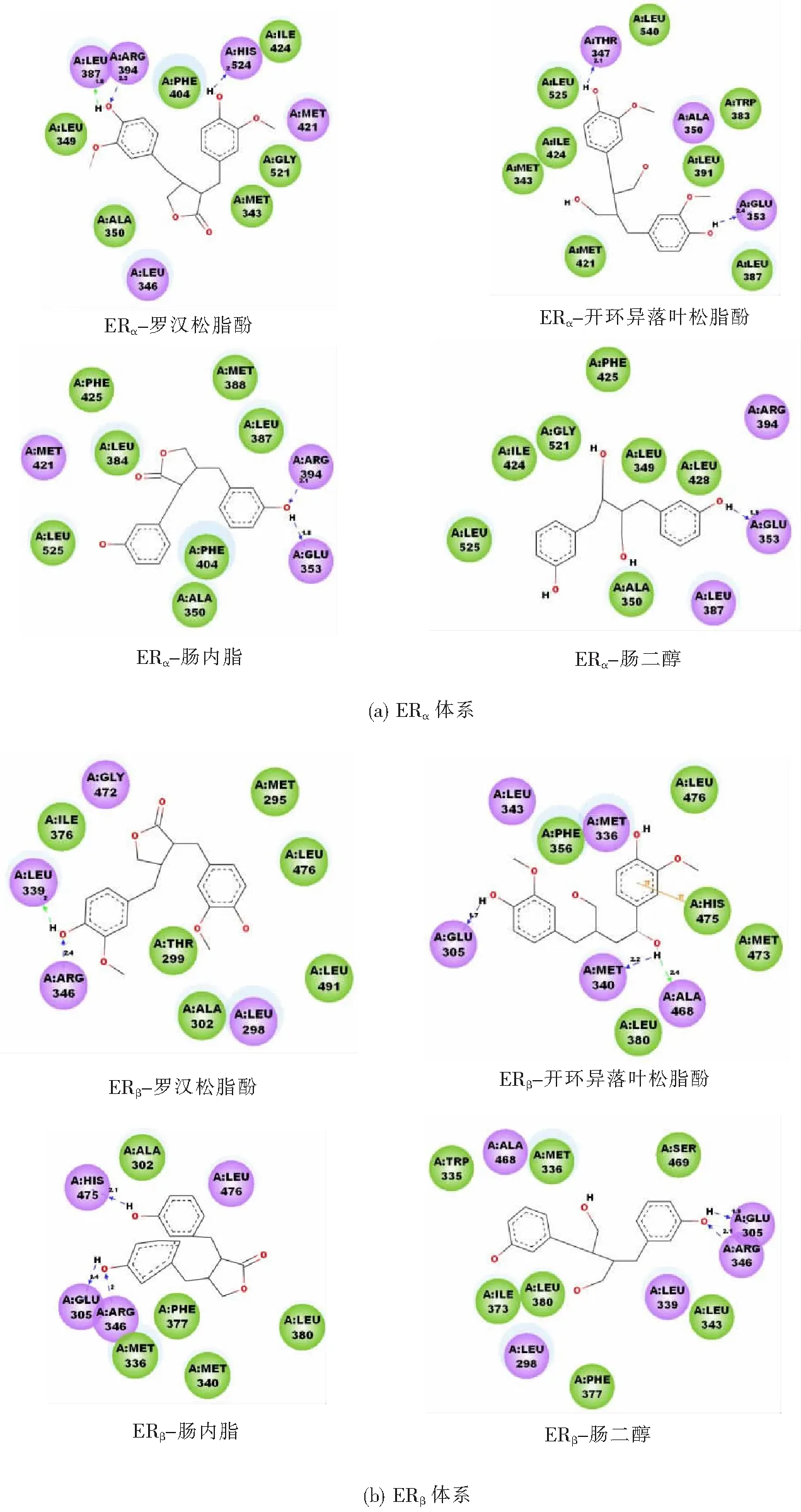
圖5 配體與受體蛋白之間的氫鍵相互作用
2.3 疏水相互作用分析
針對復合物在模擬過程中最后1 ns的軌跡構象進行疏水相互作用分析,結果如圖6。圖中顯示結合口袋處多為疏水性氨基酸,故產生的相互作用為疏水相互作用,且根據圖中結合空腔的左側和底部的疏水勢明顯強于其他位置,說明疏水相互作用對復合物的穩定起重要作用。
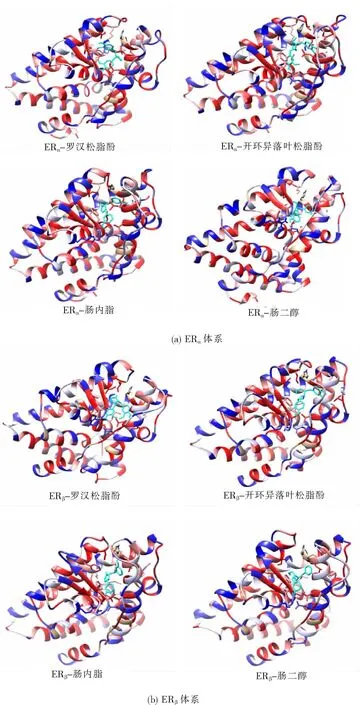
圖6 復合物的疏水相互作用(顏色從紅色變為藍色表示疏水勢降低)
2.4 結合自由能分析
為深入地研究四種配體與雌激素受體之間親和力,用Amber14中的MM/PBSA分別計算了四種木脂素類植物雌激素與ERα及ERβ之間經過100 ns的MD模擬之后所形成的兩個體系的結合自由能,結果列于表1和2。從表中數據可知,結合自由能主要是由范德華能、靜電能、溶劑化能等幾種能量構成。其中,范德華能在幾種相互作用能的貢獻中占主要部分,且其和靜電能、非極性溶劑化作用能的數值均為負值,說明其對配體-蛋白的結合起促進作用。相反的是極性溶劑化作用能對結合自由能貢獻為正值,這說明其不利于配體與受體蛋白的結合。
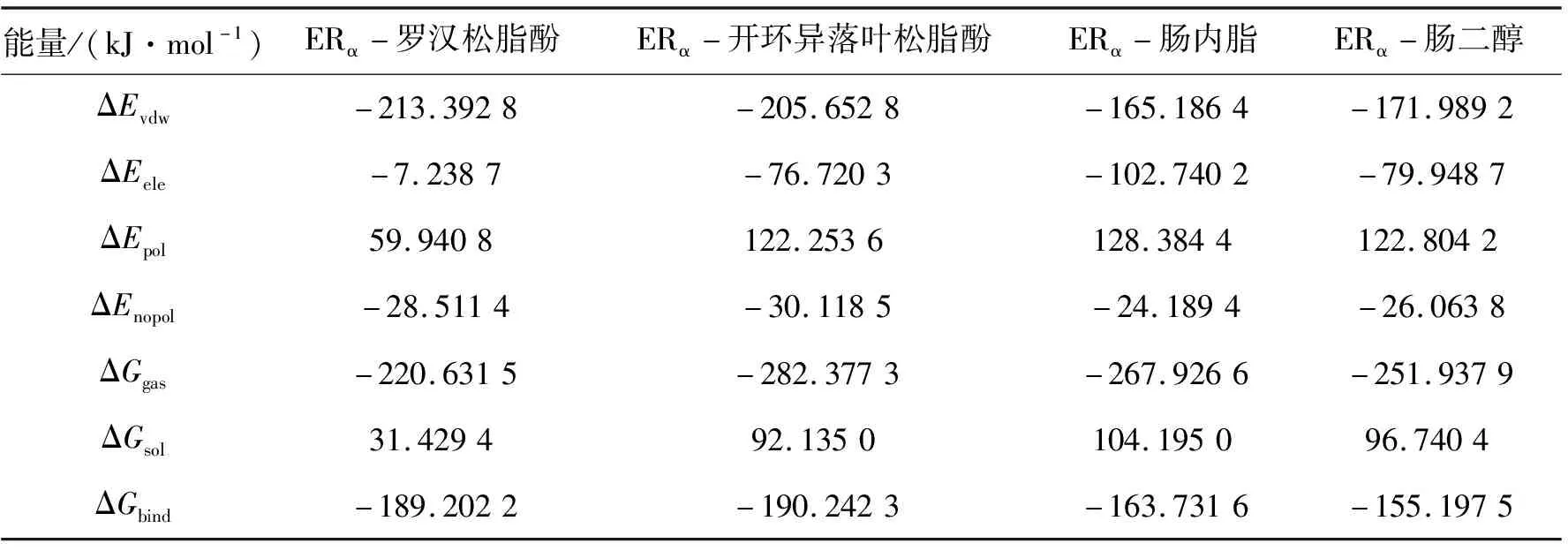
表1 ERα體系中復合物的結合自由能

表2 ERβ體系中復合物的結合自由能
此外,根據表中數據,ERβ體系中四種復合物的結合自由能數值均小于ERα體系中復合物的自由能數值,結合自由能數值越低,形成的復合物越穩定,可見ERβ體系的復合物較ERα體系穩定。復合物ERα-羅漢松脂酚、ERβ-羅漢松脂酚、ERα-開環異落葉松脂酚和ERβ-開環異落葉松脂酚的結合自由能數值低于ERα-腸內脂、ERβ-腸內脂、ERα-腸二醇和ERβ-腸二醇的自由能。結合上述氫鍵相互作用的分析結果,說明羅漢松脂酚和開環異落葉松樹脂酚對ERα和ERβ的結合親和力強于腸內酯和腸二醇。
2.5 結合自由能的分解
應用Amber14中的自由能分解模塊進行分解來分析各氨基酸對總自由能的貢獻,結果如圖7。圖7中標注的氨基酸是對結合自由能貢獻較大(超過±4.184 kJ/mol)的關鍵氨基酸。關鍵氨基酸位于配體與受體形成的結合空腔中,關鍵氨基酸的數目越多,配體與受體之間的相互作用越強,可據此判斷關鍵氨基酸在結合過程中起到的穩定作用大小。復合物ERα-羅漢松脂酚、ERα-開環異落葉松脂酚、ERβ-羅漢松脂酚和ERβ-開環異落葉松脂酚的關鍵氨基酸的數目(依次為13、13、12、12)多于復合物ERα-腸內脂、ERα-腸二醇、ERβ-腸內脂和ERβ-腸二醇中關鍵氨基酸的數目(依次為9、8、11、10)。因此,前四種復合物比后四種復合物更穩定。
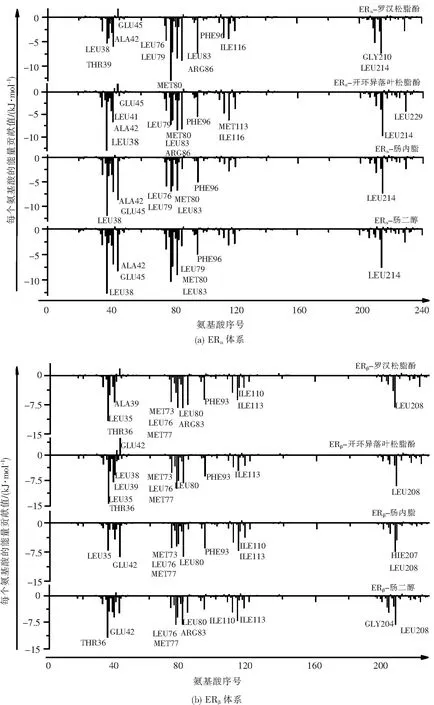
圖7 氨基酸對結合自由能的貢獻
對關鍵氨基酸進一步能量分解的結果見圖8,在此過程中將自由能分解為極性部分(圖中條紋部分)和非極性部分(圖中黑色部分)。其中LEU38、ALA42、LEU79、MET80、LEU83、PHE96和LEU214等非極性氨基酸對結合自由能的貢獻大于極性氨基酸如GLU45、ARG86等的貢獻。并且非極性部分主要是范德華能貢獻,能量為負值,進一步證實疏水相互作用是配體與受體之間結合產生的主要相互作用。然而極性部分中的極性溶劑化能的貢獻值為正值,導致極性部分對總結合自由能的貢獻減小,發揮的作用減弱。因此,非極性作用更有利于復合物的形成。
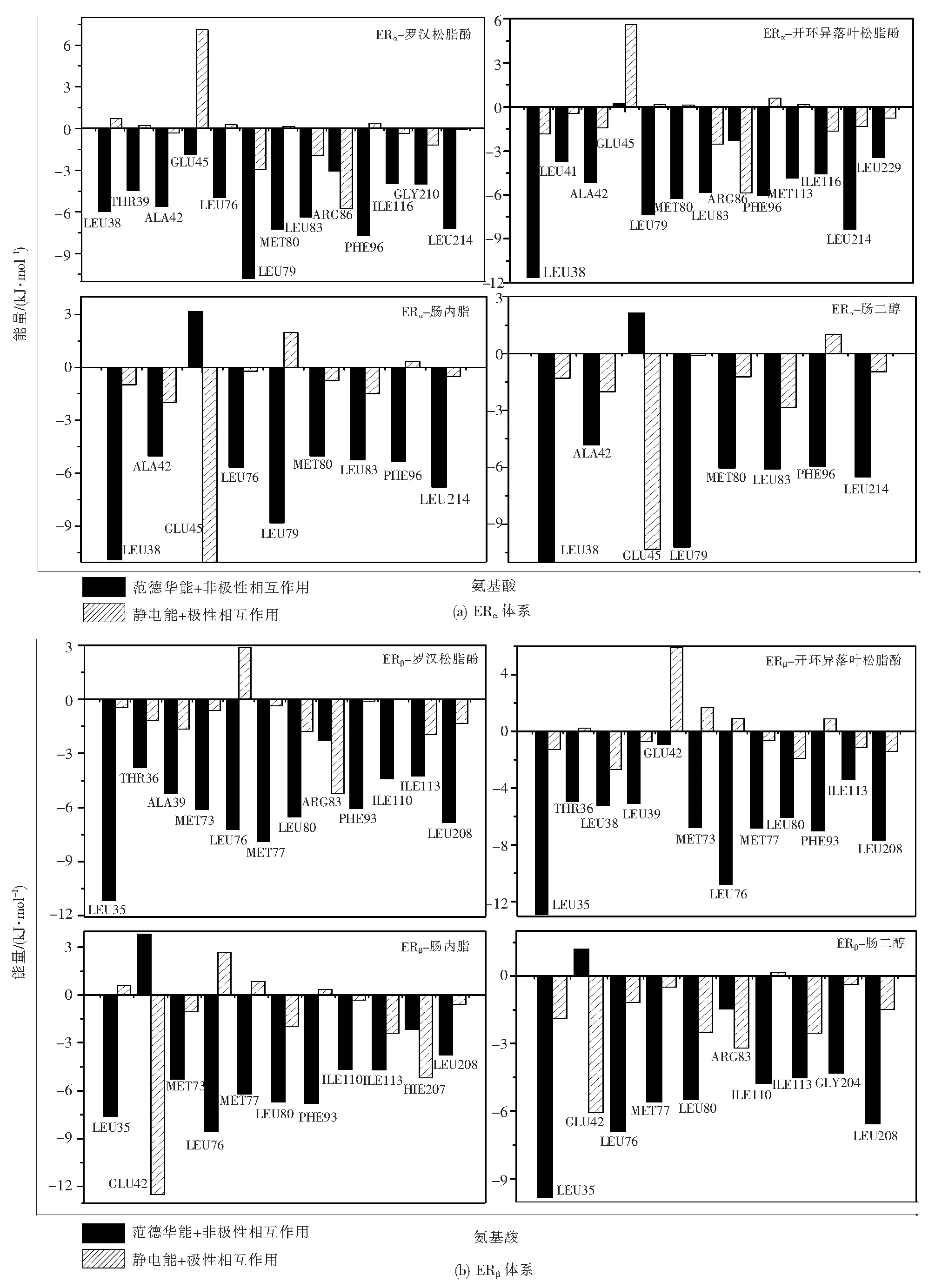
圖8 關鍵氨基酸的能量分析
3 結 論
本文用分子動力學方法研究了四種木脂素類植物雌激素與ERα及ERβ的結合親和力。氫鍵、疏水相互作用分析以及結合自由能的分析結果表明,四種香豆素類植物雌激素對ERβ的結合親和力均高于對ERα的,且植物木脂素(羅漢松脂酚和開環異落葉松脂酚)對兩種ER受體的結合親和力均高于動物木脂素(腸內脂和腸二醇)對ER的結合親和力。自由能分解結果說明非極性相互作用更有利于配體與受體的結合。

