燕麥根腐病病原真菌分離鑒定及致病性研究
楊琰珊,姚拓,張建貴,白潔,撖冬榮,李琦,李昌寧,董凱,付衛(wèi)剛
(甘肅農(nóng)業(yè)大學(xué)草業(yè)學(xué)院/草業(yè)生態(tài)系統(tǒng)教育部重點(diǎn)實(shí)驗(yàn)室/甘肅省草業(yè)工程實(shí)驗(yàn)室/中-美草地畜牧業(yè)可持續(xù)發(fā)展研究中心,甘肅 蘭州 730070)
燕麥(Avenasativa)屬禾本科(Gamineae)燕麥屬(Avena)一年生糧飼兼用草本作物[1-2];具有較強(qiáng)的抗逆性與適應(yīng)性,在世界各地皆有分布[3]。燕麥富含蛋白質(zhì)、維生素、脂肪等多種營養(yǎng)成分,營養(yǎng)價值較高[4];可調(diào)節(jié)血脂、改善血液循環(huán),具有獨(dú)特的醫(yī)療保健功能;其莖稈、葉柔嫩多汁,難以消化的纖維含量低,是農(nóng)牧區(qū)的優(yōu)良牧草,在畜牧業(yè)發(fā)展中占有舉足輕重的地位[5]。病害是飼用作物生產(chǎn)的主要限制因素之一,能影響作物的產(chǎn)量與品質(zhì)[6];燕麥病害在我國及世界燕麥種植區(qū)普遍發(fā)生,影響燕麥產(chǎn)業(yè)的健康穩(wěn)定發(fā)展。
目前我國對于燕麥病害的研究多集中于燕麥植株地上病害,如由禾本科布氏白粉菌(Blumeriagraminis)引起的白粉病[7]、大麥堅(jiān)黑粉菌(Ustilagohordei)引起的堅(jiān)黑穗病[8-9]、燕麥內(nèi)平臍蠕孢(Drechsleraavenacea)與細(xì)交鏈孢(Alternariaalternata)引起的葉斑病[10]、大麥黃矮病毒(Barley yellow dwarf virus)引起的紅葉病[11]等。但對燕麥根腐病的研究相對較少,燕麥根腐病是一種常見的土傳病害,該病主要由病原真菌引起;發(fā)病初期僅有個別須根感病出現(xiàn)病斑,植株不表現(xiàn)明顯癥狀;后期隨根部腐爛程度加劇,導(dǎo)致吸收水分與養(yǎng)分功能減弱,地上部分出現(xiàn)葉片發(fā)黃、萎蔫、枯萎等癥狀,嚴(yán)重時甚至死亡。根腐病病原主要以菌絲體或孢子形式在病殘?bào)w和土壤中越冬,成為翌年主要初侵染源,從植株根莖處或根部傷口處侵入,通過灌溉水或雨水進(jìn)行傳播與蔓延[12]。
根腐病對多種植物有較強(qiáng)的危害性,研究發(fā)現(xiàn):小麥根腐病能使小麥減產(chǎn)15%~25%,嚴(yán)重地塊則能減產(chǎn)30%~70%[13];李雪萍[14]在甘肅省甘南州和青海省等青稞種植區(qū)調(diào)查發(fā)現(xiàn),青稞根腐類病害的田間發(fā)病率均在5%~20%[14];三七、白術(shù)、黃芪等以地下部位作藥用的植物受根腐病危害較大,嚴(yán)重影響其藥用價值與經(jīng)濟(jì)價值[15]。根腐病病原多樣,且不同作物致病菌與致病菌的致病性存在差異,優(yōu)勢病原也不盡相同。研究發(fā)現(xiàn):小麥根腐病病原為麥根腐平臍蠕孢[13](Bipolarissorokiniana)、黃色鐮刀菌(Fusariumculmorum)、禾谷鐮刀菌(F.graminearum)、假禾谷鐮刀菌(F.pseudograminearum)與木賊鐮刀菌(F.equiseti)[16],其中麥根腐平臍蠕孢為優(yōu)勢病原,其致病力與菌落顏色深淺有關(guān),顏色越深致病力越強(qiáng)[17],黃色鐮刀與禾谷鐮刀在多地均有分離,且致病力較強(qiáng)[18]。青稞莖基腐病病原為燕麥鐮刀菌(F.avenaceum)、木賊鐮刀菌(F.equiseti)、銳頂鐮刀菌(F.a(chǎn)cuminatum)、柔毛鐮刀菌(F.flocciferum)和F.langsethiae[13],其中麥根腐平臍蠕孢、燕麥鐮刀菌和木賊鐮刀菌的致病力較強(qiáng)[14]。辣椒根腐病的主要致病菌為半裸鐮刀菌(F.semitectum)、尖孢鐮刀菌(F.oxysporum)、輪枝鐮刀菌(F.verticillioides)和茄病鐮刀菌(F.solani),其中尖孢鐮刀與茄病鐮刀為優(yōu)勢病原且致病性較強(qiáng),病情指數(shù)分別為67.22和66.27[19]。此外,我國對草莓[20]、苜蓿[21]、白及[22]、黃芪[23]等植物根腐病病原皆有研究。
我國對燕麥根腐病的研究見南志標(biāo)[24]在《中國牧草真菌病害名錄》中對燕麥根腐病病原名稱有簡單報(bào)道,且具體分布及致病力強(qiáng)弱不詳。鑒于此,以燕麥根腐病病株為材料,對其病原菌進(jìn)行分離、鑒定及致病性測定,以期明確燕麥根腐病病原菌種類,為燕麥根腐病的診斷和防治提供依據(jù)。
1 材料和方法
1.1 材料來源
將采集于甘肅省通渭縣華家?guī)X燕麥主產(chǎn)區(qū)的燕麥根腐病病株帶回實(shí)驗(yàn)室進(jìn)行病原真菌分離鑒定及致病性測定,以確定燕麥根腐病的致病菌。
1.2 病原真菌的分離純化
采用組織分離法[25],將燕麥根腐病病株根部病健交界處剪成0.5 cm的小段,將小段經(jīng)75%酒精浸泡30 s后,放入1%次氯酸鈉中浸泡5 min,用無菌水多次沖洗,最后接于PDA培養(yǎng)基,25℃恒溫培養(yǎng),待長出菌絲后挑取菌落邊緣處的菌絲接于新的PDA培養(yǎng)基上進(jìn)行純化,反復(fù)多次,待純化好后,將菌株轉(zhuǎn)接于PDA試管斜面,保存于4℃培養(yǎng)箱待用。
1.3 致病性測定
采用水瓊脂平皿法[26]對分離真菌進(jìn)行致病性測定,用柯赫氏法則驗(yàn)證。
挑選顆粒飽滿、大小一致的燕麥種子,經(jīng)75%酒精消毒30 s后,再用1%次氯酸鈉消毒8 min,用無菌水反復(fù)沖洗干凈,待用。
制備WA(水瓊脂)培養(yǎng)基:瓊脂12 g,水1 L,分別裝入1 L三角瓶中,121℃高壓滅菌30 min,倒入培養(yǎng)皿中,待用。
將培養(yǎng)好的真菌打成菌餅,接入準(zhǔn)備好的WA培養(yǎng)基中心位置,將經(jīng)消毒的燕麥種子均勻擺放于菌餅周圍,且與菌餅保持一定距離;每株培養(yǎng)皿內(nèi)擺放10粒燕麥種子,每個真菌做3個重復(fù),以不接菌作為對照;置于25℃光照培養(yǎng)箱中,8 d后統(tǒng)計(jì)發(fā)病情況,測定發(fā)病率與病情指數(shù)[26]。病害指數(shù)分級標(biāo)準(zhǔn)[26]見表1。
發(fā)病率=(發(fā)病株數(shù)/總株數(shù))×100%
病情指數(shù)=100×∑(各級發(fā)病指數(shù)×各級代表值)/(調(diào)查總植株數(shù)×最高級代表值)
從發(fā)病植株根部再次分離病原菌,并與初接種的分離真菌做對比,確定分離真菌是否為致病菌。

表1 病害指數(shù)分級標(biāo)準(zhǔn)[26]
1.4 病原真菌的形態(tài)學(xué)觀察
將前期分離純化好保存于試管斜面的菌株接于PDA培養(yǎng)基,觀察其菌落形態(tài)、菌絲疏密情況、是否產(chǎn)生色素及色素顏色。挑取少量菌絲,制作臨時玻片,用無菌水做浮載劑;將做好的臨時玻片置于光學(xué)顯微鏡下,觀察分生孢子的形狀及大小、產(chǎn)孢細(xì)胞及厚垣孢子有無,并拍照。根據(jù)病原真菌形態(tài)特征,參照《真菌鑒定手冊》[27]及《鐮刀菌屬》[28]等資料進(jìn)行形態(tài)學(xué)鑒定。
1.5 分子生物學(xué)鑒定
1.5.1 基因組DNA提取 采用Omega真菌DNA基因組試劑盒提取真菌DNA,將培養(yǎng)好的真菌菌絲置于研缽中加入液氮進(jìn)行研磨,研磨后按試劑盒提供的方法步驟進(jìn)行操作。將提取的DNA置于-20℃冰箱中保存,待用。
1.5.2 PCR擴(kuò)增及測序 用真菌通用引物ITS1/ITS4進(jìn)行PCR擴(kuò)增。反應(yīng)條件為:94℃預(yù)變性5 min;94℃變性30 s,53℃退火30 s,72℃延伸1 min,35個循環(huán),72℃延伸10 min。將PCR擴(kuò)增產(chǎn)物取出5 μL,再用1%的瓊脂糖凝膠進(jìn)行電泳檢測,隨后將PCR產(chǎn)物送往公司進(jìn)行測序。
1.5.3 系統(tǒng)發(fā)育樹構(gòu)建 將測序獲得的序列在NCBI上進(jìn)行BLAST比對,從GenBank數(shù)據(jù)庫中選出最相近的序列進(jìn)行同源性比較;用Mega 7.0軟件構(gòu)建基于ITS的系統(tǒng)發(fā)育樹,確定分離菌株與所選菌株的親緣關(guān)系。
2 結(jié)果與分析
2.1 病原真菌的分離純化
選取具有代表性的5株真菌,這5株真菌分離頻率較高,分別命名為Y2、Y5、Y13、Y18、Y31。
2.2 致病性測定
采用水瓊脂平皿法對5株真菌進(jìn)行致病性測定,發(fā)現(xiàn)5株真菌均能使燕麥致病。其中Y5、Y18及Y31的發(fā)病率均為100%,Y2與Y13發(fā)病率分別為80.00%和96.67%。病情指數(shù)由高至低依次為:Y5(79.67%)>Y31(74.33%)>Y18(71.67%)>Y13(60.00%)>Y2(47.00%)(表2,圖1)。將每個處理發(fā)病根部進(jìn)行病原菌再分離,并與初接菌做對比,發(fā)現(xiàn)再分離菌與初接菌為同一種菌,符合柯赫氏法則;因此,Y2、Y5、Y13、Y18、Y31為燕麥根腐病的致病菌(圖2)。
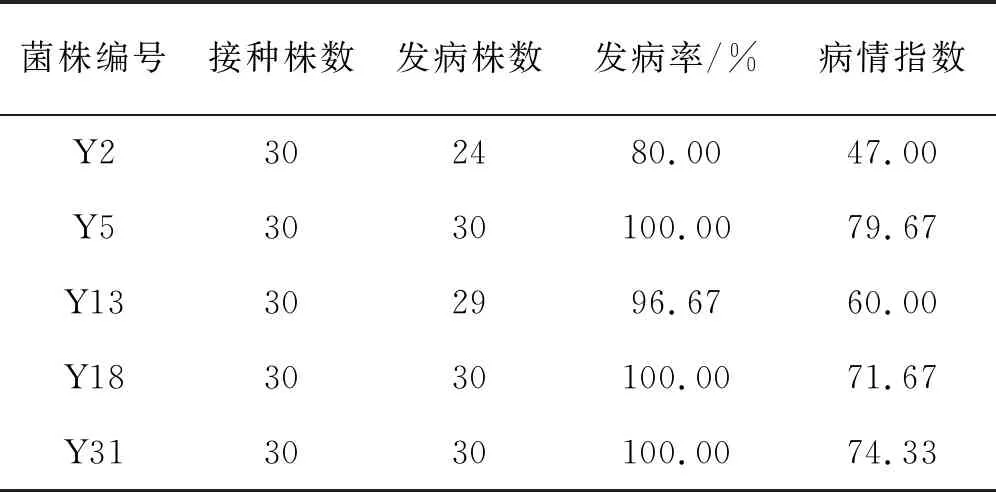
表2 分離真菌的致病性測定
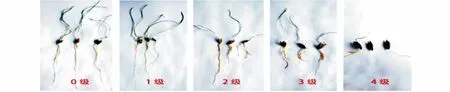
圖1 病害指數(shù)分級Fig.1 Classification of disease index
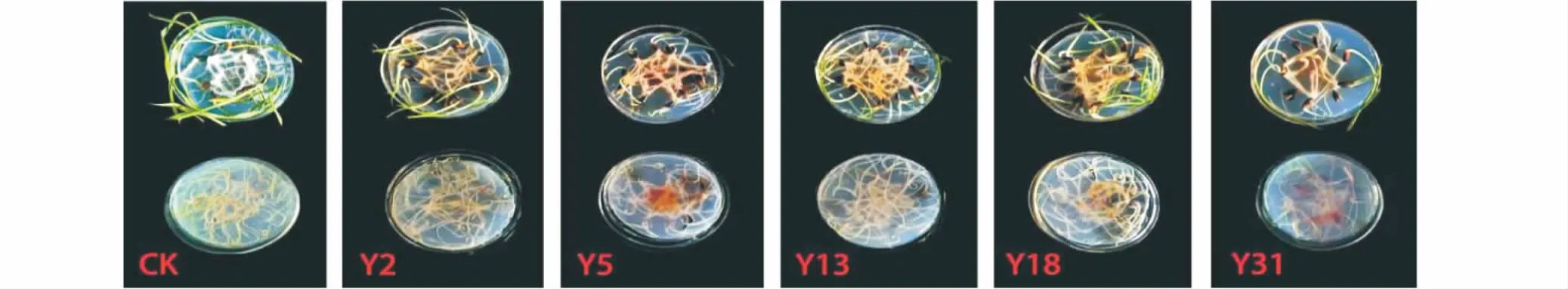
圖2 平皿法致病性測定Fig.2 Plate method for pathogenicity determination
2.3 病原真菌鑒定
2.3.1 菌株Y2的鑒定 菌株Y2在PDA培養(yǎng)基菌絲呈白色,生長一段時間后邊緣呈蠟黃色,羊絨狀(圖3-A),菌落背面呈土黃色(圖3-B),邊緣整齊。大型分生孢子呈馬特型,頂細(xì)胞稍彎,兩端較鈍,通常有2~5個隔膜,大多數(shù)為3隔,量度為(25.34~36.42) μm×(4.67~5.21) μm;小型分生孢子呈卵形或橢圓形,0~1個隔膜,量度為(6.05~14.37) μm×(2.75~4.36) μm;產(chǎn)孢細(xì)胞為單瓶梗產(chǎn)孢且瓶梗較長;厚垣孢子為球形,通常對生或串生(圖3-C~F)。根據(jù)形態(tài)特征將Y2初步鑒定為茄病鐮刀菌(F.solani)。
菌株Y2經(jīng)DNA提取、ITS引物擴(kuò)增測序后,通過Gen-Bank數(shù)據(jù)庫對菌株Y2的堿基序列同已知物種序列進(jìn)行同源性比對,結(jié)果表明Y2與數(shù)據(jù)庫中Fusariumsolani(登錄號為MH517680)序列同源性為100%。進(jìn)一步構(gòu)建基于ITS的系統(tǒng)發(fā)育樹,進(jìn)行系統(tǒng)進(jìn)化分析,結(jié)果表明菌株Y2與Fusariumsolani(登錄號為MH517680)聚為同一支,且自展值為99%(圖4);結(jié)合形態(tài)學(xué)特征將Y2鑒定為茄病鐮刀菌(Fusariumsolani)。
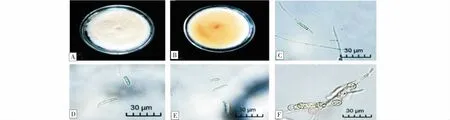
圖3 Y2的形態(tài)特征Fig.3 Morphological characteristics of Y2注:A:在PDA上菌落的正面形態(tài);B:在PDA上菌落的背面形態(tài);C:小型分生孢子與分生孢子梗;D、E:分生孢子;F:厚垣孢子
2.2.2 菌株Y5的鑒定 菌株Y5在PDA培養(yǎng)基氣生菌絲呈粉白色,中間為黃色,生長速度較快,菌絲較長,羊毛狀(圖5-A);菌落背面初期呈紅色,邊緣為白色,后期呈深紅色(圖5-B);邊緣整齊。未見小型分生孢子;大型分生孢子為鐮刀型,直且細(xì)長,4~6個隔膜,多為5個,足細(xì)胞明顯,頂細(xì)胞較細(xì),量度為(40.25~58.73) μm×(3.52~5.64) μm,單瓶梗產(chǎn)孢;厚垣孢子較少,一般間生(圖5-C~F)。根據(jù)形態(tài)特征將Y5初步鑒定為禾谷鐮刀菌(F.graminearum)。
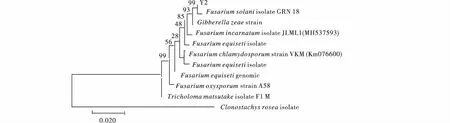
圖4 基于ITS構(gòu)建Y2系統(tǒng)發(fā)育樹Fig.4 Construction of Y2 phylogenetic tree based on ITS注:分支上的數(shù)據(jù)表示Bootstrap檢驗(yàn)的支持百分率,括號內(nèi)為GenBank序列號;圖中標(biāo)尺代表位點(diǎn)的堿基替代率,下同
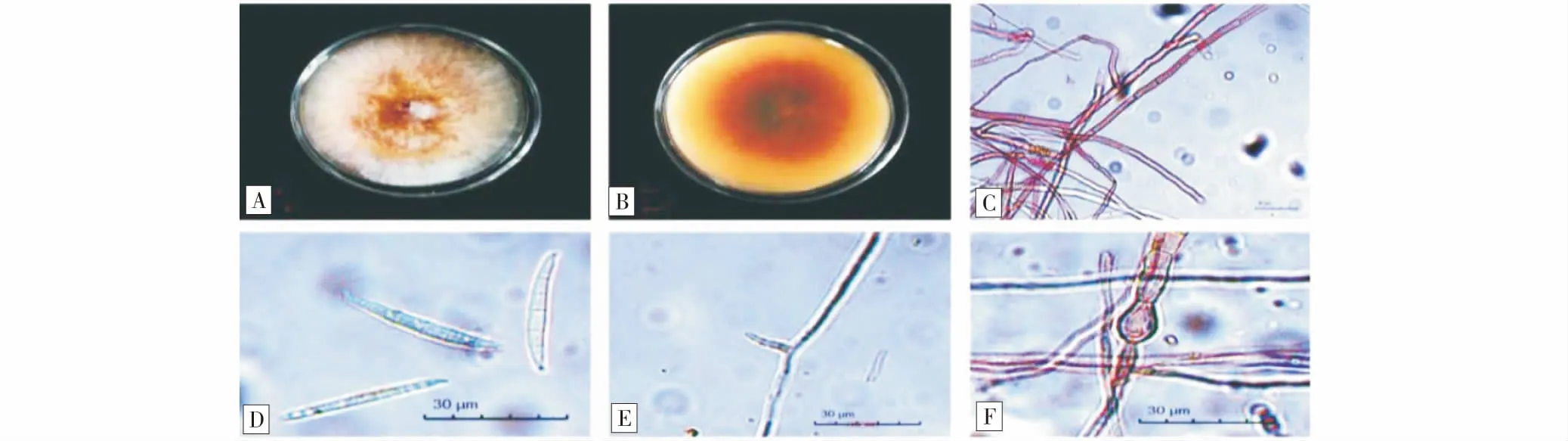
圖5 Y5的形態(tài)特征Fig.5 Morphological characteristics of Y5
菌株Y5經(jīng)DNA提取、ITS引物擴(kuò)增測序后;通過Gen-Bank數(shù)據(jù)庫對菌株Y5的堿基序列同已知物種序列進(jìn)行同源性比對,結(jié)果表明Y5與數(shù)據(jù)庫中F.graminearum(登錄號為MF800905)序列同源性為100%。進(jìn)一步構(gòu)建基于ITS的系統(tǒng)發(fā)育樹,進(jìn)行系統(tǒng)進(jìn)化分析,結(jié)果表明菌株Y5與F.graminearum(登錄號為MF800905)聚為同一支,且自展值為97%(圖6);結(jié)合形態(tài)學(xué)特征將Y5鑒定為禾谷鐮刀菌(F.graminearum).
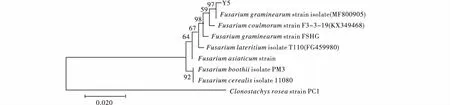
圖6 基于ITS構(gòu)建Y5系統(tǒng)發(fā)育樹Fig.6 Construction of Y5 phylogenetic tree based on ITS
2.2.3 菌株Y13的鑒定 菌株Y13在PDA培養(yǎng)基上菌絲呈白色或淡粉色,中間帶有紫色,棉絮狀(圖7-A);菌落背面初期呈紫色,邊緣為白色,后期為深紫色(圖7-B);邊緣整齊。小型分生孢子呈卵形或紡錘形,數(shù)量較多,常串生或假頭狀著生,0~1個隔膜,量度為(3.17~14.76) μm×(1.85~3.32) μm。產(chǎn)孢細(xì)胞為復(fù)瓶梗產(chǎn)孢,大型分生孢子不易產(chǎn)生,2~4隔,量度為(18.54~20.36) μm×(3.12~4.50) μm;無厚垣孢子產(chǎn)生(圖7-C~F)。根據(jù)形態(tài)特征將Y13初步鑒定為串珠鐮刀菌(F.moniliformi)。
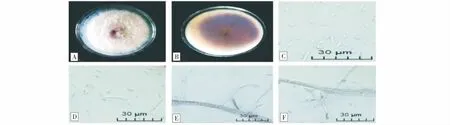
圖7 Y13的形態(tài)特征Fig.7 Morphological characteristics of Y13注:A、B:在PDA培養(yǎng)基上的正反面;C:小型分生孢子;D:大、小型分生孢子;E:小型分生孢子串狀著生;F:產(chǎn)孢細(xì)胞
菌株Y13經(jīng)DNA提取、ITS引物擴(kuò)增測序后,通過Gen-Bank數(shù)據(jù)庫對菌株Y13的堿基序列同已知物種序列進(jìn)行同源性比對,結(jié)果表明Y13與數(shù)據(jù)庫中Gibberellamoniliformi(登錄號為JF499683)序列同源性為99%。進(jìn)一步構(gòu)建基于ITS的系統(tǒng)發(fā)育樹,進(jìn)行系統(tǒng)進(jìn)化分析,結(jié)果表明菌株Y13與G.moniliformi(登錄號為JF499683)聚為同一支,且自展值為92%(圖8);G.moniliformi是串珠鐮刀菌(F.moniliformi)有性時期的名稱,因此,結(jié)合形態(tài)學(xué)特征將Y13鑒定為串珠赤霉菌(G.moniliformi)。

圖8 基于ITS構(gòu)建Y13系統(tǒng)發(fā)育樹Fig.8 Construction of Y13 phylogenetic tree based on ITS
2.3.4 菌株Y18的鑒定 菌株Y18在PDA培養(yǎng)基上,菌絲為粉白色,略帶淺粉色,氈狀(圖9-A),菌落背面呈深紅色(圖9-B),邊緣整齊。大型分生孢子較多,呈鐮刀型,細(xì)長,兩端較尖,3~6個隔膜,量度為(22.59~48.83) μm×(2.65~4.86) μm。小型分生孢子為卵形、棒形或長橢圓形,可假頭狀著生,1~2個隔膜,量度為(7.85~18.05) μm×(1.57~3.37) μm(圖9-C~圖9-E)。厚垣孢子為球形,常串生(圖9-E)。根據(jù)形態(tài)特征將Y18初步鑒定為鐮刀菌。
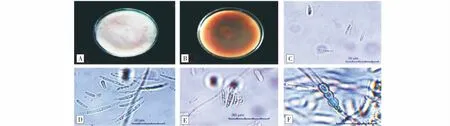
圖9 Y18的形態(tài)特征Fig.9 Morphological characteristics of Y18注:A、B:在PDA培養(yǎng)基上的正反面;C:小型分生孢子;D:大型分生孢子;E:小型分生孢子假頭狀著生;F:厚垣孢子
菌株Y18經(jīng)DNA提取、ITS引物擴(kuò)增測序后,通過Gen-Bank數(shù)據(jù)庫對菌株Y18的堿基序列同已知物種序列進(jìn)行同源性比對,結(jié)果表明Y18與數(shù)據(jù)庫中G.acuminata(登錄號為EF531234)序列同源性為99%。進(jìn)一步構(gòu)建基于ITS的系統(tǒng)發(fā)育樹,進(jìn)行系統(tǒng)進(jìn)化分析,結(jié)果表明菌株Y18與G.acuminata(登錄號為EF531234)聚為同一支,且自展值為81%(圖10);有些鐮刀菌的有性時期為赤霉菌,因此,結(jié)合形態(tài)學(xué)特征將Y18鑒定為G.acuminata。
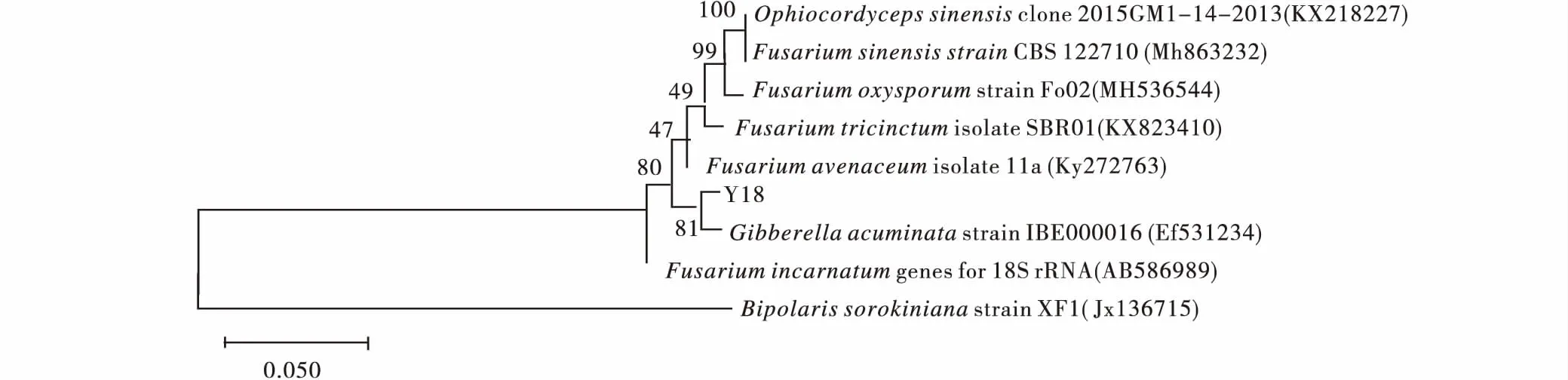
圖10 基于ITS構(gòu)建Y18系統(tǒng)發(fā)育樹Fig.10 Construction of Y18 phylogenetic tree based on ITS
2.3.5 菌株Y31的鑒定 菌株Y31在PDA培養(yǎng)基上氣生菌絲從中間向邊緣由粉色漸變?yōu)榘咨扌鯛?圖11-A);菌落背面為紅色或紅褐色,顏色由中間向邊緣逐漸變淺(圖11-B);邊緣不整齊。大型分生孢子呈線型,直且細(xì)長,4~7個隔膜,多為5隔,量度為(30.06~44.41) μm×(3.51~5.24) μm。未看到小型分生孢子和厚垣孢子(圖11-C,圖11-D)。根據(jù)形態(tài)特征將Y31初步鑒定為燕麥鐮刀菌(F.avenaceum)。

圖11 Y31的形態(tài)特征Fig.11 Morphological characteristics of Y31注:A、B:在PDA培養(yǎng)基上的正反面;C、D:大型分生孢子
菌株Y31經(jīng)DNA提取、ITS引物擴(kuò)增測序后;通過Gen-Bank數(shù)據(jù)庫對菌株Y31的堿基序列同已知物種序列進(jìn)行同源性比對,結(jié)果表明Y31與數(shù)據(jù)庫中F.avenaceum(登錄號為EF531234)序列同源性為100%。進(jìn)一步構(gòu)建基于ITS的系統(tǒng)發(fā)育樹,進(jìn)行系統(tǒng)進(jìn)化分析,結(jié)果表明菌株Y31與F.avenaceum(登錄號為EF531234)聚為同一支,且自展值為80%(圖12);因此,結(jié)合形態(tài)學(xué)特征將Y31鑒定為燕麥鐮刀菌(F.avenaceum)。
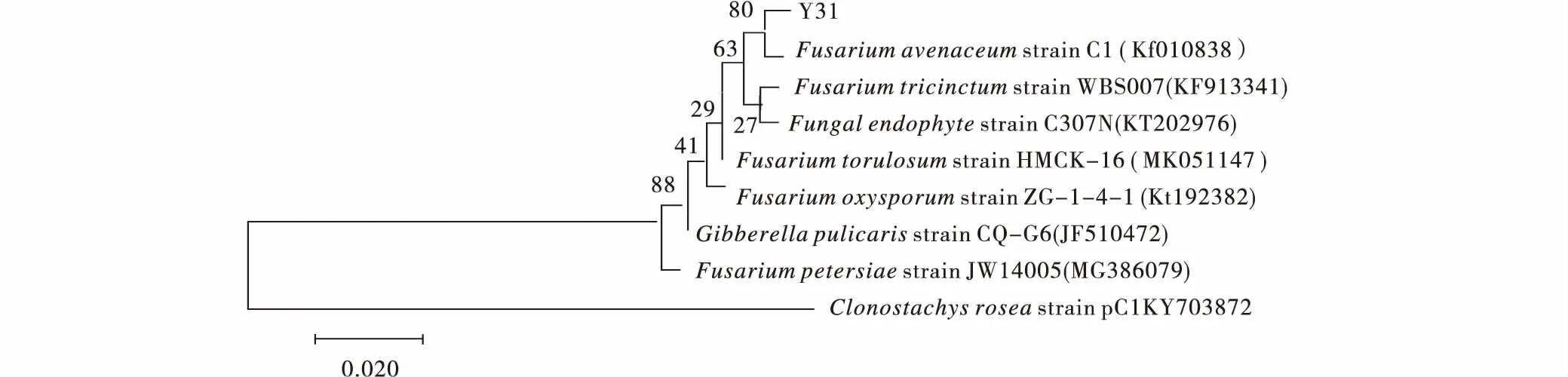
圖12 基于ITS構(gòu)建Y31系統(tǒng)發(fā)育樹Fig.12 Construction of Y31 phylogenetic tree based on ITS
3 討論
本研究從燕麥根腐病病株中分離并選取5株具有代表性的真菌,經(jīng)致病性測定,分離菌株Y2、Y5、Y13、Y18、Y31均能使燕麥根部變色;對變色根部進(jìn)行病原菌再分離,其形態(tài)特征與初接菌相一致,符合柯赫氏法則;即Y2、Y5、Y13、Y18、Y31為燕麥根腐病致病菌。采用傳統(tǒng)分類方法鑒定真菌有一定難度和不確定性;而分子生物學(xué)鑒定方法可以彌補(bǔ)傳統(tǒng)分類鑒定方法中的不足,對病原菌進(jìn)行快速準(zhǔn)確的鑒定[29-30]。rDNA-ITS是介于18S rDNA、5.8S rDNA和28S rDNA之間的區(qū)域,該區(qū)域進(jìn)化速度較編碼區(qū)快,被普遍用來進(jìn)行真菌種間或種內(nèi)遺傳相似性的分子系統(tǒng)研究[31-32];具有高度保守性,是鑒定真菌較好的輔助手段[33]。本研究通過形態(tài)學(xué)特征與rDNA-ITS序列分析相結(jié)合,分別將Y2、Y5、Y13、Y18、Y31鑒定為茄病鐮刀菌、禾谷鐮刀菌、串珠赤霉菌、G.acuminata、燕麥鐮刀菌。在我國僅有南志標(biāo)[24]對燕麥根腐病病原做了簡單的名稱報(bào)道,報(bào)道燕麥鐮刀菌、大刀鐮刀菌(F.culmorum)、禾谷鐮刀菌、雪腐鐮刀菌(F.nivale)、長直喙鐮刀菌(F.orthoceras)、早熟禾鐮刀菌(F.poae)、藤草鐮刀菌(F.scripi)為燕麥根腐病病原,本研究從燕麥病株中只分離出燕麥鐮刀菌和禾谷鐮刀菌,而對于所報(bào)道的其余5種鐮刀菌未曾分離。其原因可能是不同地區(qū)、不同菌株的生存環(huán)境不同所致。此外,本研究發(fā)現(xiàn)茄病鐮刀菌、串珠赤霉菌、G.acuminata引起燕麥根腐病為國內(nèi)首次報(bào)道。
本研究通過致病性試驗(yàn),明確了各菌株的致病性,特別是Y5(禾谷鐮刀菌),對燕麥致病力最強(qiáng),發(fā)病率為100%,病情指數(shù)為79.67。禾谷鐮刀菌是玉米苗期根病和小麥赤腐病的主要致病菌,對玉米和小麥致病力較強(qiáng)[34-35];這與本研究結(jié)論相一致。原因可能是:禾谷鐮刀菌在侵染和擴(kuò)展過程中可分泌產(chǎn)生細(xì)胞壁降解酶類,這些酶可降解植物細(xì)胞壁中的多聚碳水化合物,離解細(xì)胞壁,破壞原生質(zhì),毀壞整個細(xì)胞結(jié)構(gòu)[36];此外,禾谷鐮刀菌可產(chǎn)生單端孢霉烯毒素,其主要組分是脫氧雪腐鐮刀菌烯醇,它能抑制核酸復(fù)制與蛋白質(zhì)合成,抑制線粒體功能,破壞細(xì)胞膜完整性,抑制種子萌發(fā)、根系生成、根莖及愈傷組織的生長[37]。Y18(G.acuminata)與Y31(燕麥鐮刀菌)對燕麥致病力較強(qiáng),病情指數(shù)分別為71.67和74.33,朱海霞[38]研究發(fā)現(xiàn)燕麥鐮刀菌能使野燕麥、小麥及青稞中度感病,使蠶豆、豌豆、油菜輕度或不感病;原因可能是禾本科植物根際能夠分泌某種物質(zhì)誘導(dǎo)燕麥鐮刀菌入侵,使其對禾本科作物致病力較強(qiáng),而對其他作物無致病性或致病力較弱。Y2(茄病鐮刀)與Y13(串珠赤霉)使燕麥病情指數(shù)分別為47.00與60.00,茄病鐮刀菌為多種植物根腐病的優(yōu)勢病原,但其致病力相對較弱或?yàn)橹械萚21];串珠赤霉菌是甘蔗梢腐病與水稻惡苗病的主要病原,對甘蔗和水稻致病力較強(qiáng)[39],與本結(jié)論相一致,這可能與它自身產(chǎn)生串珠鐮刀菌素、伏馬菌素及鐮刀菌酸等多種毒素[40]有關(guān)。此外,本研究采用水瓊脂平皿法測定其致病性,有研究發(fā)現(xiàn)分別采用水瓊脂法與盆栽法測定菌株致病性,前者高于后者,但發(fā)病率及致病性趨勢一致[14];但也有研究發(fā)現(xiàn)兩者并無差異[19]。由于存在差異性,后期將通過盆栽法驗(yàn)證其致病性。根腐病病原種類復(fù)雜,常由多種病原菌復(fù)合侵染引起病害,本研究僅采用單一菌株接種燕麥種子進(jìn)行致病性測定,為更深入了解燕麥根腐病的發(fā)病機(jī)制,需利用多種致病菌同時接種開展進(jìn)一步研究。
近年來,研究者針對植物根腐病的生物防治已有相關(guān)研究,主要通過利用有機(jī)肥、植物提取液或生防菌等手段對根腐病致病菌菌絲進(jìn)行生長抑制[23]。本研究后期已篩選出對燕麥根腐病致病菌有生防作用的細(xì)菌,由于植物真菌病害是影響農(nóng)業(yè)發(fā)展的主要問題[41],因此,本研究為后續(xù)對燕麥根腐病防治研究奠定了基礎(chǔ)。
4 結(jié)論
(1)結(jié)合形態(tài)學(xué)和分子生物學(xué)的鑒定,Y2為茄病鐮刀菌(F.solan)、Y5為禾谷鐮刀菌(F.gramineae)、Y13為串珠赤霉菌(G.moniliformi)、Y18為G.acuminata、Y31為燕麥鐮刀菌(F.avenaceum)。
(2)茄病鐮刀菌、G.acuminata、串珠赤霉菌引起燕麥根腐病為國內(nèi)首次報(bào)道。
(3)水瓊脂平皿法致病性測定表明5株菌均能使燕麥致病,且禾谷鐮刀菌致病力最強(qiáng),病情指數(shù)為79.69。

