NaCl脅迫對紫花苜蓿種子萌發,幼苗生長及生理特性的影響
苗涵,王魯北,王振南,李富寬,王慧,楊燕,呂慎金
(1.臨沂大學農林科學學院,山東 臨沂 276000;2.臨沂市城市管理綜合服務中心,山東 臨沂 276000;3.臨沂市農業科學院,山東 臨沂 276012)
土壤鹽漬化是我國面臨的主要環境問題[1]。據統計,我國鹽土面積為1 600萬hm2(不包括濱海灘涂),并呈不斷擴大的趨勢。因此,改良利用鹽堿地對于發展現代農業生產具有重要意義。紫花苜蓿(Medicagosativa)是一種在世界上廣泛種植的豆科牧草,較耐鹽堿,是改良鹽堿地的理想植物[2-3]。但當鹽濃度過高時,苜蓿種子的發芽率及幼苗的成活率受到嚴重抑制[4-5],嚴重阻礙了苜蓿草地的建植。目前,已有研究報道了鹽脅迫對苜蓿種子萌發和幼苗生長的影響[5-8],所測發芽指標以及幼苗生理指標,如發芽率、發芽勢、脯氨酸含量、抗氧化酶活性等均能較好地揭示種子萌發及幼苗生長在鹽脅迫下的變化。如紫花苜蓿種子的發芽率隨鹽濃度的提高顯著下降[5];鹽脅迫下紫花苜蓿品種的相對發芽率和相對發芽勢隨著鹽濃度的升高呈降低趨勢[9];鹽脅迫引起紫花苜蓿脯氨酸含量的增加[10],但隨著鹽濃度的增加,其變化規律尚未進一步探索。另外,植物的生長是一個連續的過程,種子萌發對鹽脅迫的響應會進一步影響幼苗的生長特性[11]。因此,本研究分析了不同濃度NaCl處理下,紫花苜蓿種子的萌發及幼苗的生長隨鹽濃度增加的變化,并探討了其間的偶聯關系,以進一步揭示紫花苜蓿對鹽脅迫的響應機理。
1 材料和方法
1.1 試驗材料
紫花苜蓿品種為阿爾岡金。種子由濟南市天橋區澳荷畜牧良種銷售中心提供。
1.2 試驗方法
挑取飽滿的種子,采用0.1% KMnO4溶液消毒20 min,用清水沖洗干凈。用蒸餾水浸種12 h。采用直徑為10 cm的培養皿,培養皿中均勻鋪放2層濕潤濾紙,每皿放入100粒種子。緩慢加入不同濃度(0%、0.3%、0.6%、0.9%、1.2%、1.5%、1.8%)的NaCl溶液4 mL,0%濃度為對照。將培養皿放置在人工氣候箱中,溫度設置為25℃,光照/黑暗時間為16 h/8 h,培養7 d后統計相關萌發指標,并在第7 d稱取0.5 g全株(鮮重),測定相關生理指標。
1.3 測定指標與方法
1.3.1 種子萌發相關指標 以胚根長度為種子長度的2倍,胚芽與種子等長作為種子萌發標準,每天統計發芽的種子數后計算發芽率、發芽勢、發芽指數和活力指數。計算公式如下:
發芽率(Germination rate,GR,%)=(7 d時正常發芽的種子數/100)×100%
發芽勢(Germination potential,GP,%)=(4 d時正常發芽的種子數/100)×100%
發芽指數(Germination index,GI)=∑(Gt/Dt)
活力指數(Vigor index,VI)=GI×第7 d正常幼苗平均鮮重
式中,Dt為第t天,Gt為與Dt相應的發芽種子數。
于第7 d隨機取10株苗,用直尺測量苗長度、根長度,以稱重法稱量苗鮮重、根鮮重。將稱量完鮮重的苗與根于65℃烘干24 h,稱量苗、根干重,計算全株鮮重和干重,進而計算苗、根和全株植物的絕對含水量。每個處理均設置3個重復。
全株鮮重(g)=苗鮮重+根鮮重
全株干重(g)=苗干重+根干重
苗(或根、全株)絕對含水量(%)=[1-苗(或根、全株)干重/苗(或根、全株)鮮重]×100%
1.3.2 生理指標測定 對全株進行生理指標測定。丙二醛(MDA)含量用硫代巴比妥酸氧化比色法測定[12];可溶性糖(WSS)含量用蒽酮法測定[13];脯氨酸(Proline)含量用磺基水楊酸法測定[14];過氧化物酶(POD)活性用愈創木酚法測定[15];過氧化氫酶(CAT)活性用過氧化氫-碘量法測定[16];超氧化物歧化酶(SOD)活性用氮藍四唑光還原法測定[17];可溶性蛋白(SP)含量用考馬斯亮藍法測定[18]。
1.4 數據統計與分析
各指標測定重復3次。采用Excel 2003進行數據錄入及作圖,SPSS 17.0 One-Way ANOVA進行差異性統計分析,SPSS17.0構建相關性模型。
2 結果與分析
2.1 NaCl脅迫對發芽率、發芽勢、發芽指數和活力指數的影響
隨著NaCl濃度的升高,紫花苜蓿種子的發芽率、發芽勢、發芽指數和活力指數均呈現降低趨勢(表1)。發芽率在高濃度(1.5%和1.8%)NaCl脅迫下顯著降低(P<0.05),低濃度脅迫下不顯著(P>0.05)。但NaCl脅迫均顯著延緩了種子的發芽速度,并且隨著NaCl濃度的增加,種子發芽勢、發芽指數、活力指數均呈顯著降低的趨勢。說明NaCl脅迫對種子的萌發有抑制作用。

表1 不同濃度NaCl處理下的發芽率、發芽勢、發芽指數和活力指數
2.2 NaCl脅迫對苗高、根長和全株長的影響
隨著鹽濃度的增加,紫花苜蓿苗高、根長和全株長先增加后降低。NaCl濃度為0.3%時,苗高、根長和全株長顯著增加(P<0.05),高濃度NaCl(1.5%,1.8%)脅迫顯著降低了苗高、根長和全株長(P<0.05)。其他濃度間無顯著變化(P>0.05)(表2)。
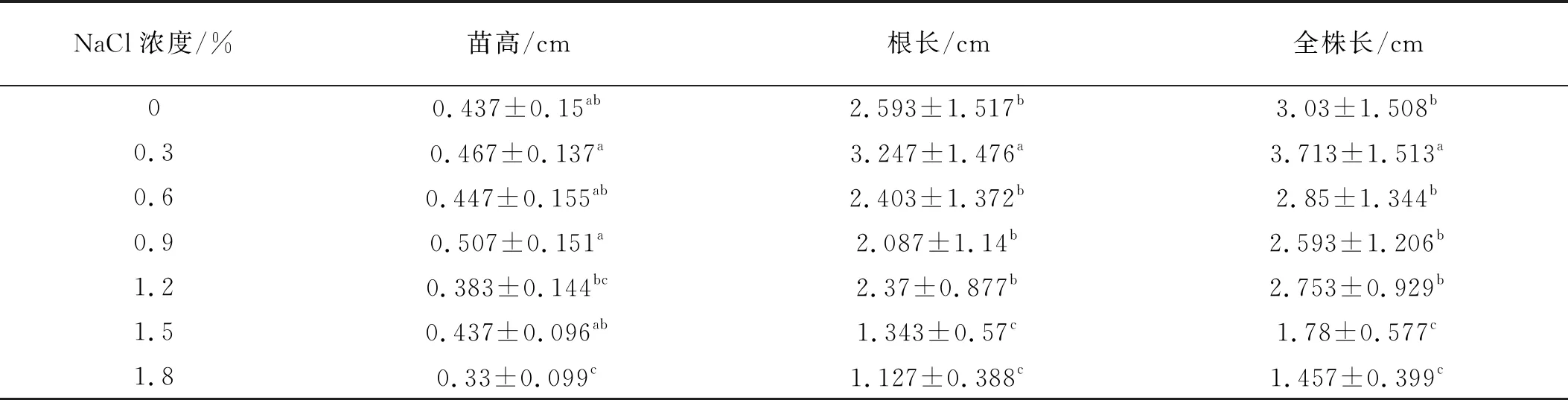
表2 不同濃度NaCl處理下的苗高、根長和全株長
2.3 NaCl脅迫對幼苗鮮重、干重及絕對含水量的影響
NaCl脅迫對紫花苜蓿鮮重、干重及絕對含水量影響顯著(P<0.05)(表3)。隨著NaCl濃度的增加,苗鮮重、全株鮮重、苗干重、全株干重呈先增加后降低的趨勢,在0.9%濃度時達到最大值;但根鮮重呈顯著降低的趨勢;根干重只在高濃度下(1.5%和1.8%)顯著降低(P<0.05);苗和全株絕對含水量呈先增加后降低的趨勢,1.2%濃度時達到最大值;但根絕對含水量呈降低趨勢。NaCl脅迫顯著降低了紫花苜蓿的根冠比(P<0.05)。
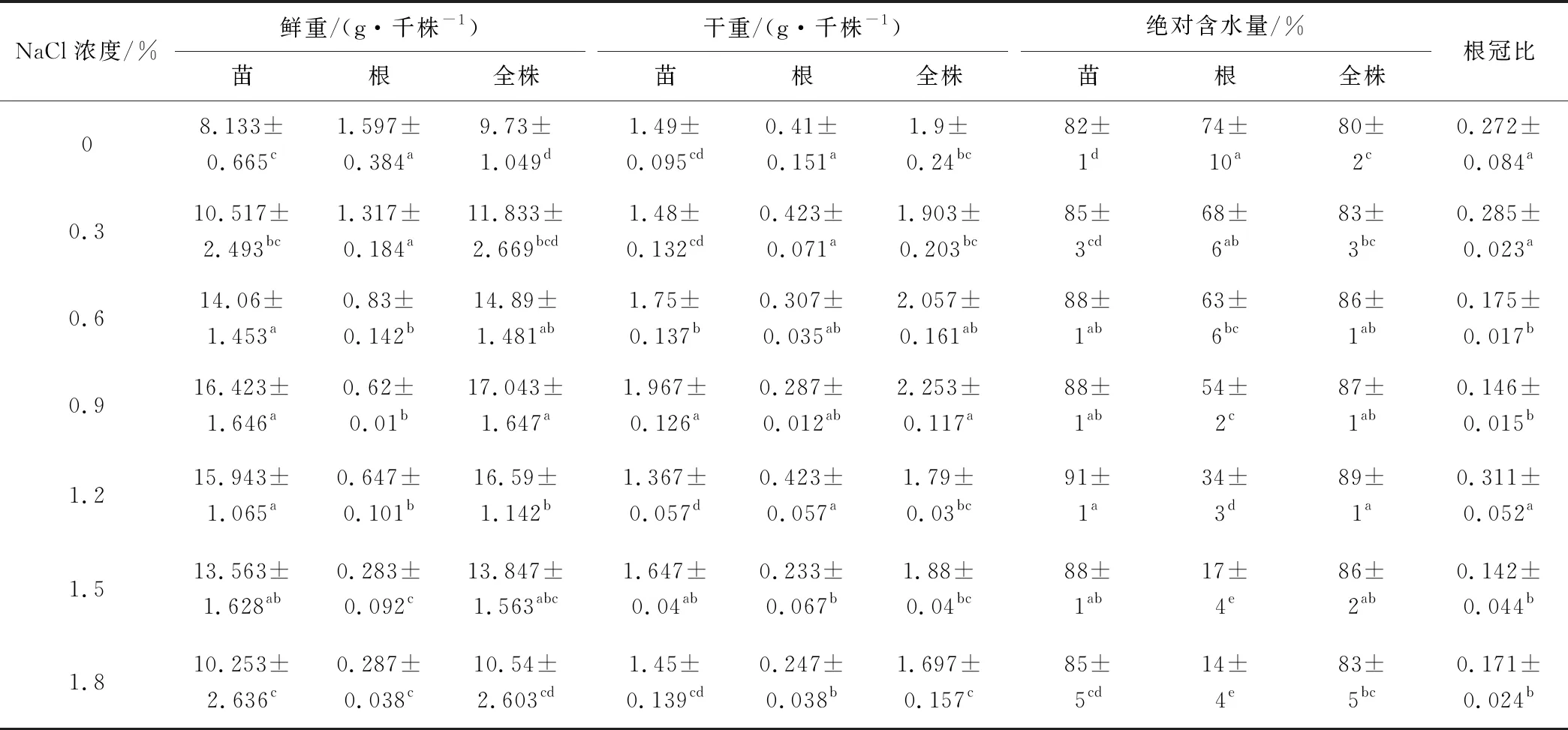
表3 不同濃度NaCl處理下的幼苗鮮重、干重、絕對含水量
2.4 NaCl脅迫對紫花苜蓿生理指標的影響
隨著NaCl濃度增加,苜蓿MDA含量呈先增加后降低的趨勢(NaCl濃度為0.3%時除外),濃度為0.6%時最高。POD活性在NaCl為0.6%和1.5%時,顯著低于其他NaCl濃度(P<0.05)。SOD活性在高濃度(1.2%、1.5%和1.8%)NaCl脅迫下顯著高于低濃度脅迫(P<0.05)。CAT活性隨NaCl濃度增加呈先增加后降低的趨勢(0.3%和1.5% NaCl濃度除外)。脯氨酸含量在NaCl為0%、1.5%和1.8%時顯著高于其他濃度(P<0.05)。隨著NaCl濃度的增加,WSS含量顯著降低,SP含量顯著增加(P<0.05),但0.9%濃度時不顯著(表4)。
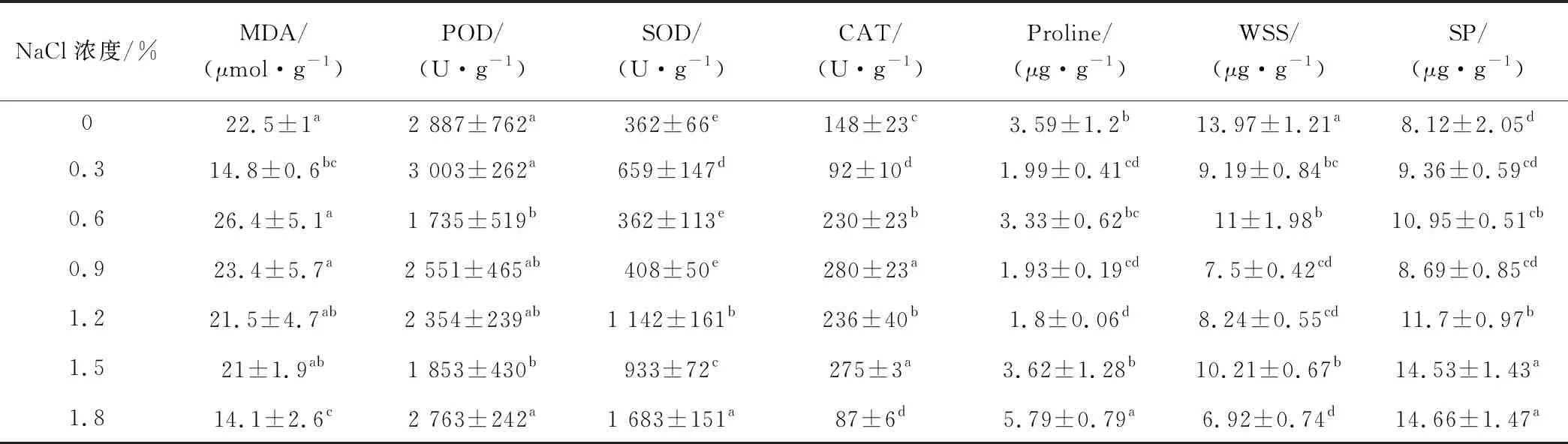
表4 不同濃度NaCl處理下紫花苜蓿幼苗的生理特征
2.5 紫花苜蓿幼苗生長性狀、生理特征與種子萌發的關系
紫花苜蓿幼苗苗長、根長、全株長、根鮮重、根干重、根絕對含水量與種子發芽率、發芽勢、發芽指數、活力指數基本呈極顯著正相關(P<0.01)(表5)。

表5 紫花苜蓿幼苗生長性狀與種子萌發的關系
3種抗氧化酶中,只有SOD酶活性與發芽率、發芽勢、發芽指數和活力指數呈極顯著負相關(P<0.01)。脯氨酸含量與發芽率、發芽勢呈極顯著負相關(P<0.01),與種子活力指數呈顯著負相關(P<0.05)。可溶性糖含量與發芽率、發芽勢、發芽指數和活力指數呈顯著正相關(P<0.05)。可溶性蛋白含量與發芽率、發芽勢、發芽指數和活力指數呈極顯著負相關(P<0.01)(表6)。
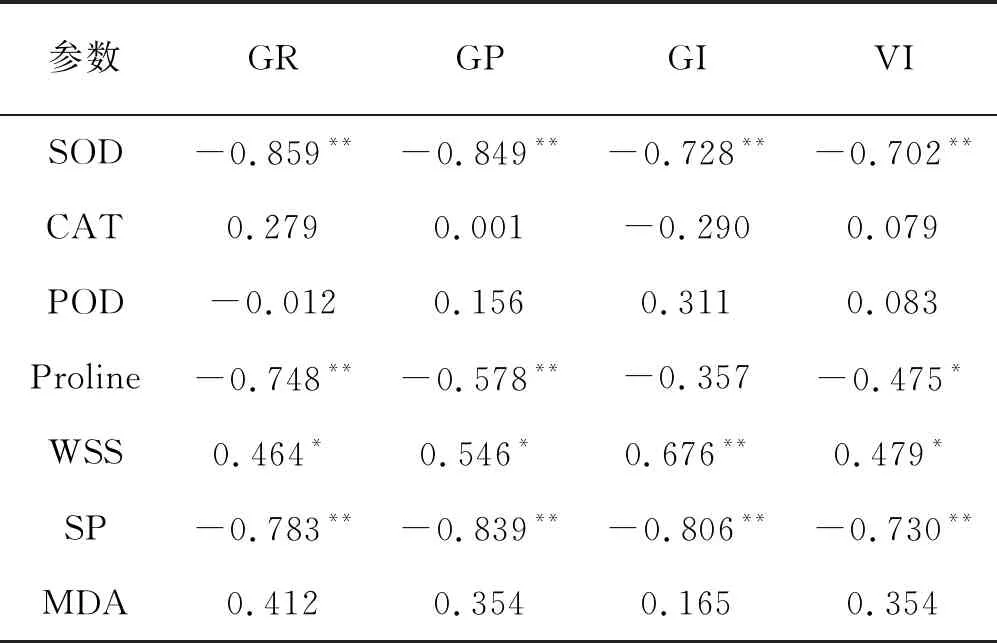
表6 紫花苜蓿幼苗生理特征與種子萌發的關系
3 討論
土壤鹽漬化是我國面臨的主要環境問題,其嚴重限制了植物的萌發與生長。紫花苜蓿較耐鹽堿,是改良鹽堿地的理想植物。但隨著鹽濃度的升高,對紫花苜蓿種子萌發的抑制效應越顯著[19],這在本研究也得到了相似的結果。但也有研究表明,NaCl濃度過高時才抑制苜蓿種子的萌發,而低濃度的NaCl處理能促進發芽率、發芽勢等[19-21]。另外,高濃度的NaCl脅迫抑制了苜蓿幼苗的長度及質量,但低濃度的NaCl脅迫因苜蓿品種的不同或抑制或促進[22]。在本研究中,低濃度NaCl處理誘導了苗高、根長和全株長的增加,促進了幼苗和全株鮮重、干重和絕對含水量的增加,但抑制了根干重和鮮重的積累,且幼苗根冠比隨NaCl濃度的增加顯著降低,說明NaCl脅迫對根系抑制效應更顯著。本研究表明,紫花苜蓿種子的萌發情況與幼苗根系的長度、重量及絕對含水量呈顯著正相關,而與苗和全株的重量、絕對含水量關系基本不顯著,這更加說明NaCl脅迫對紫花苜蓿根生長的抑制作用更顯著。
紫花苜蓿發芽過程中受NaCl脅迫,其內部生理生化特性亦發生異常。一般情況下,NaCl脅迫打破了植物體內活性氧的代謝平衡,從而使膜脂過氧化物的最終分解產物丙二醛隨NaCl濃度的增加呈顯著增加的趨勢[23]。但本研究中,MDA呈先增加后降低的趨勢,這可能是由于高NaCl濃度抑制了弱勢苜蓿種子的發芽,使剩余發芽的種子具有較高的抗鹽性。這在本研究中得到了一定的證實,即保護性物質SOD的活性、脯氨酸含量和可溶性蛋白含量與種子萌發指標呈顯著的負相關。
4 結論
(1) 隨著NaCl濃度的增加,紫花苜蓿種子的發芽率、發芽勢、發芽指數和活力指數呈降低的趨勢。
(2) NaCl脅迫影響了紫花苜蓿幼苗的形態特征,相比于苗和全株,對根生長的抑制作用更顯著。

