泛素化激酶Cbl蛋白對H9N2亞型禽流感病毒早期復制的抑制作用
陳佳靜,李彤彤,張則,盧安然,李陳飛,馮秀麗
(南京農業大學動物醫學院/農業農村部動物細菌學重點實驗室/教育部“動物健康與食品安全”國際合作聯合實驗室,江蘇 南京 210095)
法氏囊是禽類中樞體液免疫器官。法氏囊源活性分子發揮了多種功能,如免疫調節[1-3]、促進B細胞分化[4-5]、抗氧化[6]及抗腫瘤[7-8]等功能。前期研究發現,法氏囊源活性分子法氏囊五肽(BPP-I、BPP-IV)來源于同一種蛋白分子,即Cbl(Casitas b-lineage lymphoma)[9]。Cbl蛋白家族是具有Ring Finger結構域的一種泛素化激酶(E3)。哺乳動物細胞中存在3種Cbl亞型,分別為c-Cbl,Cbl-b和Cbl-3[10]。Cbl-b蛋白可以通過充當銜接蛋白來調節細胞活化。在免疫系統中,Cbl-b可通過調節T細胞,B細胞和自然殺傷細胞(natural killer cell,NK)激活途徑在抗腫瘤免疫中發揮關鍵作用[11]。Cbl編碼906個氨基酸的多結構域蛋白c-Cbl,其主要功能是調節酪氨酸激酶[12]。c-Cbl是一種120 kDa的蛋白質,包含1個變異的SH2結構域,1個RING結構域,1個富含脯氨酸的區域和1個與泛素(Ub)相關的結構域,與活性血小板衍生的生長因子、表皮生長因子和集落刺激因子-1受體結合并刺激其泛素化[13]。有研究表明,在P-選凝素活化β2整合素的信號通路中,存在有c-Cbl泛素化激酶介導的負反饋調控過程[14],說明c-Cbl蛋白在炎癥反應方面有著精細的調控作用。最近有研究表明,c-Cbl可以作為E3分子調控維甲酸誘導基因I(retinoic acid inducible-gene I, RIG-I)、干擾素調節因子8 (IRF8)等分子泛素化,與細胞Ⅰ型干擾素的產生以及抗病毒反應有密切的關系[15]。
自1992年在中國發現甲型H9N2流感病毒以來,已給家禽養殖業造成了重大的經濟損失[16-17]。前期研究發現,重組表達的Cbl能夠抑制H9N2亞型禽流感病毒(AIV)復制[18],說明該蛋白具有一定的抗病毒復制功能。有文獻報道,H9N2作為一種臨床上常見的AIV亞型,為多種AIV亞型提供了基因片段,具有重要的公共衛生意義[19]。基于此,本研究以人源細胞A549為宿主細胞模型,開展Cbl蛋白表達對H9N2亞型AIV增殖的影響研究。
1 材料與方法
1.1 菌株、載體及細胞
人肺腺癌細胞(A549)由本實驗室保存,采用含有10%胎牛血清1640培養基于37 ℃、5% CO2培養箱中進行培養。AIV毒株A/chicken/Shandong/LY1/2017 (H9) 由本實驗室于2017年分離、初步鑒定并保存。Cbl siRNA(表1)和陰性對照siRNA購自南京擎科生物科技有限公司。

表1 siRNA序列
1.2 主要試劑
GAPDH單抗,購于Enogene生物公司;HRP標記山羊抗兔IgG二抗,購于優寧維生物公司;DL2000 DNA Marker、DL15000 DNA Marker、核酸內切酶EcoRⅠ和HindⅢ、Mix、核酸膠回收試劑盒、TRIzol試劑,購于TaKaRa公司;DMEM和胎牛血清(FBS),購于Gibco公司;蛋白預染Marker、LipofectamineTM3000轉染試劑,購于Invitrogen公司;抗流感病毒A核蛋白抗體 (ab20343) 和c-Cbl蛋白抗體(ab32027),購于Abcam公司。
1.3 Cbl基因的擴增
根據GenBank中Cbl基因(NM_204208.1)的序列設計特異性引物擴增基因,引物由上海生工生物工程股份有限公司合成。引物序列為,F:5′-AAGCTTATGTCGGCTCCGCTGAAGAAGGG-3′,R:5′-GAA-TTCTTACAGGGATAACTTCGTCAGGTTACGCCTAGGC-TGAG-3′。
1.4 重組質粒的構建
在50 μL PCR體系中加入反轉錄后的HD11 cDNA模板2.5 μL,上、下游引物各1 μL,rTaq酶mix 25 μL,補加ddH2O至50 μL。PCR反應條件為:95 ℃預變性 5 min;95 ℃變性30 s,56 ℃退火30 s,72 ℃延伸5 min,進行35個循環;72 ℃延伸10 min,在16 ℃終止反應。PCR結束后,回收PCR產物進行雙酶切。酶切體系為:質粒或目的片段1 μg、限制性內切酶各2 μL、10 × Cutsmart buffer 5 μL、ddH2O補至50 μL。37 ℃酶切45 min,65 ℃ 5 min結束酶切反應。清潔回收酶切產物,然后利用T4 DNA連接酶連接。16 ℃連接過夜,取連接產物轉化DH5α感受態細胞,在含有氨芐抗性的LB固體平板上37 ℃ 過夜培養。挑取單克隆菌落進行菌液PCR鑒定,選取1~3個陽性克隆送南京擎科生物技術有限公司進行測序。
1.5 Western blot檢測蛋白表達
A549細胞接種至24孔板中,待其貼壁生長至密度為60%~70%,利用Lip3000轉染相應質粒至A549細胞中,其中FLAG-Cbl組轉染FLAG-Cbl質粒,FLAG組轉染FLAG-N空載體,對照組則僅加入Lip3000轉染試劑,轉染后6 h更換培養液,用含2%血清的1640培養基,繼續培養至24 h。接種感染復數(MOI)為0.1的H9N2亞型病毒,在對應時間點收集細胞沉淀制樣,進行SDS-PAGE檢測后,轉印至PVDF膜,于5%脫脂奶中室溫封閉2 h,用PBST洗膜3次,洗膜完成后根據蛋白Marker大小剪取所需蛋白大小的膜至稀釋好的對應單抗中,4 ℃孵育過夜。清洗后置于5%脫脂奶稀釋的HRP標記山羊抗兔二抗中于37 ℃繼續孵育1 h。利用化學發光檢測試劑盒進行化學發光顯色,檢測蛋白表達情況。
1.6 RNA的提取及反轉錄
采用TRIzol裂解法提取細胞總RNA,并且反轉錄為 cDNA 模板用于實時熒光定量 PCR,反轉錄體系為 20 μL:RNA 模板 6 μL;AccuRT reaction mix (4×) 2 μL;AccuRT Reaction Stopper (5×) 試劑2 μL;5× All-In-One RT MasterMix 試劑 4 μL;Nuclease-free H2O試劑6 μL;反應程序為25 ℃ 10 min,42 ℃ 15 min,最后85 ℃ 5 min。
1.7 熒光定量PCR設計合成
根據 GenBank上公布的 H9N2 亞型 AIV 的血凝素(HA)、核蛋白(NP)和非結構蛋白(NS)基因序列,設計并且合成熒光定量 PCR引物,如表2所示。引物由上海生工生物工程股份有限公司合成。

表2 熒光定量PCR引物
1.8 熒光定量 PCR反應體系和程序
反應體系: EvaGreen 2×qPCR MasterMix 10 μL,上下游引物各0.6 μL,模板DNA 2 μL,水6.8 μL。反應程序為預變性95 ℃ 1 min,然后95 ℃ 10 s,60 ℃ 30 s,35個循環,采集信號分析結果。熒光定量PCR試驗數據處理采用2-ΔΔCt法。
1.9 轉染siRNA
A549細胞接種至24孔板中,待其貼壁生長至密度為30%~40%,利用LipofectamineTM3000轉染試劑轉染相應siRNA各50 pmol,轉染后6 h后更換培養液為含2%血清的1640培養基繼續培養36 h。然后接種MOI=0.1的H9N2亞型AIV,分別在感染后不同時間段收集細胞樣品,采用熒光定量PCR檢測病毒HA基因相對表達水平。
2 結果與分析
2.1 真核重組表達載體 FLAG-Cbl 構建
以禽源HD11細胞的cDNA為模板,擴增出Cbl片段,大小為420 bp (圖1) ,與預估大小符合。將擴增產物Cbl與空載體FLAG-N連接后,以單菌落擴增后提取的質粒為模板進行 PCR,瓊脂糖凝膠電泳顯示,在420 bp處有1條明顯條帶(圖2),與預期結果一致。PCR陽性質粒經EcoRⅠ和HindⅢ雙酶切,瓊脂糖凝膠電泳檢測,發現約3 779和420 bp 2條特異條帶,如圖3所示。這些結果說明,真核重組表達載體FLAG-Cbl已構建成功。
M.DNA Marker;1~3.Cbl的PCR產物
M.DNA Marker;1~5.FLAG-Cbl的重組載體PCR產物
2.2 Cbl蛋白對H9N2病毒在A549細胞中復制的影響
2.2.1 從蛋白水平上檢測Cbl蛋白對病毒復制的影響
FLAG-Cbl 重組載體和FLAG空載體轉染A549細胞24 h,然后接種H9N2病毒,分別于6、12、24和36 h后收樣,檢測不同時間點病毒NP蛋白的表達情況,如圖4。結果顯示,在接毒6 h后FLAG-Cbl組的NP蛋白表達低于FLAG空載組。該結果表明表達的Cbl蛋白抑制了H9N2 病毒在A549細胞中的早期復制。
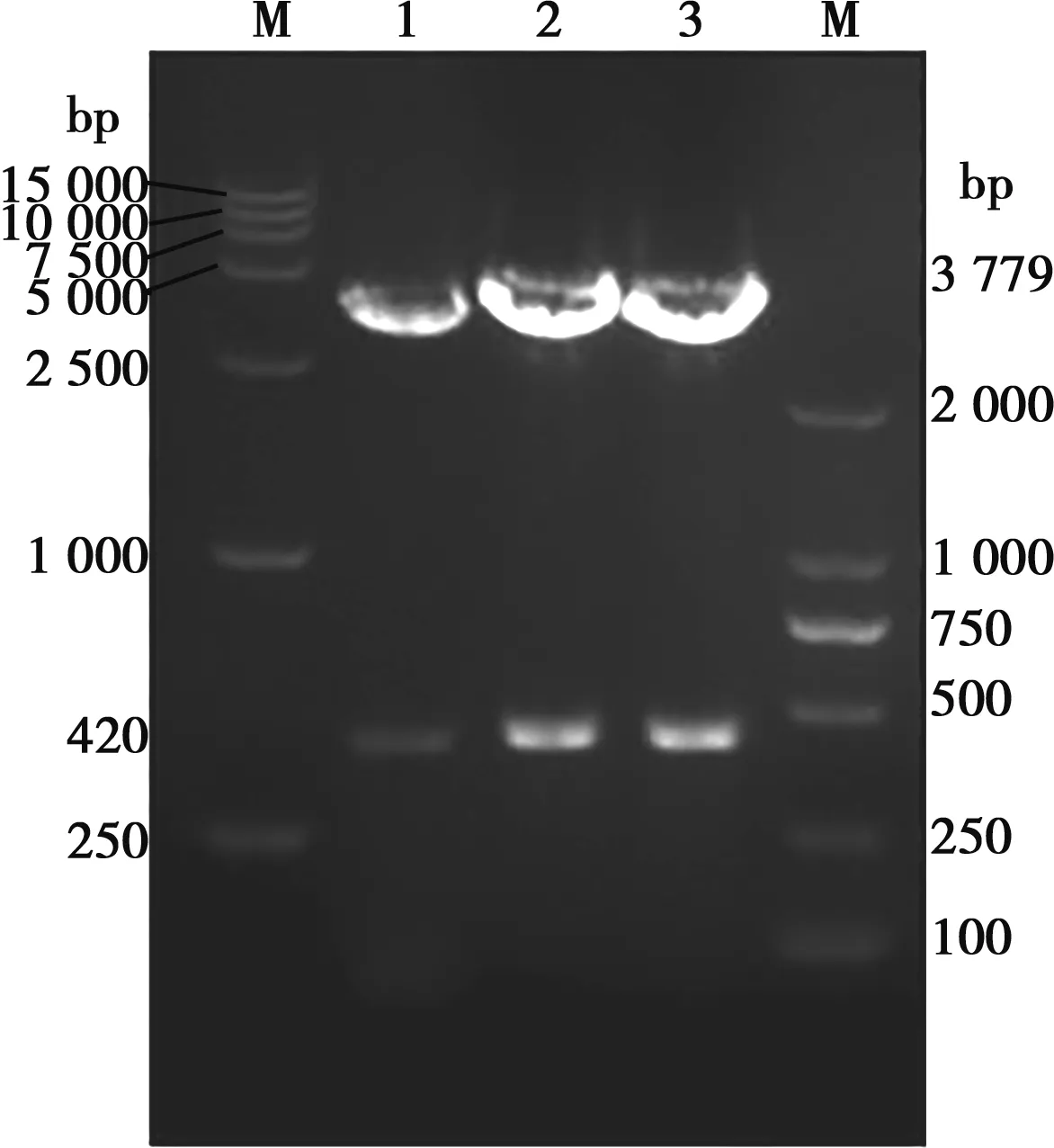
M.DNA Marker;1~3.雙酶切FLAG-Cbl重組載體
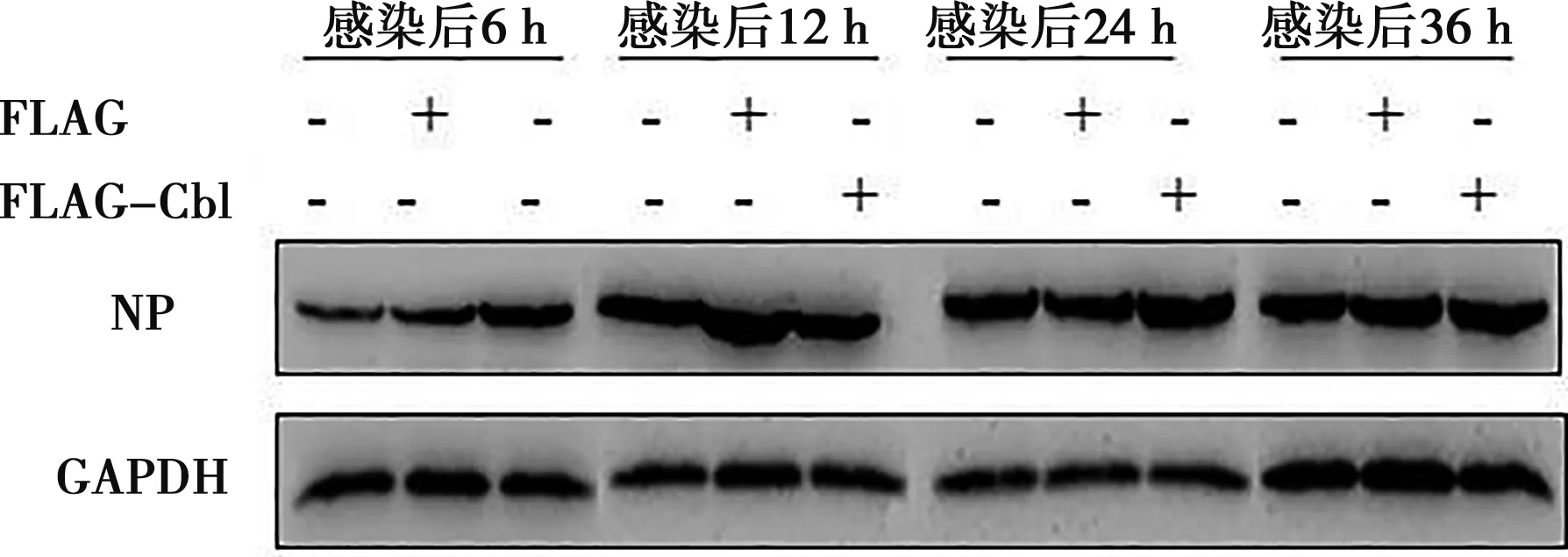
圖4 Western blot檢測病毒NP蛋白的表達
利用 Image J 軟件進行結果分析,分析不同細胞組的NP蛋白與內參蛋白GAPDH蛋白的比值,結果如圖5所示。接毒6 h時,FLAG-Cbl組的NP蛋白水平明顯低于對照和FLAG組(P<0.05)。接毒12 h時,FLAG-Cbl組的NP蛋白水平也低于對照組,不過沒有達到差異水平(P<0.05)。
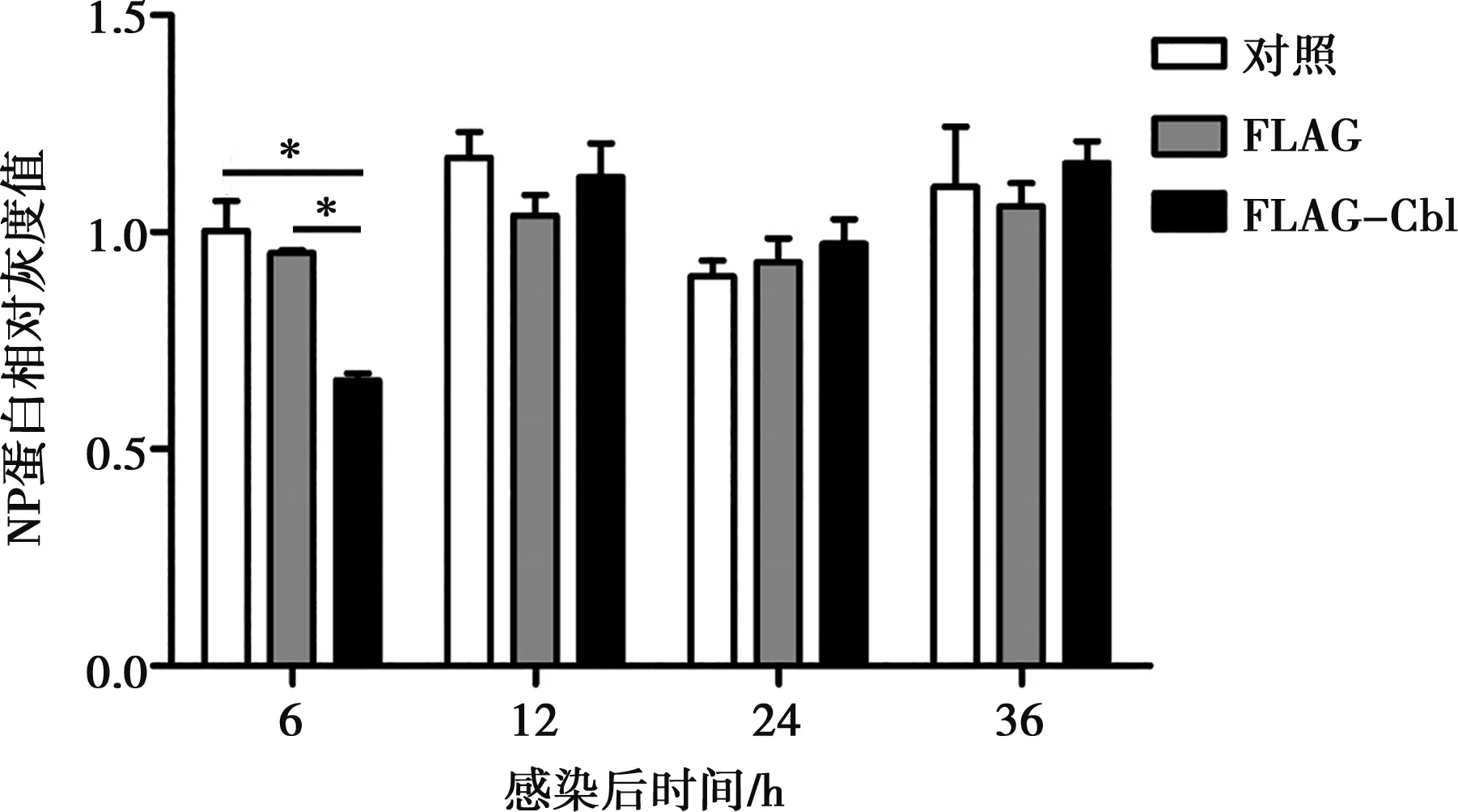
*表示差異顯著(P<0.05)。下同
2.2.2 從mRNA水平上檢測Cbl蛋白對病毒復制的影響
FLAG-Cbl重組載體和FLAG空載體轉染 A549 細胞24 h,分別于接種H9N2亞型病毒6、12、24和36 h收樣,進行熒光定量PCR檢測。結果如圖6所示,接毒6、12和24 h時,FLAG-Cbl組的病毒NP基因相對水平顯著低于對照和FLAG組(P<0.05,P<0.01),表明重組表達的Cbl蛋白抑制了H9N2亞型AIV在A549細胞中的早期復制。在病毒接種36 h時,FLAG-Cbl組的病毒NP基因相對水平低于FLAG空載體組(P>0.05),不過極顯著高于對照組(P<0.01)。
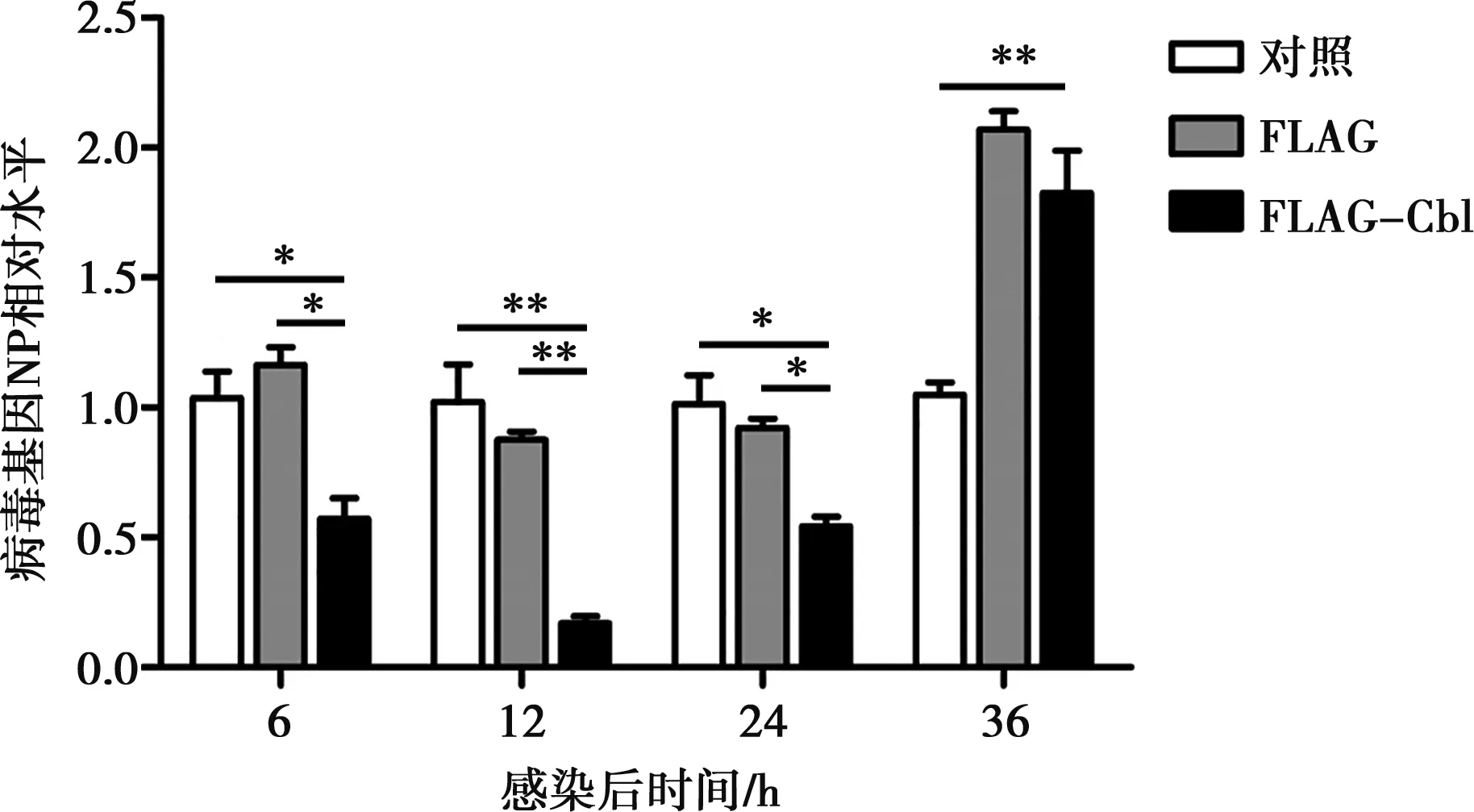
**表示差異極顯著(P<0.01)。下同
同時,采用定量PCR技術檢測了H9N2病毒的HA、NS基因表達水平。結果顯示,在接毒6和12 h,FLAG-Cbl組的病毒NS基因相對水平明顯比FLAG空載體組低(P<0.05,P<0.01)(圖7),且該組的HA基因相對水平明顯低于FLAG空載體組(P<0.05)(圖8)。在病毒接種24 h時,各試驗組的NS和HA基因表達水平差異不大(P>0.05)。在病毒接種36 h時,FLAG-Cbl組的病毒NS和HA基因相對水平低于FLAG空載組,不過高于對照組。
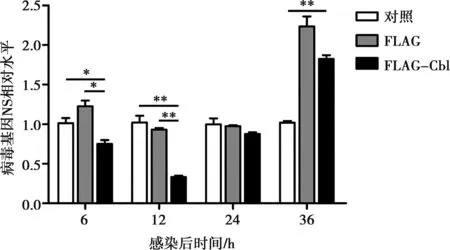
圖7 熒光定量PCR檢測NS基因相對表達水平
2.3 敲低內源性Cbl蛋白對H9N2病毒增殖的影響
為了探究內源性Cbl蛋白對于H9N2病毒的影響,在A549細胞中分別轉染對照和3條靶向Cbl蛋白的siRNA (Cbl-1、Cbl-2和Cbl-3) 敲低Cbl蛋白的表達。轉染72 h后,經Western blot和熒光定量PCR驗證敲低效率。與對照相比,siRNA-Cbl-1、-2和-3均敲低細胞中Cbl蛋白的蛋白表達及基因表達水平明顯減少,其中以siRNA-Cbl-1敲低Cbl蛋白和基因表達最為明顯(P<0.05)(圖9、10)。
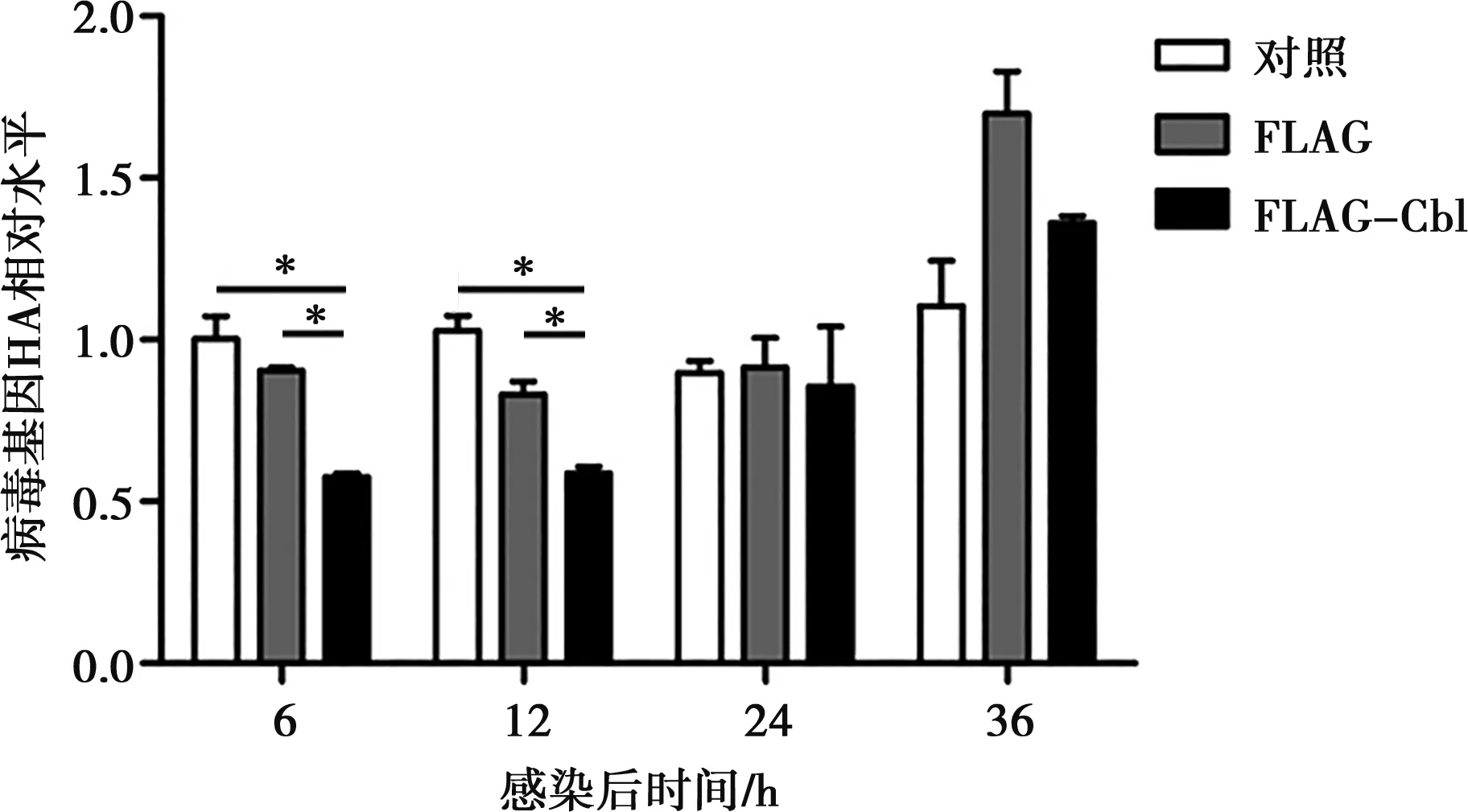
圖8 熒光定量PCR檢測HA基因相對表達水平

圖9 Western blot檢測siRNA對Cbl蛋白的敲低作用
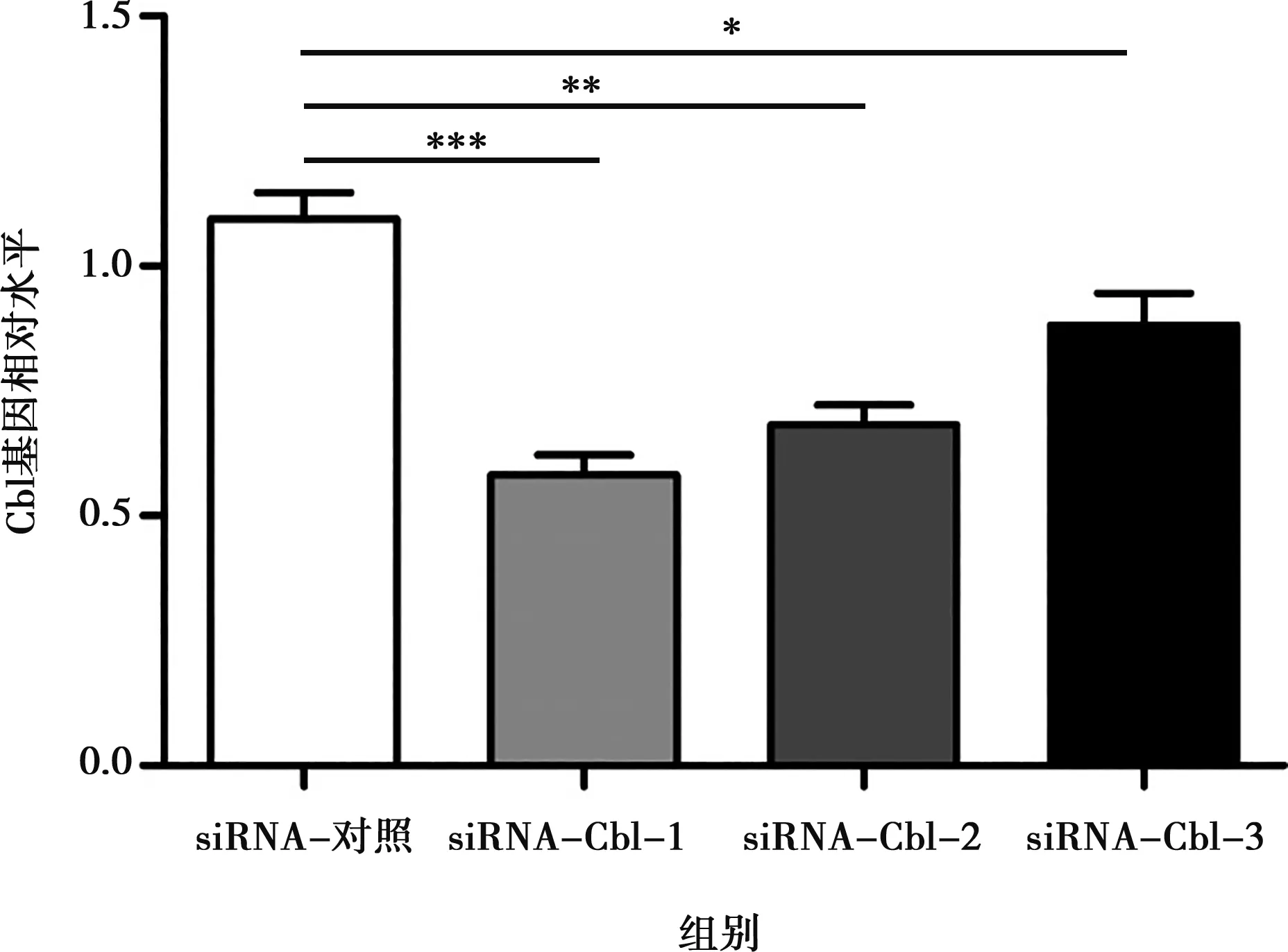
***表示差異極顯著(P<0.001)。下同
基于上述結果,選擇敲低效果最顯著的siRNA-Cbl-1進行后續試驗。轉染siRNA-Cbl-1 36 h后,以MOI=0.1的H9N2病毒感染,分別在感染后 6、12、24和36 h收集細胞樣品,做熒光定量PCR驗證。結果如圖11所示,在A549細胞中敲低Cbl蛋白表達12~36 h時,病毒HA基因水平明顯上升(P<0.001),說明敲低細胞內Cbl時,病毒復制增強,暗示細胞內的Cbl蛋白能夠在一定程度上抑制H9N2病毒的復制。
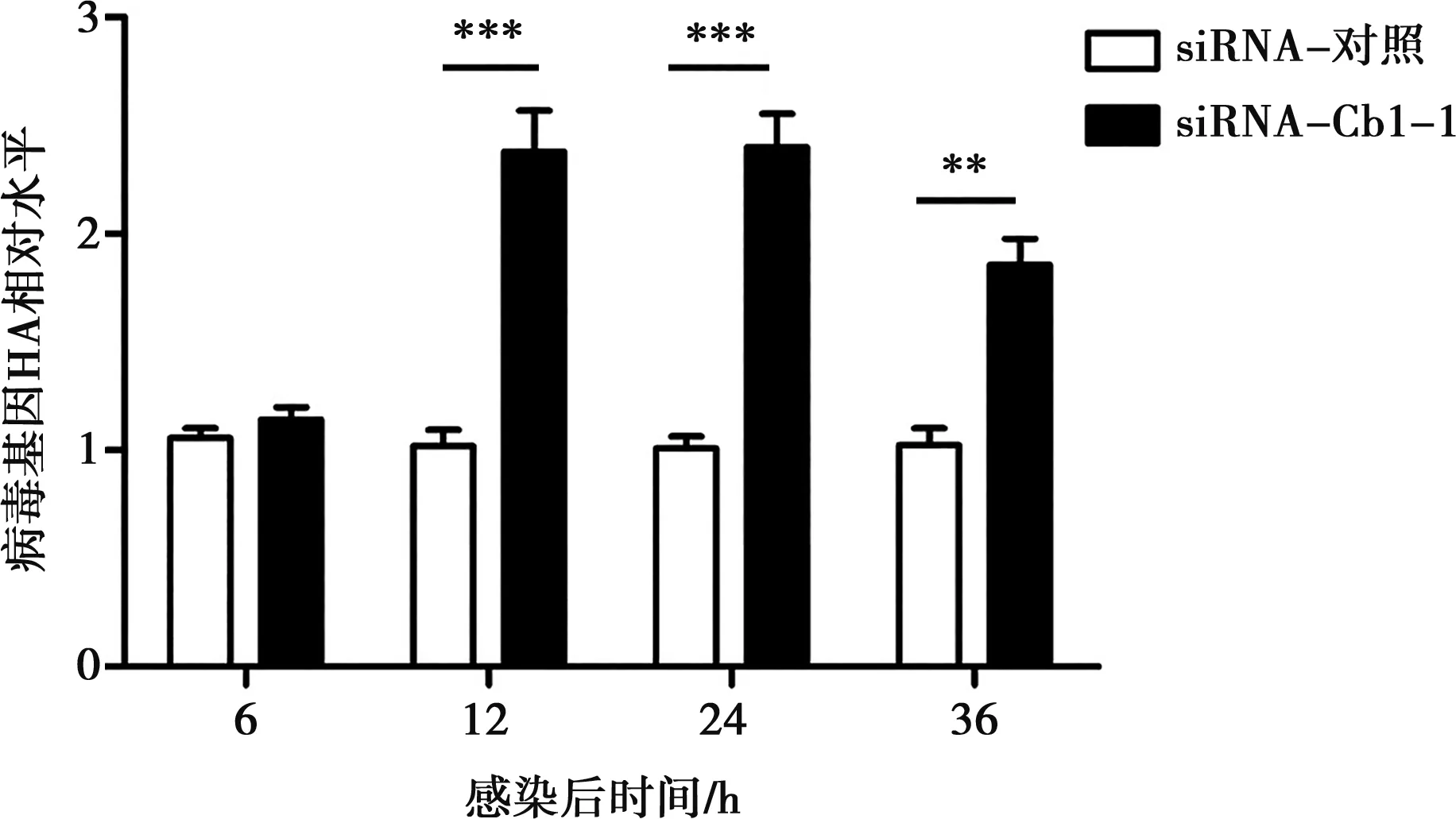
圖11 熒光定量PCR檢測敲低細胞內Cbl對病毒HA基因表達的影響
3 討論
H9N2亞型AIV已給我國家禽養殖業造成了巨大的經濟損失,并造成了嚴重的公共衛生安全隱患[16-17]。開展抗AIV的功能機制研究已成為眾所關注的重要課題。本研究前期發現,Cbl為法氏囊源活性分子的同源蛋白[9]。Cbl作為一種泛素化激酶(E3),是細胞內泛素化生物過程的重要組成[20-21]。有研究顯示,E3泛素連接酶可通過促進TBK1 泛素化修飾來調控其表達及活化[22],也可與TRAF3相互結合并對其進行K29泛素化修飾,增強下游信號分子IRF3的活化,從而促進Ⅰ型干擾素的產生來抑制病毒復制[23]。那么,Cbl對H9N2亞型AIV的復制影響如何,有待于進一步探索。
本試驗成功構建了FLAG-Cbl真核表達載體,并將其轉染至A549細胞中,感染H9N2亞型AIV后,經Western blot和熒光定量PCR檢測NP等病毒蛋白的表達情況,發現在病毒感染6和12 h時,FLAG-Cbl轉染的細胞中病毒NP、NS和HA基因表達水平均明顯低于FLAG組,且低于對照組,這說明Cbl蛋白在H9N2亞型病毒早期復制有一定的抑制作用。同時發現,病毒感染24 h時,FLAG-Cbl轉染組、FALG組和對照組細胞中病毒NS和HA基因表達水平相似,而在病毒感染36 h時,FLAG-Cbl轉染組細胞中病毒NP、NS和HA基因表達水平均低于FLAG組,但高于對照組。我們推測可能是因為24 h以后,細胞內病毒總量復制增加,Cbl雖然具有一定抑制病毒的能力,但病毒可能通過一些機制仍在不斷增加,以至于Cbl蛋白不能充分發揮抑制病毒復制的功能,這些側面說明了Cbl蛋白僅在病毒早期發揮抑制病毒復制的作用。至于其中的功能機制尚不清晰,還有待深入探索。
HA蛋白是H9N2亞型AIV的重要結構蛋白,不僅介導病毒吸附及穿入宿主細胞,而且是一種保護性抗原[24]。本試驗用RNAi技術敲低細胞內Cbl蛋白后,以HA基因水平反映H9N2亞型AIV的入侵宿主細胞及其在宿主細胞中的復制情況。熒光定量PCR檢測發現病毒HA基因水平明顯增高。這說明細胞內Cbl蛋白降低后,細胞內AIV增多,暗示著細胞內Cbl蛋白降低后,AIV復制增強。該結果與FLAG-Cbl轉染過表達的結果具有一定的負相關關系。這也反過來暗示了Cbl蛋白對于H9N2亞型流感病毒復制有一定的抑制作用。鄭陽等[18]報道,重組表達的Cbl蛋白能夠在犬MDCK 細胞上抑制H9N2亞型AIV的復制。本研究以A549細胞為模型,采用不同的重組表達載體,取得了與此相似的研究結果。這暗示著Cbl能夠在不同宿主細胞內發揮抑制H9N2亞型AIV復制的功能。許多研究都證實,E3泛素連接酶家族成員可通過泛素化途徑來調控干擾素水平從而影響病毒復制情況[23]。那么,Cbl蛋白抑制AIV早期復制的作用機制是否與其泛素化調節干擾素的功能機制相關,還有待進一步研究。
總之,本研究證實法氏囊源多肽同源蛋白Cbl的重組蛋白能夠在人源細胞模型中抑制H9N2亞型AIV的早期復制,為深入研究Cbl蛋白抗病毒復制機制提供了重要的試驗依據,同時為開展抗H9N2亞型AIV藥物提供了重要參考。

