非洲豬瘟病毒p30蛋白單克隆抗體的制備與鑒定
張路捷,高雁怩,夏婷婷,白娟,姜平
(南京農業大學/農業農村部動物細菌學重點實驗室,江蘇 南京 210095)
非洲豬瘟病毒(African swine fever virus, ASFV)可引起豬嚴重疫病,呈現高發病率和死亡率,高熱和全身出血等特征,對全球養豬業造成了巨大經濟損失,至今尚無有效的商品化疫苗和治療方法,早期診斷是控制該病的重要方法之一[1]。
ASFV是一個復雜的二十面體雙鏈DNA病毒,基因組長度約為170~190 kb,共編碼50多種結構蛋白,其中p72、p54和p30蛋白具有較好的抗原性和免疫原性,可用于ASFV血清學診斷[2-6]。ASFV p30蛋白由CP204L基因編碼,屬于病毒的早期蛋白,主要參與病毒入侵過程[7],能夠誘導豬體產生較強的免疫反應[8]。本研究根據ASFV Pig/HLJ/2018毒株序列設計引物擴增CP204L(p30)基因,通過原核表達系統獲得ASFV重組p30蛋白,制備出2株針對p30蛋白的單克隆抗體,為ASFV診斷和生物學特性研究奠定了基礎。
1 材料與方法
1.1 主要材料
ASFV陽性病料、小鼠骨髓瘤細胞(SP2/0)和pET-32a (+)載體、豬繁殖與呼吸綜合征病毒(PRRSV)、豬偽狂犬病病毒(PRV)、豬塞內卡病毒A(SVA)和豬流行性腹瀉病毒(PEDV)由本實驗室收集保存。SPF級雌性BALB/c小鼠(6~12周齡)購自揚州大學實驗動物中心。ASFV感染的豬肺泡巨噬細胞玻片和滅活病毒液由中國農業科學院哈爾濱獸醫研究所制備提供。
DH5α及BL21(DE3),購自全式金生物技術有限公司;2 × Phanta Max Master Mix和180 kDa Prestained Protein Marker,購自諾唯贊生物科技股份有限公司;限制性核酸內切酶EcoRⅠ、XhoⅠ和T4 DNA連接酶,購自Thermo Fisher Scientific公司;RPMI-1640培養基、胎牛血清,購自美國Gibco公司;羊抗鼠IgG(H+L)-HRP,購自碧云天生物技術有限公司;異硫氰酸熒光素(FITC)-羊抗鼠IgG、小鼠單克隆抗體亞型鑒定試劑盒,購自Proteintech生物科技有限公司;TanonTM High-sig ECL Western blot底物試劑盒,購自天能科技有限公司;異丙基硫代半乳糖苷(IPTG)、弗氏完全佐劑、弗氏不完全佐劑、HAT和HT,購自美國Sigma公司;其他試劑均為國產分析純。
1.2 重組質粒構建
參考GenBank數據庫中ASFV Pig/HLJ/2018(GenBank MK333180)毒株的CP204L(p30)基因序列設計引物,p30-F:5′- GCGGAATTCAT-GGATTTTATTTTAAATATA -3′,含有EcoRⅠ酶切位點(下劃線處);p30-R:5′- CGCCTCGAGTTTTTTTTTTAAAAGTTTAAT-3′,含有XhoⅠ酶切位點(下劃線處),用于擴增CP204L(p30)基因,大小為582 bp。病毒DNA由ASFV陽性病料中提取。PCR反應條件:95 ℃ 2 min;95 ℃ 10 s,53 ℃ 30 s,72 ℃ 30 s,共35個循環;72 ℃ 延伸5 min。將目的片段和pET-32a(+)載體經EcoRⅠ和XhoⅠ雙酶切后進行連接。將連接產物轉化至DH5α中,經菌液PCR和雙酶切鑒定正確后送通用生物系統公司測序,將測序正確的質粒命名為pET-32a-p30并置于-20 ℃保存備用。
1.3 重組p30蛋白誘導表達及純化
將重組質粒pET-32a-p30轉化至BL21,于含氨芐青霉素的LB液體培養基中培養至菌液OD600 nm為0.6~0.8,加入終濃度為1 mmol/L的IPTG于37 ℃誘導表達6 h。將誘導后菌體進行超聲波破碎后于4 ℃ 10 000 r/min離心10 min,分別收集沉淀和上清,通過SDS-PAGE鑒定目的蛋白表達形式。用尿素透析法純化目的蛋白[9-10],利用BCA法測定目的蛋白濃度,通過Western blot試驗(用ASFV陽性血清)鑒定重組p30蛋白抗原性。重組p30蛋白置于-80 ℃保存備用。
1.4 重組p30蛋白單克隆抗體制備
1.4.1 動物免疫
取5只6~8周齡雌性BALB/c小鼠分別命名為鼠1~5,將純化的重組p30蛋白與弗氏完全佐劑1∶1混勻乳化,通過皮下多點注射方式免疫小鼠,免疫劑量為50 μg/只。二免、三免用弗氏不完全佐劑乳化,每次免疫間隔2周,第3次免疫后1周對小鼠進行尾部采血,分離血清,用間接ELISA方法測定血清抗體效價;融合前3 d選取抗體效價最高的小鼠進行沖擊免疫,腹腔注射100 μg重組蛋白
1.4.2 單克隆抗體制備
沖擊免疫后3 d將小鼠安樂死并分離脾細胞,在PEG4000作用下與對數生長期的SP2/0細胞按照7∶1的比例進行細胞融合。將融合細胞鋪至含有HAT選擇培養基的96孔細胞板中培養。細胞融合7 d后,取100 μL細胞培養上清用間接ELISA方法進行檢測。陽性雜交瘤細胞需進行2~3次亞克隆直至抗體陽性率達100%。將穩定分泌抗體的雜交瘤細胞株擴大培養并凍存于液氮中長期保存。
1.4.3 間接ELISA方法
將重組p30蛋白用碳酸鹽抗原包被液稀釋至2 μg/mL包被酶標板,于4 ℃包被過夜并用5%脫脂乳于37 ℃封閉2 h。將雜交瘤細胞培養上清作為一抗,加入酶標板,同時設立陰、陽性對照;用PBST洗滌3次后加入100 μL羊抗鼠IgG(H+L)-HRP(1∶1 000稀釋)于37 ℃反應45 min;洗滌同上,每孔加入100 μL TMB顯色液于37 ℃避光顯色10 min;加入50 μL 2 mol/L H2SO4終止反應。用酶標儀測定每孔OD450 nm值,待檢樣品OD450 nm/陰性樣品OD450 nm(S/N)>2.1判定為陽性。
1.4.4 腹水制備
選取12周齡雌性BALB/c小鼠,向小鼠腹腔內注射500 μL無菌液體石蠟。7 d后,向小鼠腹腔中注射3 × 106~4 × 106個雜交瘤細胞。5~7 d后,小鼠的腹部會變大,觸之有波動感、行動不敏捷、被毛粗糙時收集腹水,于4 000 r/min離心5 min,取中間層液體,于-80 ℃長期保存備用。
1.5 單克隆抗體生物學特性鑒定
1.5.1 單克隆抗體分泌穩定性及亞型測定
將陽性雜交瘤細胞連續傳代培養20代,每隔5代凍存一批細胞,測定不同代次的細胞上清中ELISA抗體效價。按照小鼠單克隆抗體亞型鑒定試劑盒說明書鑒定其亞型。
1.5.2 Western blot反應性鑒定
取重組p30蛋白及豬肺泡巨噬細胞上增殖的ASFV滅活病毒液,進行SDS-PAGE檢測,轉印至硝酸纖維素膜(NC膜)上。以雜交瘤細胞上清作為一抗,進行Western blot反應性鑒定,同時設立空載誘導菌體和豬肺泡巨噬細胞作為陰性對照。
1.5.3 間接免疫熒光試驗(IFA)反應性鑒定
取ASFV感染豬肺泡巨噬細胞及其玻片(4%多聚甲醛固定),用PBS(pH = 7.2)洗滌3次后每孔加入200 μL含有2% 牛血清白蛋白(BSA)的PBST溶液,于37 ℃封閉2 h;洗滌同上,每孔加入200 μL雜交瘤細胞培養上清,于37 ℃反應1 h;洗滌同上,每孔加入200 μL FITC-羊抗鼠IgG(用PBST進行1∶200稀釋),37 ℃ 反應1 h后,用PBST重復洗滌3次,將玻片置于在熒光顯微鏡下觀察,使用EVOS FL細胞成像系統拍攝照片并保存。
1.5.4 單克隆抗體特異性鑒定
取PRRSV、PRV、SVA、PEDV和ASFV滅活病毒液進行SDS-PAGE分析,轉印至NC膜上。以雜交瘤細胞上清作為一抗,進行Western blot反應性鑒定,同時設立豬肺泡巨噬細胞作為陰性對照。驗證單克隆抗體的特異性。
2 結果與分析
2.1 目的基因的擴增及重組質粒的構建
PCR擴增的p30目的基因片段大小為582 bp,與預期相符。將構建的重組質粒pET-32a-p30進行雙酶切鑒定,酶切后的目的片段與目的基因大小一致并且基因測序結果完全正確(圖1)。
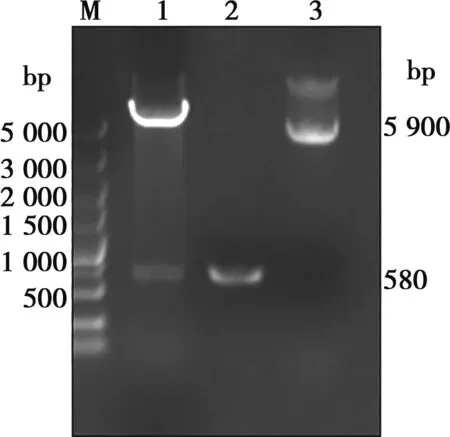
M. DL5000 DNA Marker;1. pET-32a-p30雙酶切產物;2. p30基因PCR產物;3. pET-32a-p30重組質粒
2.2 重組p30蛋白表達、純化及鑒定
SDS-PAGE結果顯示,重組菌BL21-p30經IPTG誘導后在50 kDa處有明顯條帶,與預期大小相符,且為不溶性表達。重組p30蛋白通過尿素透析法純化后在處出現單一條帶(圖2A)。Western blot結果表明,ASFV陽性血清能與重組p30蛋白發生特異性反應,證明該蛋白具有良好的抗原性(圖2B)。
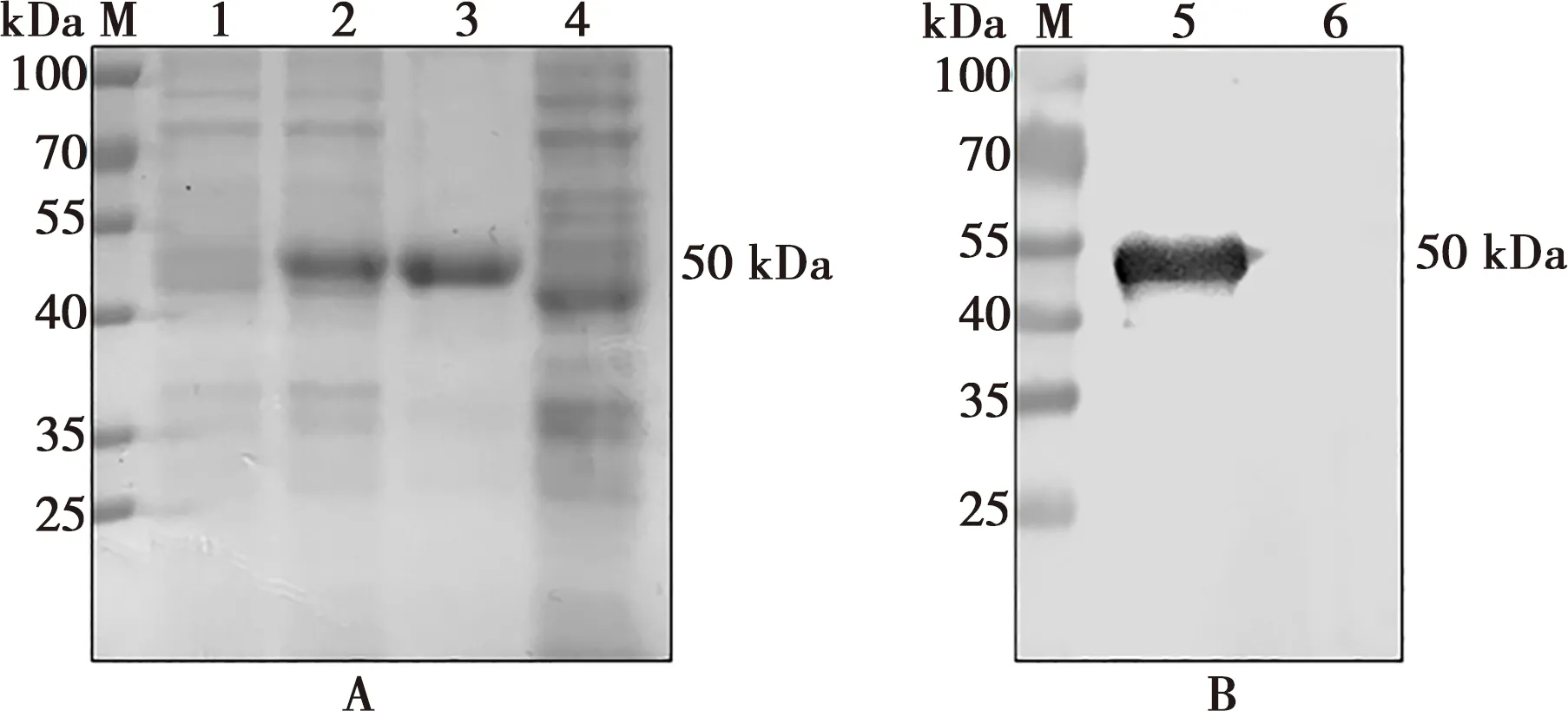
M. 蛋白分子量標準;1. 重組質粒誘導表達后上清;2. 重組質粒誘導表達后沉淀;3、5. 純化的重組p30蛋白;4、6. 空載體誘導全菌蛋白
2.3 小鼠血清抗體效價測定
小鼠3次免疫后1周,用本研究建立的間接ELISA方法檢測小鼠血清抗體效價。與陰性小鼠相比,免疫組內的所有小鼠均表現出具有較高水平的p30蛋白抗體效價,血清抗體效價均大于1∶25 800。
2.4 單克隆抗體制備及效價測定
采用本研究建立的間接ELISA方法篩選出2株能穩定分泌抗ASFV p30蛋白單克隆抗體的雜交瘤細胞,分別命名為2B9和8B9。將2株陽性雜交瘤細胞進行連續傳代至20代,細胞上清ELISA抗體效價穩定,用2株陽性雜交瘤細胞制備小鼠腹水,抗體效價較高(表1)。
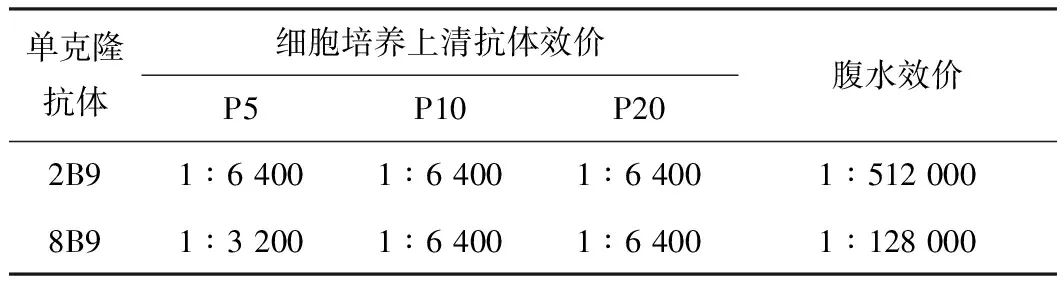
表1 雜交瘤細胞上清和腹水ELISA抗體效價測定
2.5 單克隆抗體亞型鑒定
結果見如表2,2株單克隆抗體的重鏈均屬于IgG1亞類,輕鏈均為Kappa型。
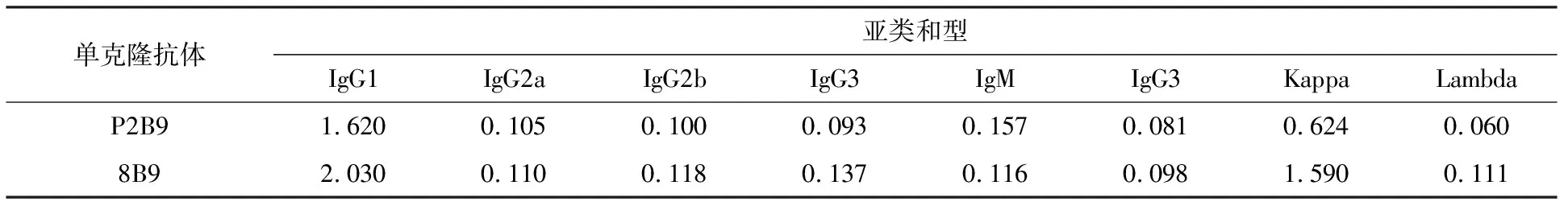
表2 單克隆抗體亞型鑒定
2.6 單克隆抗體Western blot反應性鑒定
Western blot結果顯示(圖3),2株單克隆抗體均能與重組蛋白以及ASFV感染的豬肺泡巨噬細胞發生特異性反應,而與空載誘導全菌和豬肺泡巨噬細胞不反應。
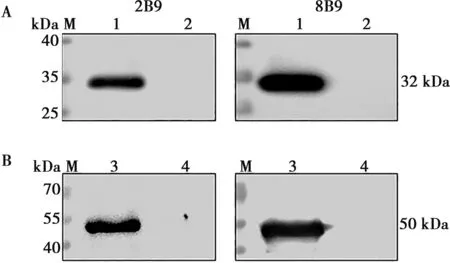
M. 蛋白分子量標準;1. ASFV 感染后24 h滅活病毒液;2. 非感染細胞對照;3. 重組p30蛋白;4. 空載誘導全菌蛋白
2.7 單克隆抗體IFA反應特性鑒定
IFA試驗結果顯示(圖4),單克隆抗體制備2B9和8B9均能與ASFV感染的豬肺泡巨噬細胞發生反應,產生特異性的綠色熒光。
2.8 單克隆抗體特異性鑒定
Western blot結果顯示(圖5),2株單克隆抗體只能與ASFV感染的豬肺泡巨噬細胞發生特異性反應,而與PRRSV、PRV、SVA和PEDV不發生反應。
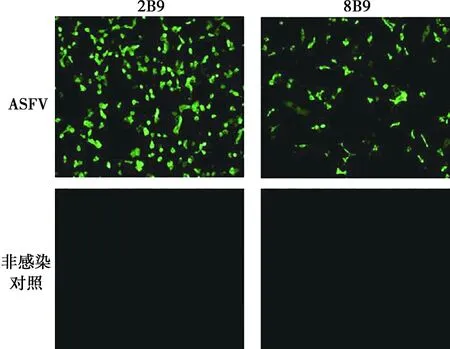
圖4 抗p30蛋白單克隆抗體與ASFV的IFA反應
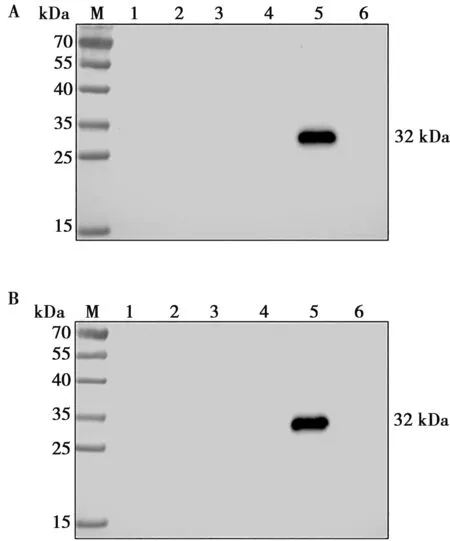
M. 蛋白分子量標準;1. PRRSV;2. PRV;3. SVA;4. PEDV;5. ASFV;6. 非感染細胞對照
3 討論
2018年至今非洲豬瘟對我國養豬業造成了嚴重的經濟損失[11]。目前關于ASFV致病機理以及編碼蛋白的功能研究較少,然而單克隆抗體能夠在基礎研究中發揮重要作用。ASFV單克隆抗體研制主要集中在p72、p54、p30蛋白上[12-15]。p30蛋白在病毒感染早期能促進病毒的內化[16]。相關研究表明,ASFV感染宿主細胞4 h后Western blot能夠檢測到該蛋白的表達,隨后在整個病毒復制周期中持續存在[17]。Oviedo等[18]發現p30蛋白適合用于ELISA抗體檢測,并且p30和p54蛋白的聯合應用可提高方法ELISA方法的敏感性。研究p30蛋白單克隆抗體有助于ASFV致病機制的研究以及血清學檢測方法的建立。本研究通過原核表達技術成功表達重組p30蛋白,Western blot證明該蛋白具有良好的抗原性。將重組p30蛋白免疫BALB/c小鼠,利用間接ELISA方法篩選出2株針對p30蛋白的單克隆抗體,分別為2B9和8B9,為該病毒檢測和生物學功能研究提供了有用材料。
單克隆抗體反應特性是決定其應用價值的重要指標。Wu等[15]采用桿狀病毒表達重組p30(24~188 aa)蛋白,制備了21株p30蛋白單克隆抗體,并鑒定了4種抗原表位,對ASFV感染的早期診斷具有重大意義。本研究分別測定了2B9和8B9雜交瘤細胞的穩定性、抗體效價、Ig亞型、Western blot和IFA反應性,結果表明2B9和8B9單克隆抗體從P10代開始穩定分泌抗體,腹水抗體效價分別為1∶512 000和1∶128 000,2株單克隆抗體的重鏈均屬于IgG1亞類,輕鏈均為Kappa型。Western blot反應性鑒定試驗顯示,2株單克隆抗體均能與ASFV感染的豬肺泡巨噬細胞發生特異性反應,在32 kDa處出現預期的條帶。IFA反應性鑒定試驗顯示,2株單克隆抗體均能夠識別ASFV感染的豬肺泡巨噬細胞,證明該2株單抗具有重要應用價值,但其針對的ASFV p30蛋白抗原表位尚需要進一步研究。

