甜瓜蔓枯病菌原生質體制備及再生體系研究
毛建才,王豪杰,李俊華,翟文強
(新疆農業科學院哈密瓜研究中心,新疆 烏魯木齊 830091)
0 引言
【研究意義】甜瓜蔓枯病是由子囊菌瓜類黑腐小球殼菌(Didymella bryoniae)引起的是一種土傳真菌性病害,是為害甜瓜的主要病害之一,在病害流行時,瓜田減產可達30%以上[1],有報道稱甜瓜蔓枯病的危害遠大于甜瓜枯萎病等世界性病害[2]。該病可以自然侵染甜瓜、西瓜和黃瓜等葫蘆科作物,化學藥劑防治難度較大,目前在全國各個甜瓜產區均有分布[3]。由于甜瓜蔓枯病受濕度影響較大,且病原菌寄主范圍廣、傳播途徑多樣、存活時間長,加之缺乏優良的抗病育種材料,所以該病的防治一直是生產上的難題。在病原菌與寄主植物互作中,病原物會不斷進化出強毒力的致病基因來克服寄主的防衛反應,同樣寄主植物也會產生相應的手段來抵御病原物的入侵。因此,從分子生物學角度研究甜瓜與蔓枯病菌的互作對開發新的防治方法具有重要意義。高效的遺傳轉化方法是分子生物學研究的基礎[2],為進一步明確甜瓜蔓枯病菌的致病機理,需要建立高效的甜瓜蔓枯病菌遺傳轉化體系,目前大多數絲狀真菌的遺傳轉化均利用分生孢子作為材料,但甜瓜蔓枯病菌A型菌株在常規培養條件下不產生分生孢子,且研究參與病原菌細胞壁合成的相關功能基因需要利用原生質體細胞壁再生進行鑒定[4],因此研究甜瓜蔓枯病菌原生質體的制備及再生體系對上述工作具有重要意義。【前人研究進展】原生質體是一種有組織且具有細胞全能性的生活物質,它可以在人工操作下進行各種分子生物學操作,如細胞融合、細胞壁及完整的植株再生、高分子和病毒的提取等。CaC12/聚乙二醇(PEG)介導的原生質體轉化技術是一種常用的基因功能研究方法,該方法是通過細胞壁降解酶的消化作用去除細胞壁獲得原生質體,并通過聚乙二醇(PEG)的作用將外源DNA轉化整合到原生質體的過程。自PEG遺傳轉化法在構巢曲霉(Aspergillus nidulans)中建立以來[5],禾谷鐮刀 菌 (Fusarium graminearum)、 刺 盤 孢 菌(Colletotrichum fructicola)[6]、楊 樹 腐 爛 病 菌(Cytospora chrysosperma)[7]、 大 麗 輪 枝 菌(Verticillium dahliae)[8]和尖孢鐮刀菌(Fusarium oxysporum)等在甘藍、西瓜、香蕉專化型[9?11]等多種真菌中建立了轉化體系。【本研究切入點】盡管CaC12/PEG介導的原生質體遺傳轉化技術以其操作簡便、無需特殊設備等優點已成為絲狀真菌和植物中常用的轉化方法之一,但原生質體的產量及再生率仍是制約轉化是否高效的關鍵因素之一[6]。影響原生質體制備的條件有很多,如菌絲的菌齡、酶組合、滲透壓穩定劑、酶解溫度和時間等,但不同物種細胞壁的組分不同,因此不同微生物制備原生質體所需要的條件也不盡相同[12]。【擬解決的關鍵問題】本研究選用2種不同的酶組合,分別在不同菌齡、不同酶解時間、不同穩定劑及pH條件下進行原生質體的制備和再生體系研究,以期建立高效的甜瓜蔓枯病菌原生質體制備和再生體系。
1 材料與方法
1.1 試驗材料
1.1.1 菌株 甜瓜蔓枯病菌A型菌株在新疆農業科學院 哈密瓜研究中心試驗地采集并分離、鑒定保存。
1.1.2 主要試劑、培養基 甜瓜蔓枯病病原菌生長培養基為PDA(200 g馬鈴薯煮沸20 min后,4層紗布過濾,2%葡萄糖,1.5%~2%瓊脂,補水至1 000 mL,121 ℃高溫高壓滅菌20 min),菌絲搖培培養基為CM液體培養基(0.6% 酵母提取物,0.3% 干酪素水解物,0.3% 酸水解酪蛋白,1% 蔗糖),再生培養基為TB3培養基(0.3% 酵母提取物,0.3% 酪蛋氨基酸,20% 蔗糖,0.7% 瓊脂)和SR培養基(0.1% 酵母提取物,0.1% 酶水解酪蛋白,1 mol·L?1蔗糖,1.5%瓊脂),STC(1.2 mol·L?1山梨醇,10 mmol·L?1Tris-HCl,pH=7.5,50 mmol·L?1氯 化 鈣)。Driselase和Lysing enzymes購自Sigma 公司,Miracloth濾布購自美國C albiochem公司。
1.2 試驗方法
1.2.1 原生質體制備 將保存的菌株在PDA培養基上活化,26 ℃黑暗培養5 d。用滅菌的接種針從培養基上刮取活化好的蔓枯病菌菌絲,接種到50 mL帶有5顆玻璃珠的CM液體培養基中,26 ℃、180 r·min?1條件下培養24~42 h[9],每6 h取樣1次。然后,用滅菌的Miracloth濾布收集菌絲體,收集到的菌絲體先用無菌水沖洗3次,然后用滲透壓穩定劑再沖洗2次。稱取0.5 g沖洗好的菌絲置于50 mL滅菌的三角瓶中(設置3個重復),加入10 mL酶解液(酶解液為20 g·L?1Driselase+8 g·L?1Lysing enzymes,溶劑為0.7 mol·L?1的NaCl,4 ℃,2 000 r·min?1離心10 min后,用0.22 μm微孔濾器除菌),在26~34 ℃、80~200 r·min?1條 件 下 酶 解2~6 h[9,12,13],之 后 繼 續 用Miracloth濾布過濾收集原生質體,利用血球計數板計 算原生質體個數,每個處理設置3個重復。
1.2.2 原生質體再生 采用雙層覆蓋法再生原生質體[9],將收集的原生質體離心濃縮,條件為4 ℃、2 000 r·min?1離心10 min,之后用穩滲液將原生質體含量調至1×106個·mL?1,取0.1 mL上述原生質體溶液分別均勻涂抹在SR、PDA和TB3固體培養基上[8,9,11],上層覆蓋55 ℃、0.4%~0.9%瓊脂培養基,搖勻覆蓋,每個處理設置3個重復;同時,按上述方法取0.1 mL上述含量的原生質體溶液并加入1 mL無菌水,室溫靜置30 min后分別均勻涂布到SR、PDA和TB3固體培養基上作為對照。將上述平板倒置,在28 ℃恒溫條件下培養3~5 d,至平板表面長出小菌落為止。1.2.3 原生質體的保存 用STC溶液純化收集的原生質體,將其含量調整為2×108個·mL?1,之后加入1/10體積的PEG溶液和1/100體積的DMSO,用移液槍輕輕混勻,分裝于100 μL離心管中,?80 ℃冰箱中保存。

2 結果與分析
2.1 原生質體制備
2.1.1 菌絲菌齡對原生質體產量的影響 將菌絲在CM液體培養基中分別培養24、30、36、42、48 h后收集菌絲制備原生質體,結果如圖1所示,用于制備原生質體的甜瓜蔓枯病菌菌絲最佳培養時間為36 h左右,此段時間獲得的原生質體數量最多,可達6.04×107個·mL?1,培養時間繼續延長或縮短,原生 質體產量均有所下降。

圖 1 菌絲菌齡對原生質體產量的影響Fig. 1 Effect of mycelium age on protoplast release by lysis
2.1.2 酶解時間對原生質體產量的影響 在菌絲菌齡統一為36 h的情況下,計算酶解2、3、4、5、6 h原生質體的產量,明確反應時間對原生質體制備的影響。從圖2-A可知,酶解4 h之后,原生質體的產量最高,可達8.22×107個·mL?1,酶解時間過長或過短,原生質體的產量均有所下降。但酶促反應的時間在3~5 h,原生質體的產量波動不大,當酶解時間低于2 h或高于5 h,原生質體的產量明顯降低,因此 ,甜瓜蔓枯病菌原生質體的最佳酶解時間為4 h。
2.1.3 酶解溫度對原生質體產量的影響 酶解溫度是影響酶促反應結果的關鍵因素之一,不同的酶具有不同的最適溫度,但是混合酶的最適溫度需要測定。在上述確定的最優條件下,設置24、26、28、30、32、34 ℃為酶解溫度,探討溫度對原生質體制備的影響。圖2-B顯示,隨著溫度的升高,原生質體的產量逐漸增加,溫度到達30 ℃時,原生質體的產量最大,為9.65×107個·mL?1,繼續提高溫度到32 ℃,原生質體的產量略有下降,之后繼續提高反應溫度,原生質體產量下降明顯。因此,該結果說明該酶促反應的最適溫度為30 ℃。
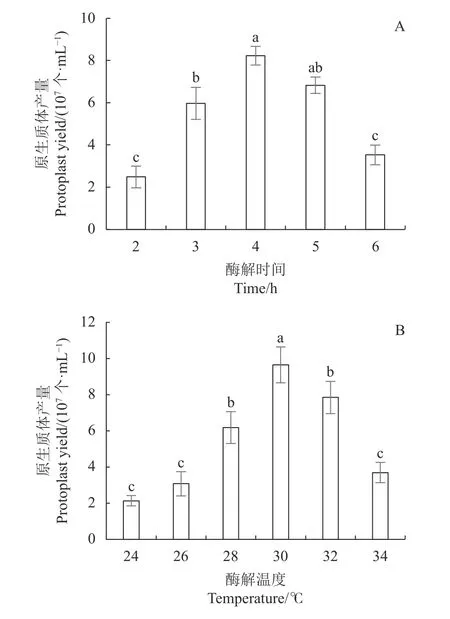
圖 2 酶解時間和酶解溫度對原生質體產量的影響Fig. 2 Effects of enzymatic digestion time and temperature on protoplast release by lysis
2.1.4 不同滲透壓穩定劑對原生質體產量的影響 滲透壓穩定劑在酶促反應中的作用主要是維持原生質體細胞內外壓力平衡和影響裂解酶的活性,從而最終影響原生質體的數量。在酶濃度、酶解時間和溫度統一的標準下,采用0.7 mol·L?1的NaCl、KCl、山梨醇和蔗糖分別作為穩滲液[12,14],統計甜瓜蔓枯病菌原生質體的產量。結果如圖3-A所示,利用NaCl作為該酶促反應的滲透壓穩定劑原生質體的數量最多,可達9.16×107個·mL?1,其次是KCl溶液。
將NaCl的濃度依次設置為0.5、0.6、0.7、0.8、0.9 mol·L?1,明確不同濃度的NaCl滲透壓穩定劑對甜瓜蔓枯病菌原生質體制備的影響。由圖3-B可知,利用0.7 mol·L?1的NaCl溶液作為滲透壓穩定劑,原生質體的產量最多,為8.86×107個·mL?1,濃度過大或過小,均不利于原生質體的釋放。上述結果說明0.7 mol·L?1的NaCl溶液可以作為甜瓜蔓枯病菌 原生質體制備過程中適宜的滲透壓穩定劑。

圖 3 滲透壓穩定劑對原生質體產量的影響Fig. 3 Effect of osmotic stabilizer on protoplast release by lysis
2.1.5 pH對原生質體產量的影響 滲透壓穩定劑環境的pH值是影響酶活的一個主要因素。在上述最優條件下,將滲透壓穩定劑的pH設置為4、5、6、7、8、9[7],比較不同pH條件下甜瓜蔓枯病菌原生質體的釋放情況,結果如圖4-A,當pH值為7時,原生質體的產量最高,可達8.58×107個·mL?1,pH值增加或者減小,原生質體的數量都會下降,由此結果可知,pH值為7時,是甜瓜蔓枯病菌制備原生質體過 程中的最佳pH。
2.1.6 轉速對原生質體產量的影響 酶解過程中勻速震蕩酶解液是為了使裂解酶與菌絲體充分接觸,有利于加快酶促反應的進程,保持其他最優條件不變,分別設定轉速為80、100、120、140、160、200 r·min?1,計算轉速與原生質體的數量關系。圖4-B顯示,隨著搖培轉速的增加,原生質體的釋放速率也在加快,轉速為140 r·min?1時,原生質體的產量到達峰值,為9.60×107個·mL?1,轉速在120~140 r·min?1時,原生質體的生成速率波動不大。當轉速超過160 r·min?1時,原生質體的產量下降且破碎的原生質體增多,因此確定原生質體制備搖培過程中最佳轉速 為120~140 r·min?1。

圖 4 p H和轉速對原生質體產量的影響Fig. 4 Effects of p H and rotational speed on protoplast yield in lysis
2.2 原生質體再生
2.2.1 不同再生培養基對原生質體再生率的影響 原生質體的再生能力是衡量獲得的原生質體質量最關鍵的指標,是評價原生質體是否有利用價值并進行下一步遺傳轉化的基礎。分別以PDA、SR和TB3這3種固體培養基作為甜瓜蔓枯病菌原生質體的再生培養基,評價在該體系中制備的原生質體的再生率。圖5-A顯示,蔓枯病菌原生質體在SR、PDA和TB3再生培養基生的再生率分別是22.53%、14.78%和22.38%,由此得知,SR和TB3培養基二者差異不顯著,在試驗中均可用來高效再生蔓枯病菌原生質體。
以SR培養基作為再生培養基,明確上層覆蓋培養基的瓊脂含量對原生質體再生率的影響。在試驗中發現,當瓊脂含量低于0.5%時,培養基不易凝固,覆蓋后影響原生質體的再生率,覆蓋培養基瓊脂含量在0.5%~0.6%時,原生質體的再生率較高,分別是19.00%和19.67%,二者差異不顯著;瓊脂含量高于0.6%時,再生率下降(圖5-B)。從上述結果可知,雙層覆蓋法中上層覆蓋培養基的瓊脂含量對甜瓜蔓枯病菌原生質體再生具有明顯影響,覆蓋培養基的瓊脂含量為0.5%~0.6%時,原生質體再生率最高。
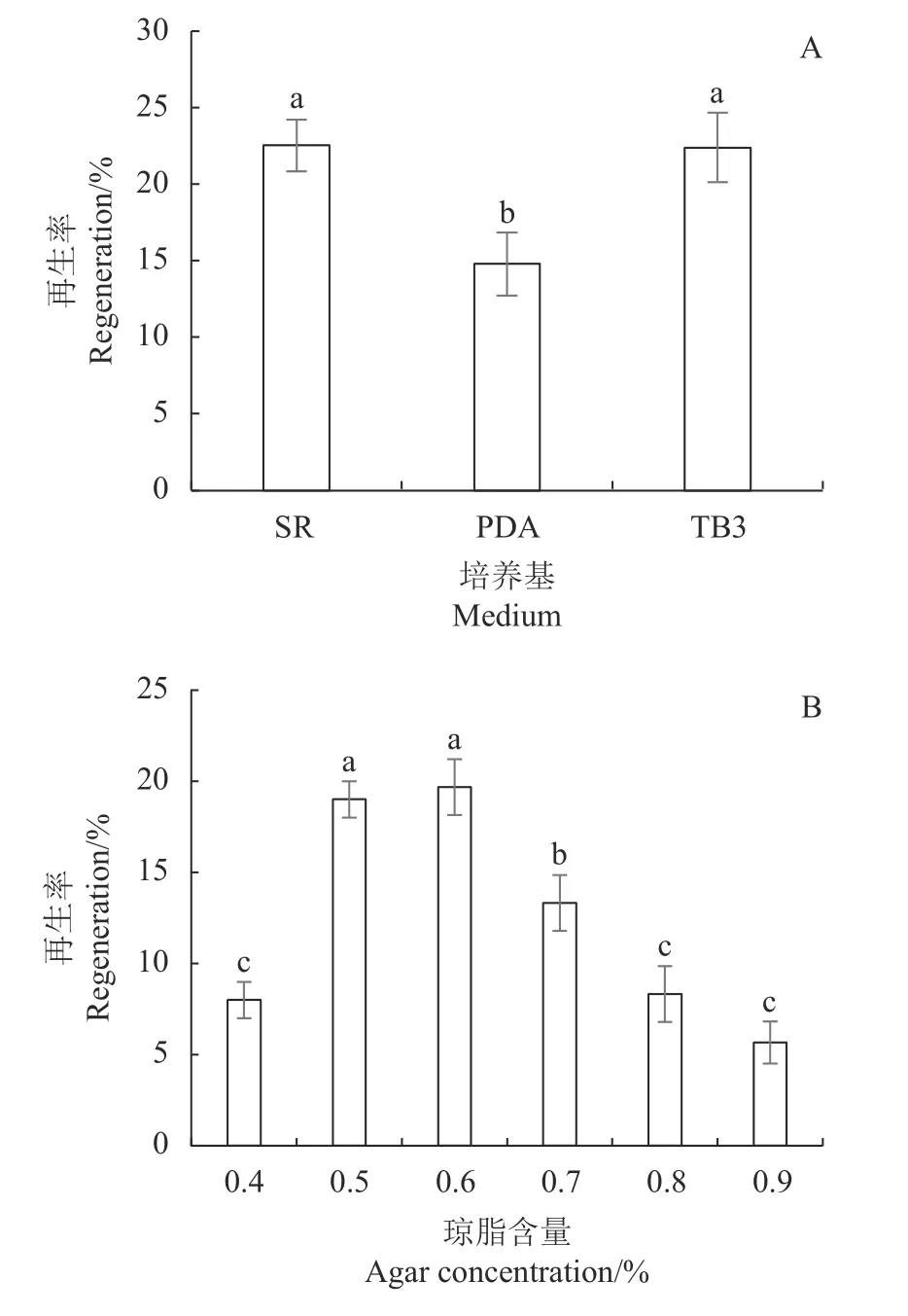
圖 5 不同再生培養基對原生質體再生率的影響Fig. 5 Effects of medium and agar concentration on protoplast regeneration rate
2.2.2 酶解時間對原生質體再生的影響 在甜瓜蔓枯病菌原生質體制備過程中,酶解時間的長短直接影響原生質體的產量(圖2-A),酶解時間過短細胞壁不能被完全酶解,酶解時間過長又會破壞原生質體的完整性。為了明確酶解時間是否也影響原生質體的再生率,在上述確定的條件下再生原生質體,結果如圖6-A所示,酶解時間不同,原生質體的再生率也不同,酶解4 h,原生質體的再生率最高,可達19.30%,酶解時間超過4 h后,再生率逐漸下降。因此,酶解時間的長短會影響原生質體的再生率,綜合原生質體的釋放和再生率,甜瓜蔓枯病菌原生質 體的最佳酶解時間是4 h。
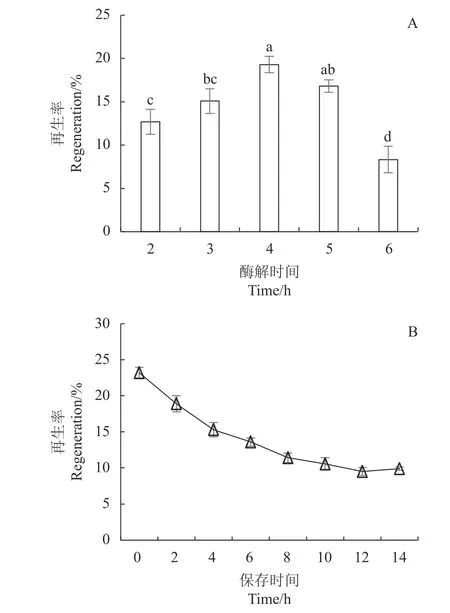
圖 6 酶解時間和存放時間對原生質體再生率的影響Fig. 6 Effects of enzymatic digestion time and storage time on protoplast regeneration rate
2.2.3 原生質體的保存時間與再生率的關系 將制備的原生質體分別保存在?80 ℃冰箱中2、4、6、8、10、12、14 h,之后取出解凍利用SR培養基再生,明確保存時間對再生率的影響。由圖6-B可知,隨著存放時間的延長原生質體的再生率下降明顯,并且表現為初期下降較為明顯,存放10 h之后,下降趨 勢逐漸平緩,最終維持在10%左右。
3 討論與結論
優化和完善原生質體的制備和再生體系,是建立甜瓜蔓枯病菌高效遺傳轉化系統的必要條件之一。從本質上講,原生質體的制備過程是一個酶促反應,影響酶促反應的因素主要有酶濃度、酶解時間、溫度和酶解體系的環境等,本研究探討甜瓜蔓枯病菌原生質體制備和再生的適宜條件,為進一步開展甜瓜蔓枯病菌功能基因研究提供技術支持。
菌齡不同的細胞,其細胞壁的薄厚程度和結構也不盡相同。菌絲培養時間過短,細胞壁比較幼嫩,形成的原生質體大小不一,釋放后更容易被破壞;菌絲培養時間過長,組織老化,產生對降解酶耐受的結構,不容易被降解,原生質體的產量反而下降[14],因此,要選擇合適菌齡的菌絲體才能制備出高效的原生質體。張婷[15]研究發現,黑曲霉(Aspergillus niger)在培養4 d時收集菌絲制備的原生質體數量最多;大麗輪枝菌的分生孢子在YPED培養基中搖培18 h產生的菌絲最適宜制備高效的原生質體[8],而馬鈴薯晚疫病菌的最佳菌齡是18 d[16]。不同病原真菌的最佳菌齡各不相同,本研究明確了甜瓜蔓枯病菌制備原生質體的最佳菌齡是36 h。
不同病原真菌細胞壁的組分與結構不盡相同,因此所需的裂解酶也不同。陳孝仁等[17]研究發現使用Driselase和Lysing enzyme兩種混合酶可產生較多的原生質體,楊樹腐爛病菌的原生質體制備過程中,利用這兩種混合酶也能產生較多的原生質體[7],本研究中利用20 g·L?1Driselase和8 g·L?1Lysing enzymes兩種混合酶也能起到較好的酶解作用。影響酶促反應的另一個關鍵因素就是溫度和時間,溫度過高或過低,均不利于酶促反應,一般單一的裂解酶其最適工作溫度都是固定的,但是混合酶的最適溫度就需要測定,本試驗中,這兩種混合酶的最適酶解溫度是30 ℃。酶解時間的長短也直接影響原生質體的數量和質量,由于菌絲的菌齡不可能完全一致,在酶解過程中,幼嫩的菌絲首先被酶解釋放出原生質體,隨后較老的菌絲才開始產生原生質體,所以隨著酶解時間的延長,原生質體的產量不斷增加,但時間超過達到4 h后,甜瓜蔓枯病菌原生質體的數量開始下降。這可能是由于先釋放出的原生質體長時間暴露在酶液中,酶液中蛋白酶對原生質體膜造成損害而導致原生質體破裂[7?8]。
滲透壓穩定劑不僅是維持原生質體活力的重要因素,也是發揮酶活性的重要場所,常用的滲透壓穩定劑主要是有機類化合物和無機鹽溶液,趙小強[8]的研究發現大麗輪枝菌制備原生質體的最佳滲透壓穩定劑是1.2 mol·L?1的KCl溶液,根據姚婷婷[18]的研究,利用山梨醇作為滲透壓穩定劑黑曲霉(Aspergillus niger)原生質體的產量最高,伏建國[14]研究認為0.7 mol·L?1的NaCl溶液是鏈格孢菌(Alternaria alternata)的最佳滲透壓穩定劑,本研究選用0.7 mol·L?1的NaCl作為滲透壓穩定劑,原生質體的產量最高。
原生質體的再生能力是衡量獲得的原生質體質量最關鍵的指標,而選擇合適的再生培養基可以有效提高原生質體的再生率。在甘藍枯萎病菌中,利用SR培養基再生原生質體再生率可達21.13%[9],大麗輪枝菌中SR培養基比PDA更有利于原生質體的再生[8]。本研究通過對甜瓜蔓枯病菌原生質的再生發現,SR和TB3培養基對原生質體的再生率為22.53%和22.38%,均能作為甜瓜蔓枯病菌原生質的再生培養基。

