牦牛卵泡發育及卵母細胞成熟過程中CYP19A1表達差異分析
孫 瑩,王 萌,孫曉軍,王靖雷,馬 睿,余四九,潘陽陽*
(1.甘肅農業大學 動物醫學院,甘肅 蘭州 730070;2.蘭州市動物疫病預防控制中心,甘肅 蘭州 730050)
牦牛(Bos grunniens)主要分布在海拔3 000~5 000 m的青藏高原地區,該地空氣稀薄、草料短缺。目前,牦牛為人類提供牦牛肉、牦牛奶、皮革制品,也可作為交通工具、使役工具,抗逆性極強,是牧民重要的生活來源、經濟來源[1-3]。牦牛雖屬于季節性多次發情的動物,但與生活在平原的其他家畜相比,70%的雌性個體在發情季節只發情一次,一頭成年牦牛平均繁殖率約48.61%,又因地處惡劣多變的高原環境,發情時間、生產性能極易受到季節性變化及牧草質量的影響[4,5]。目前,對牦牛卵巢的研究多集中于解剖學范疇,而在分子機制上尚不完善[6]。因此,本研究以牦牛為模型,探究CYP19A1在不同發育時期卵泡及卵母細胞上的表達以及對牦牛生殖生理的調控。
卵巢是雌性哺乳動物重要的生殖器官,具有促進卵泡生長、排卵、黃體形成及溶解的功能,對哺乳動物的繁殖力起決定性作用[7,8]。卵泡在卵巢中成熟的過程是受多種激素、細胞因子調節的復雜生物過程,其中以甾體激素為主要調節機制。CYP19A1是細胞色素P450(Cytochrome P450,CYP450)家族的成員之一,在卵巢、胎盤、垂體等組織中均有不同程度的表達。由CYP19A1編碼的細胞色素P450芳香化酶是該通路的關鍵限速酶,卵泡膜細胞雄激素是E2的前體,它通過卵巢顆粒細胞的E2合成通路合成E2,即在粒細胞中催化雄激素轉變為雌激素[9]。其中,E2是雌激素中活性最高、妊娠期間母體最主要的雌激素。在分子水平上,E2促進卵巢顆粒細胞的增殖,抑制其凋亡和卵泡閉鎖。研究表明,抑制CYP19A1的表達會導致E2分泌不足,卵泡閉鎖,無黃體生成[10,11]。因此,本研究檢測CYP19A1在牦牛不同級別卵泡及卵母細胞成熟過程中的表達水平及位置分布,旨在進一步研究CYP19A1在牦牛雌性生殖中的作用機制,為探索牦牛特殊的生殖生理奠定基礎。
1 材料與方法
1.1 主要試劑
磷酸緩沖鹽溶液(phosphate buffered saline,PBS)、杜氏磷酸鹽緩沖液(Dulbecco’s phos-phate buffered saline,D-PBS)購自Sigma公司(美國);胎牛血清(fetal bovine serum,FBS)購自PAN公司(澳大利亞);TransZol RNA提取試劑盒(TransGen,北京);Evo M-MLV反轉錄試劑盒Ⅱ(艾科瑞生物,湖南);SYBR GreenⅡ熒光定量PCR試劑盒(寶生物,大連);CYP19A1 Antibody(親科生物,常州)、免疫熒光檢測試劑購于南京碧云天生物公司。
1.2 樣品采集與體外培養
2020年8—12月于青海省西寧市馬佳肴屠宰場采集牦牛卵巢,置于裝有35℃含抗生素(青鏈霉素)的生理鹽水中,4 h內帶回實驗室。37℃生理鹽水(含青鏈霉素)清洗3遍,用帶有18G針頭的注射器(防止針頭過細刮傷卵母細胞)抽取卵巢表面2~8 mm卵泡中的卵泡液,將提前在37℃恒溫箱內平衡后的采卵液(D-PBS+5%FBS)與卵泡液在離心管中混勻;將混合后的采卵液倒入50 mm培養皿中,置于體視顯微鏡下,用撿卵針挑選并移入裝有37℃采卵液的培養皿中,用無血清PBS清洗3次;然后轉入卵母細胞成熟培養液中,在37℃、5%CO2和飽和濕度培養箱中進行培養。分別收集未成熟卵母細胞(0 h)、成熟12 h卵母細胞、成熟18 h卵母細胞和成熟卵母細胞(24 h)各40枚,將不同階段卵母細胞分為兩份,一份用于提取RNA,-80℃保存,另一份置于固定液用于后續免疫熒光染色。
1.3 牦牛COCs及卵泡液總RNA的提取與反轉錄
對于編碼基因的定量,首先需參照TransZol RNA提取試劑盒和Evo M-MLV反轉錄試劑盒Ⅱ說明書,分別提取不同成熟階段COCs的RNA(0 h、12 h、18 h和24 h)和卵泡大小為0~3 mm、3~5 mm、5~8 mm及大于8 mm時卵泡液的RNA,反轉錄合成相應cDNA,存于-20℃,用于后續qRT-PCR檢測。
1.4 設計引物
根據Genbank上所公布的牛的CYP19A1、β-Actin基因的基因序列,使用Primer 5軟件設計引物,由生工生物工程(上海)股份有限公司合成所需引物,其詳細信息及反應條件見表1,利用普通PCR對引物進行初步驗證。

表1 CYP19A1引物信息
1.5 qRT-PCR技術檢測CYP19A1基因的相對表達量
使用LightCycler? 96 SW 1.1(Roch,Switzerland)實時熒光定量PCR儀,總體系20 μl,反應體系為模板cDNA 1 μl(500 ng/μl),上、下游引物各0.5 μl(0.2 μmol/ml),2*SYBR GreenⅡ PCR mix 10 μl,ddH2O 8 μl。反應條件為95℃預變性10 s;95℃變性10 s、退火10 s(具體溫度見表1)、72℃延伸10 s,重復共40個循環,建立4個重復,設置β-Actin為內參基因,根據熔解曲線確定反應特異性,利用所得每個樣品的循環閾值(Ct值),采用2-ΔΔCt法計算CYP19A1的相對表達量。
1.6 免疫熒光染色檢測COCs中CYP19A1蛋白的表達
通過免疫熒光染色技術對卵丘—卵母細胞復合體的CYP19A1蛋白進行定位檢測,首先對在4℃用交聯劑(4%多聚甲醛)固定后的細胞進行通透處理,以保證后續抗體能夠順利進入相應抗原位點,其次使用免疫封閉液孵育1 h,使非特異性結合蛋白位點封閉,再用CYP19A1抗體4℃孵育過夜,清洗3遍后用二抗孵育結合,再清洗3遍用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色,最后清洗3遍封片鏡驗,用奧林巴斯熒光倒置顯微鏡觀察并拍照。
1.7 數據分析
對所得結果進行單因素方差分析(oneway,ANOVA),每組至少重復3遍以上,所有數據用平均值±標準誤(mean±SE)表示,通過Graphpad prism 7繪制柱狀圖(P<0.05表示差異顯著)。
2 結果與分析
2.1 CYP19A1引物特異性檢測
2.1.1 核酸電泳檢測引物特異性 對卵泡液、COCs的RNA反轉錄所得的cDNA進行普通PCR擴增,CYP19A1、β-Actin PCR產物大小分別為184 bp、143 bp,核酸電泳結果如圖1所示,可見片段大小與預期一致,條帶成像清晰,無非特異性結合片段。由此可見,所設計的引物特異性良好、模板質量高。需特別注意CYP19A1基因在卵泡大小為3~5 mm及大于8 mm的卵泡液中不表達,具體結果可結合后續實時熒光定量PCR進行分析。
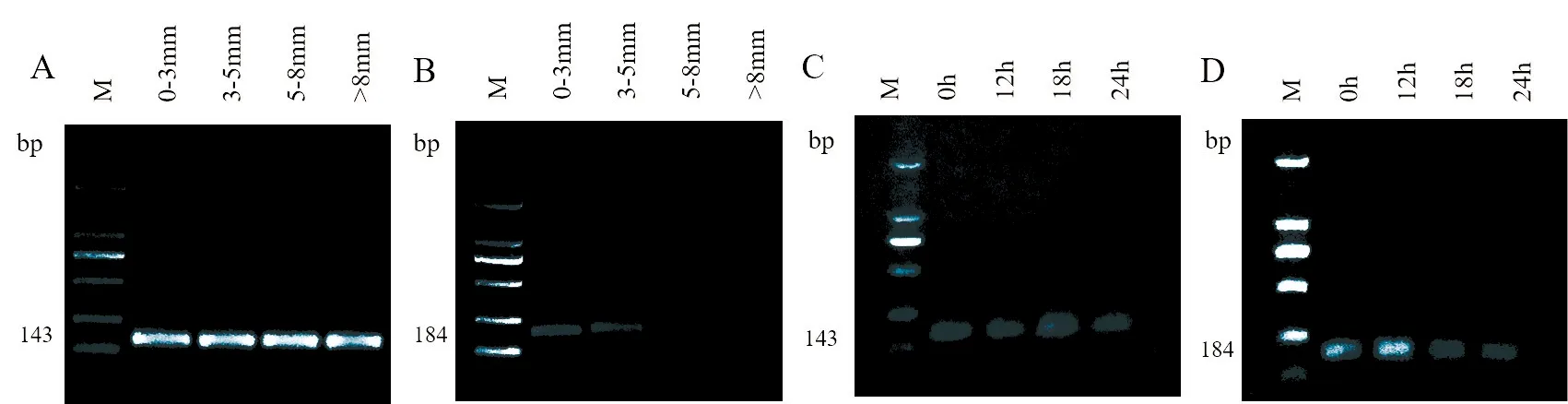
圖1 CYP19A1在卵泡液和卵母細胞中表達的核酸電泳結果
2.1.2 qRT-PCR技術檢測CYP19A1擴增所得熔解曲線的結果 通過qRT-PCR技術檢測CYP19A1的擴增情況,驗證其引物特異性,結果如圖2所示。熔解曲線是單峰,且出峰位置即退火溫度,再次證明該引物特異性良好。
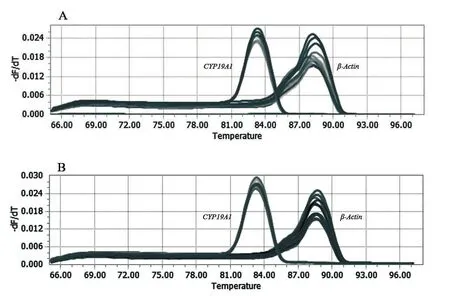
圖2 qRT-PCR檢測CYP19A1擴增所得熔解曲線的結果
2.2 qRT-PCR技術檢測CYP19A1在不同階段卵泡液和COCs中的表達結果
qRT-PCR結果如圖3所示,CYP19A1在卵泡液發育的各個時期均表達,相對表達量隨卵泡增大呈逐漸下降趨勢。在卵泡大小為0~3 mm時,CYP19A1的相對表達量最高,卵泡大小大于5 mm的卵泡液中CYP19A1表達量已呈現較低水平。同樣在COCs成熟的各個階段均表達,在未成熟的COCs中,CYP19A1的相對表達量最低,成熟18 h的COCs中相對表達量達到最高值,之后呈下降趨勢。
2.3 免疫熒光染色檢測CYP19A1蛋白在COCs上的表達定位
對不同發育時期的COCs進行免疫熒光染色處理后,結果如圖4所示,CYP19A1在不同時期COCs的卵丘細胞、卵母細胞中均有表達,并且目的蛋白表達位置與骨架蛋白β-Tubulin表達位置一致。同時,由圖4可見在成熟18 h的COCs卵丘細胞中CYP19A1蛋白的熒光信號更明顯,對比DAPI細胞核標記,CYP19A1主要在卵丘細胞的細胞質中表達。
3 討論
由垂體釋放的催乳素(Prolactin,PRL)、促卵泡素(Follicle-stimulating hormone,FSH)、促黃體生成素(Luteinizing hormone,LH)共同作用,能顯著促進促性腺激素釋放激素(Gonadotrophin releasing hormone,GnRH)誘導的睪酮(Testosterone,T)和雌二醇的釋放[12,13]。誘導卵巢顆粒細胞釋放類固醇激素,調控卵泡和顆粒細胞的生長發育以及相關基因(FSHR、LHR、CYP11、CYP19)的表達,其中基因CYP19A1的表達活化芳香化酶,催化雄激素芳香化,將睪酮轉化為雌二醇,誘導卵泡正常發育、優勢卵泡的選擇、維持卵巢正常的組織結構[14-16]。由此可見,卵泡和顆粒細胞的生長發育均依賴于E2的分泌,CYP19A1在其中起關鍵的調控作用,是母畜提高繁殖力的重要保障[17]。另有研究表明,敲除小鼠CYP19A1基因,E2分泌量下降,卵泡由此發生閉鎖,卵巢無黃體產生,雌性動物性狀發育偏雄性化,甚至引起小鼠不孕[18-20]。由此可見,CYP19A1對雌性哺乳動物的發育繁殖產生積極影響,特別是對卵泡的擴張、卵母細胞的成熟發揮關鍵作用。因此,本研究以牦牛不同發育時期的卵泡和不同成熟階段的卵丘—卵母細胞復合體為模型,對提高牦牛生產性能具有重要的實踐意義。
通過利用qRT-PCR技術對不同發育時期的卵泡及卵母細胞中CYP19A1基因的相對表達量進行檢測,結果顯示CYP19A1基因在卵泡大小為0~3 mm時的表達量最高,隨著卵泡大小的擴增、卵泡的成熟,表達量逐漸降低,而在COCs發育早期表達量相對較低,COCs成熟18 h時表達量最高。由此可見,CYP19A1在卵泡發育早期主要集中于卵母細胞,在卵子形成過程中發揮重要作用,促使卵泡擴張,而在卵泡細胞發育后期,CYP19A1的表達則集中于卵丘細胞上,通過誘導顆粒細胞釋放E2,加速卵丘細胞與卵母細胞的營養交換、物質代謝,以卵母細胞為靶細胞表達,促進卵母細胞成熟。根據免疫熒光染色結果與上述結果對應,CYP19A1在COCs的卵丘細胞中熒光強度更高,推測CYP19A1在COCs中主要在卵丘細胞中表達,誘導激素分泌,作用于卵母細胞,增強卵丘細胞與卵母細胞間的物質代謝,促進卵母細胞的成熟。
4 結論
本試驗在牦牛不同級別卵泡發育及卵母細胞成熟的過程中對CYP19A1的表達進行定位分析,研究發現CYP19A1基因在牦牛不同級別的卵泡及卵母細胞中均有表達,其中分別在卵泡發育早期(0~3 mm)、成熟18 h的COCs中表達量最高,免疫熒光染色結果顯示CYP19A1在COCs中的表達主要集中在卵丘細胞,推測CYP19A1參與并促進卵泡的發生和卵母細胞的形成,揭示了CYP19A1在雌性牦牛的生殖過程中對卵泡發育和卵母細胞的成熟均起到積極的調控作用,為進一步探索牦牛生殖生理中的分子機制奠定了基礎。

