基于循環生成對抗網絡的鼻咽癌CBCT圖像修正
全科潤,程品晶,陳榕欽,柏朋剛,陳濟鴻,黃妙云,陳彥宇,洪加標
1.南華大學核科學技術學院,湖南衡陽421001;2.福建省腫瘤醫院放療科,福建福州350014;3.福建醫科大學附屬協和醫院放療科,福建福州350001
前言
放射治療是鼻咽癌的主要治療方式,治療過程往往持續數周。隨著治療分次的增加,患者腫瘤及周圍組織的解剖結構和劑量分布將發生變化,若繼續采取原放療計劃方案進行照射,可能造成靶區劑量分布改變,并帶來嚴重的放療并發癥,影響放療精確性[1-2]。自適應放療(Adaptive Radiation Therapy,ART)通過在某次治療過程中獲取新的引導影像分析分次放療與原放療計劃之間的差異,指導并調整后續分次放療計劃,是未來放射治療發展的趨勢[3]。錐形束CT(Cone-beam Computed Tomography,CBCT)能采集患者治療期間內的解剖信息,廣泛應用于圖像引導的放射治療。但由于偽影及重建技術的限制,對于具有相同電子密度的材料,CBCT圖像和CT圖像的CT值(Hounsfield Unit,HU)有較大偏差,因此未經HU值修正的CBCT圖像不能直接用于劑量計算,這限制了其在ART中的應用潛力[4]。CBCT圖像HU值的傳統校準方法主要有基于模體的電子密度曲線刻度方法[5]、基于特定患者的方法[6]及基于體素形變配準的方法[7]等。近年來,深度神經網絡在圖像處理領域取得巨大突破,尤其是生成對抗網絡(Generative Adversarial Network,GAN),現已廣泛用于圖像風格遷移[8]。在醫學圖像處理領域中,GAN廣泛用于從MRI圖像遷移生成偽CT(Synthesized CT,sCT)圖像,這說明GAN可能是醫學圖像轉換的潛在工具[9-10]。本研究擬使用循環生成對抗網絡(Cycle-consistent Generative Adversarial Network,CycleGAN)深度學習算法[11]對鼻咽癌CBCT圖像進行遷移,生成sCT圖像,對比sCT圖像與計劃CT(Planning CT,pCT)圖像的HU值及平滑性,從而探討該算法應用于鼻咽癌CBCT圖像HU值修正的應用價值。
1 材料與方法
1.1 數據獲取及預處理
所有CT圖像及CBCT圖像來自2019年10月~2020年2月在福建省腫瘤醫院接受放射治療的39例鼻咽癌患者。CT圖像采集于PHILIPS Brilliance Big Bore,球管電壓設置為120 kV,X射線管電流為225 mA,切片尺寸為512×512;CBCT圖像采集于Elekta XVI,球管電壓為120 kV,X射線管電流為25 mA,圖像體素分辨率為(1×1×1)mm3,切片尺寸為410×410。CBCT圖像均在患者首次治療前獲得。通過開源軟件Elatix,選擇剛性配準算法對CT圖像和CBCT圖像進行配準,以CBCT圖像為基準,將CT圖像重采樣到CBCT圖像體素及尺寸大小,將所得的重采樣pCT圖像作為本研究圖像評價的金標準。為避免頭枕、治療床等非解剖結構對訓練產生影響,基于閾值分割及形態學處理方法創建外輪廓的二進制掩膜,將掩膜外的區域體素值設置為-1 000 HU。將待訓練圖像的HU范圍裁剪至[-1 000,2 000]。由于計算機GPU顯存的限制,本研究采用的是二維CycleGAN模型。在輸入模型之前,pCT與CBCT均從圖像中心裁剪至256×256尺寸大小且CT值均歸一化到[-1,1]之間。選擇30例患者為訓練集,每位患者取70張切片,共包含2 100張pCT圖像和CBCT圖像;其余9例為測試集,共有630張pCT圖像和CBCT圖像。
1.2 CycleGAN算法模型
傳統的GAN依賴于生成器與鑒別器的互相博弈學習產生較好的輸出結果。本研究采用的CycleGAN模型相比較于傳統GAN增加了逆向循環GAN,雙重約束模型以提高輸出圖像的準確性。
如圖1所示,該模型由兩個生成器與兩個判別器組成。在前向循環中,CBCT通過生成器GpCT生成類pCT域的sCT圖像,再通過GCBCT重構回類CBCT域的循環CBCT(Cycle Cone-Beam Computed Tomography,CCBCT)圖像。同理,逆向循環中,pCT通過GCBCT生成偽CBCT(Synthesized Cone-Beam Computed Tomography,SCBCT)圖像,并通過GpCT重構生成循環CT(Cycle Computed Tomography,CCT)圖像。判別器DpCT和DCBCT用于判別輸入圖像是否為真實域圖像,確保圖像的遷移。訓練過程中,生成器的目標是盡可能生成對方領域的圖像以欺騙各自相對應的判別器。判別器的目標是提高鑒別能力,減少分辨誤差。隨著生成器與鑒別器不斷對抗優化,最終達到動態平衡。CycleGAN損失函數分為對抗損失和循環一致性損失,計算公式如下:
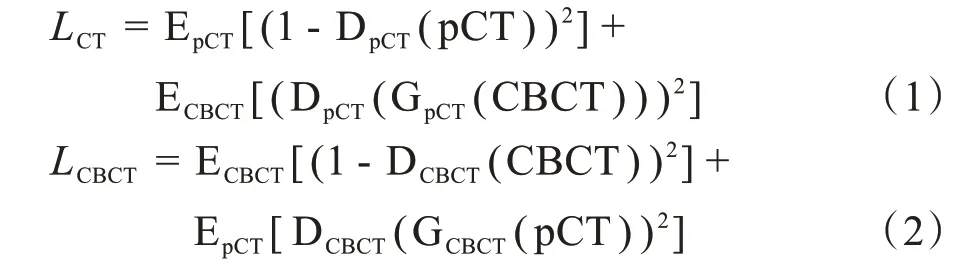
式(1)、式(2)為對抗損失函數。其中,EpCT[(1-DpCT(pCT))2]是pCT輸入判別器DpCT之后所得實際判別值與理想值之間均方誤差的期望值,ECBCT[(DpCT(GpCT(CBCT)))2]是CBCT輸入生成器GpCT得到sCT之后再輸入判別器DpCT所得的實際判別值與理想值之間均方誤差的期望值。ECBCT[(1-DCBCT(CBCT))2]、EpCT[DCBCT(GCBCT(pCT))2]同理。
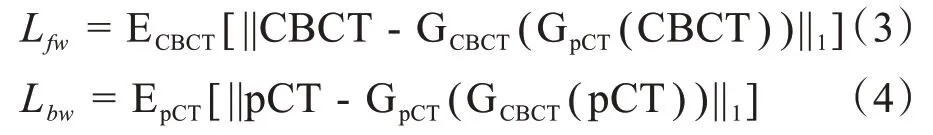
式(3)、式(4)為循環一致性損失函數。ECBCT[||CBCT-GCBCT(GpCT(CBCT))||1]是CBCT輸入GpCT得到sCT之后再輸入生成器GCBCT所得CCBCT與輸入CBCT之間平均絕對誤差的期望值。EpCT[||pCT-GpCT(GCBCT(pCT))||1]同理。
在整個訓練期間,通過總目標函數Lcyclegan并行優化生成器與判別器。
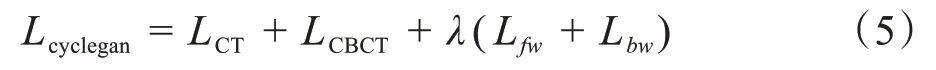
式(5)中λ為循環一致性損失與對抗性損失的權重比,用來調節最終生成數據之間的相關性。
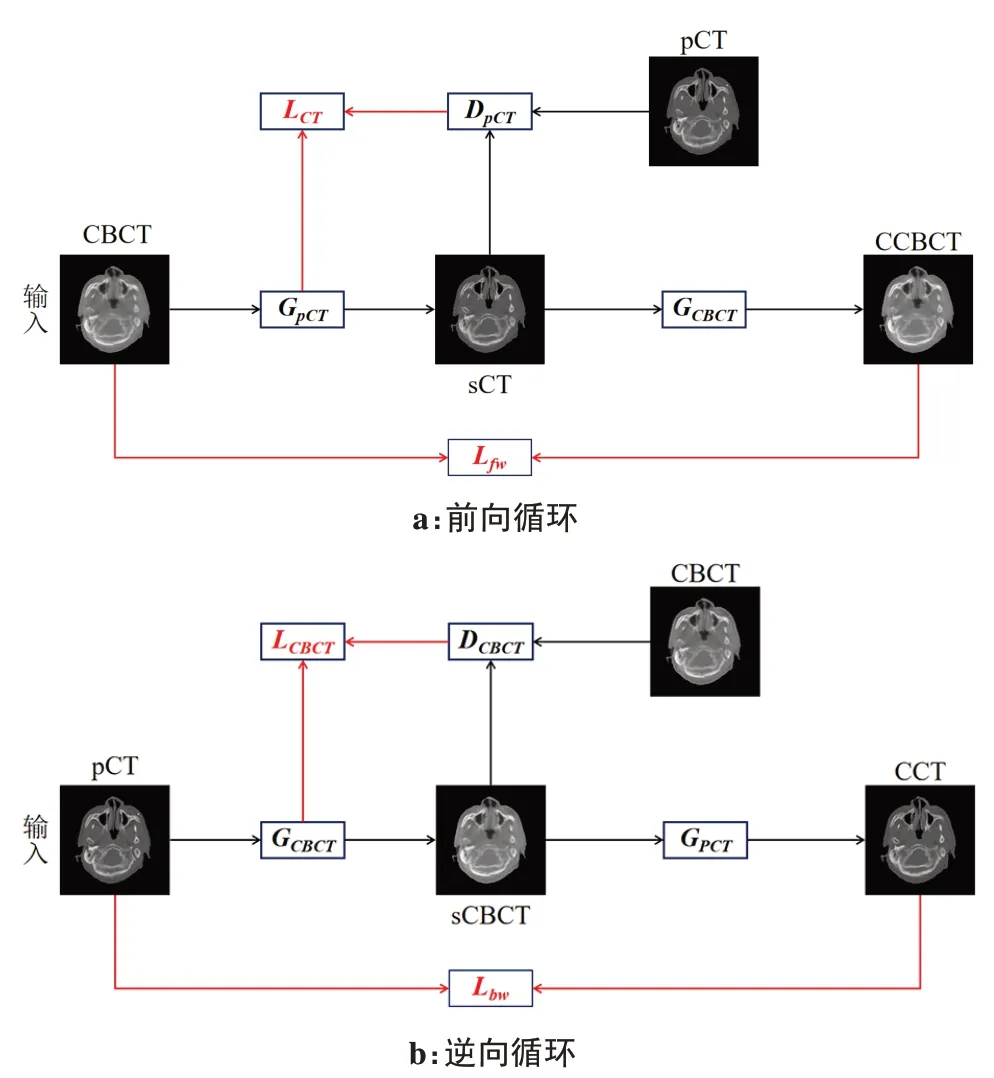
圖1 CycleGAN模型Fig.1 Illustration of cycle-consistent generative adversarial network(CycleGAN)
1.3 網絡結構及參數設計
生成器G由編碼層、轉換層和解碼層組成。輸入圖像經過編碼層以減少特征圖大小,再經過9層ResNet[12]殘差模塊轉換為目標域的特征向量,最后經過解碼層得到合成圖像,實現端到端遷移。判別器D為一個二分類網絡,輸出在[0,1]之間。所有網絡均在Tensorflow框架下實現,λ設置為10,采用Adam算法進行優化[13],取一階矩衰減系數β1=0.5,二階矩衰減系數β2=0.5,batchsize=2,epoch=100,初始學習率為0.000 2,在20個epoch后學習率線性衰減。
1.4 HU值評估
使用平均絕對誤差(Mean Absolute Error,MAE)和平均誤差(Mean Error,ME)比較測試集sCT、CBCT與pCT之間的差異。計算公式如下:
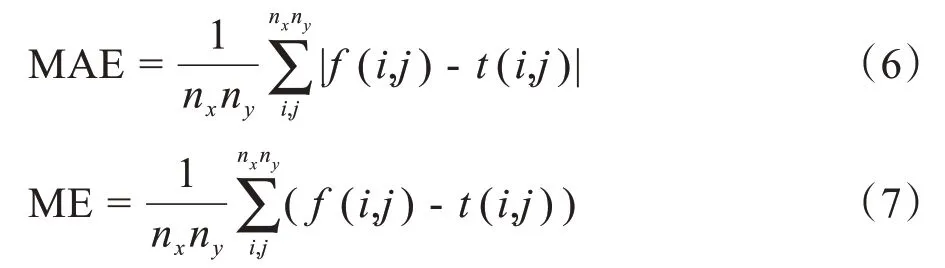
其中,f(i,j)為掩膜內pCT圖像(i,j)處的像素值;t(i,j)為待比對圖像(i,j)處的像素值;nxny為像素總數。
2 結果
2.1 MAE和ME評估
9例測試集的CBCT圖像與pCT圖像以及sCT圖像與pCT圖像之間的MAE與ME見圖2。在體內區域(CT值分布在-1 000-2 000 HU),sCT圖像與pCT圖像的MAE為(99.00±15.37)HU,ME為(-24.00±12.64)HU。對軟組織區域而言(CT值分布在-100~150 HU),sCT圖像與pCT圖像的MAE為(48.00±7.45)HU,ME為(-7.00±8.96)HU。
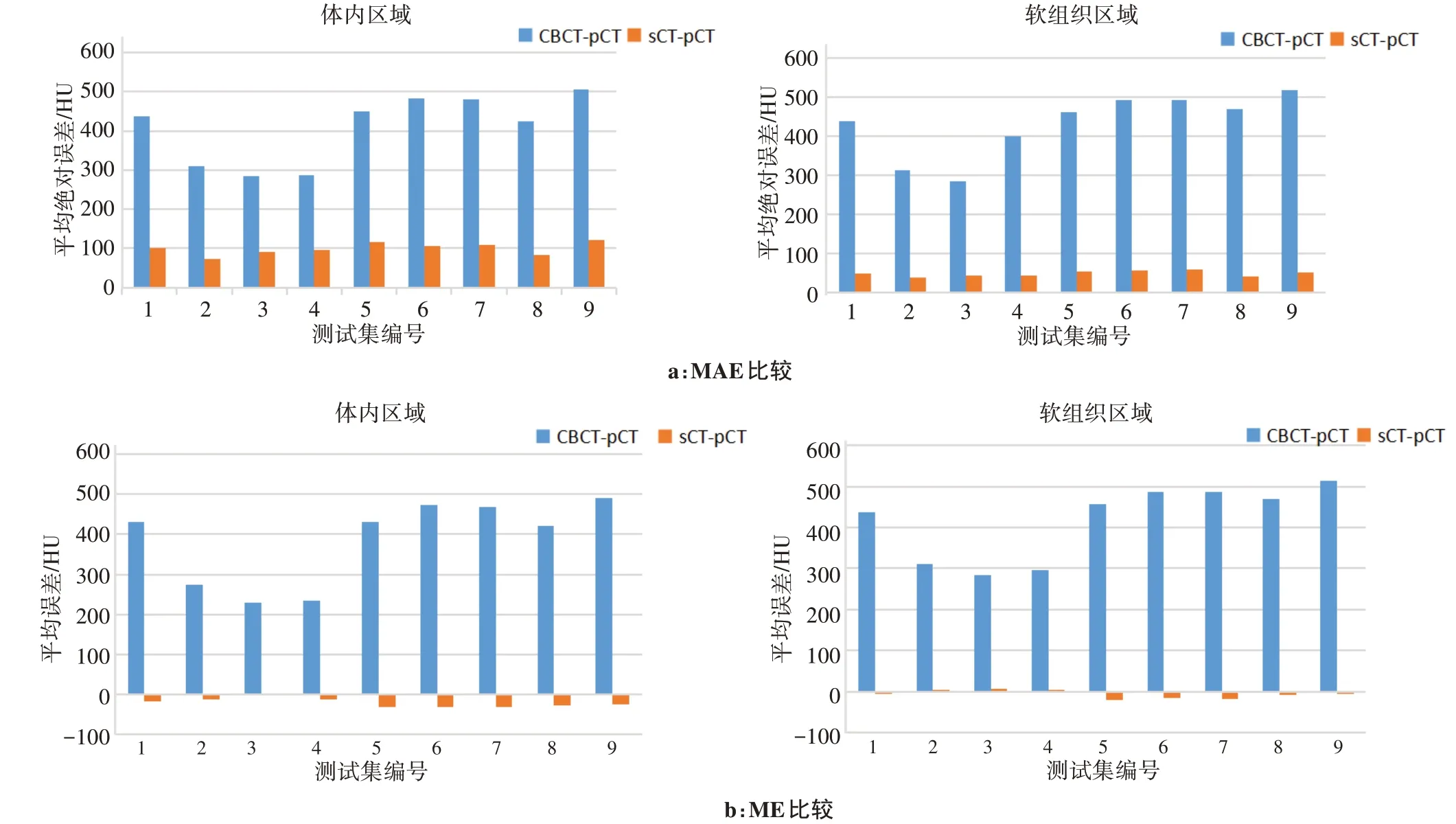
圖2 測試集CBCT圖像與sCT圖像之間的MAE和ME比較Fig.2 Comparison of MAE and ME between CBCT images and sCT images for test datasets
2.2 HU值分布曲線
在測試集中隨機選擇一位患者,比較sCT圖像的HU值分布情況(圖3)。在Line a的HU分布曲線中,區域1處sCT圖像的MAE為50.6 HU,區域2處為275.3 HU;在Line b的HU分布曲線中,區域1處sCT圖像的MAE為9.1 HU,區域2處為132.6 HU。
3 討論
CBCT技術已廣泛應用于圖像引導的放射治療,在整個治療過程中能準確反映擺位誤差及器官解剖結構發生變化的信息,但重建技術及噪聲偽影使其與CT圖像的HU值存在較大偏差,因此當CBCT圖像用于劑量計算時需要對HU值進行修正。
Zhang等[14]通過線性擬合方法得到鼻咽癌扇形束CT圖像與CBCT圖像的HU值近似函數,并根據放射治療計劃系統中扇形束CT電子密度曲線及該擬合函數,轉換后獲得修正后的CBCT電子密度曲線,并進行基于CBCT圖像的劑量計算。結果表明經修正后的CBCT圖像與扇形束CT圖像的MAE差異為111.9 HU,在2%/2 mm標準下,Gamma驗證通過率分別為97.60%±0.83%和97.74%±2.08%。Barateaua等[15]提出基于GAN的深度學習算法來修正CBCT圖像,合成CT圖像在整個體表輪廓內的MAE為82 HU,軟組織的MAE為69 HU,在2%/2 mm標準下,Gamma驗證通過率為98.1%±1.2%,優于HU電子密度刻度方法(91.0%±5.3%)。
本研究探索利用CycleGAN算法對鼻咽癌CBCT圖像進行遷移,生成與pCT圖像HU值相似的sCT圖像,以實現CBCT圖像的修正。通過對9例測試集生成的sCT圖像HU值進行評估,結果顯示通過本方法遷移合成的sCT圖像與pCT圖像偏差較小。相比于上述CBCT圖像修正的相關工作,本方法所遷移的sCT圖像的MAE相比線性擬合方法更低(99 HUvs119 HU)[14],雖在整個體表輪廓內的MAE略高于Barateaua等[15]方法(99 HUvs89 HU),但在軟組織區域的修正效果更好(48 HUvs69 HU)。圖3區域2可見本文算法遷移誤差主要集中在峰值附近區域,這可能是由于訓練數據較少,生成器在上采樣過程中丟失局部特征等原因造成。由于MAE是逐個像素進行比較,該區域在整個圖像所占份額少,絕大部分為軟組織區域,因此該區域誤差對實際劑量計算的影響較小。除此之外,本算法遷移生成圖像在平坦區域處的平滑度與pCT圖像相當(如圖3Line b中區域1),與Li等[16]基于U-net模型合成CT圖像的結果一致。本課題組以往研究結果表明,當CT值差異為68 HU時,靶區劑量學差異為1.5%,脊髓差異為2%左右[17],因此使用本研究算法遷移生成的sCT圖像可應用于劑量計算。
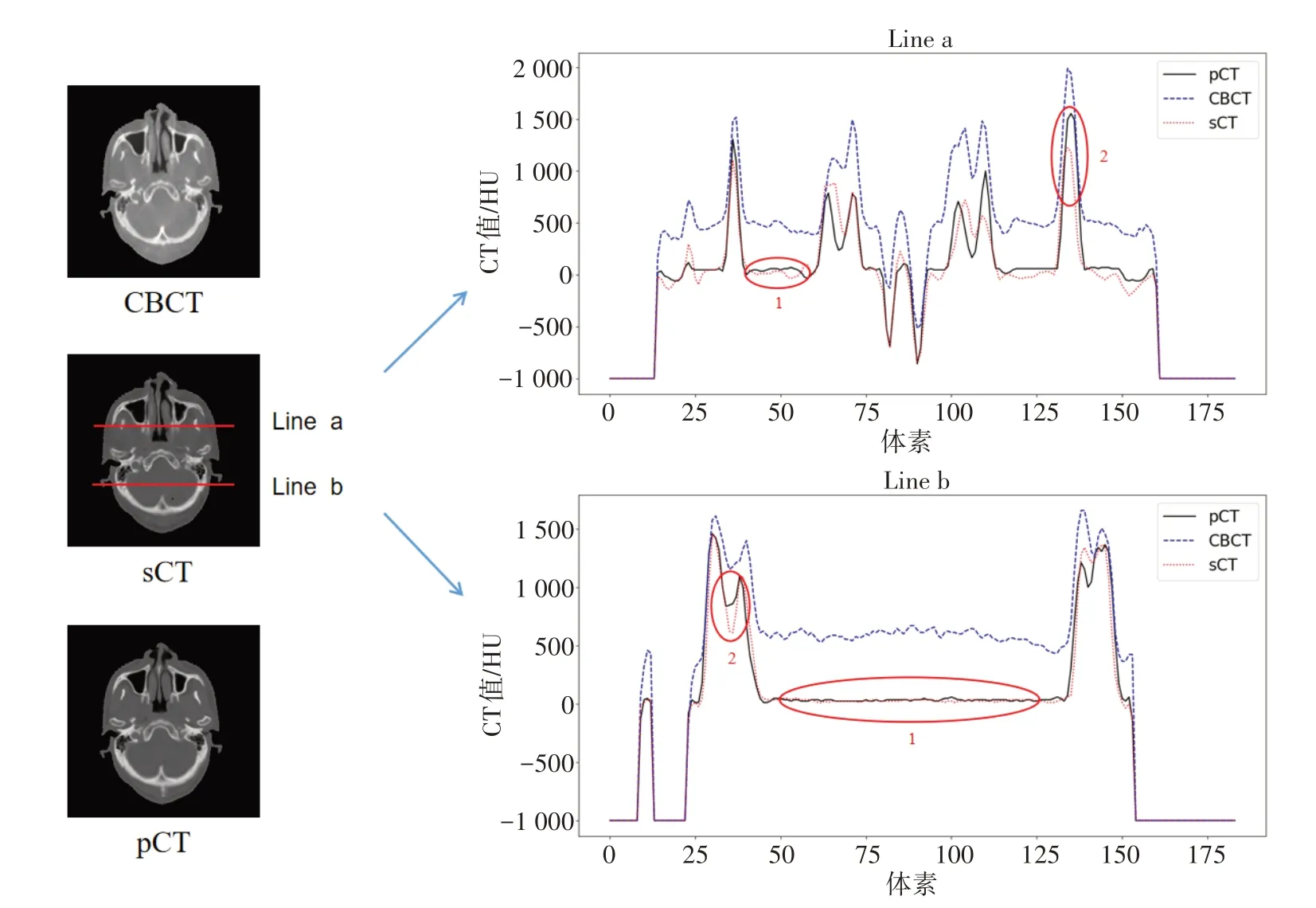
圖3 CBCT、pCT及sCT圖像的HU值分布比較Fig.3 Comparison of HU profile among CBCT,pCT and sCT images
雖然基于本研究的算法可以較好地修正CBCT圖像HU值,但該算法采用的是二維模型,忽略了圖像層間信息,如果采用三維模型預期能取得更好的效果[18-19]。其次,由于預處理配準時采用的是剛性配準算法,重采樣CT圖像與CBCT圖像之間存在一定的不確定性偏差,改進配準算法提高配準精度能使sCT更加精確[20]。在未來的研究中本課題組將會優化配準方法及算法模型,并進行基于遷移sCT的劑量學研究,進一步對該算法進行驗證。
綜上所述,基于CycleGAN模型的深度學習算法能有效修正CBCT圖像HU值,遷移生成的sCT圖像的HU值及平滑度與CT圖像相似,可應用于劑量計算,為CBCT在精確放療中的應用提供幫助。

