宏觀角度下有機電解質鋰空氣電池放電機理研究
崔建弘,楊靜宜,張紅梅,楊俊巖
(1.河北工程技術學院,河北 石家莊 050000;2.中國電子科技集團公司 第13 研究所,河北石家莊 050000)
鋰空氣電池[1-2]因具有比能量高、無毒無污染、質量輕等特點,是最有應用前景的新技術產品之一,備受廣大科研工作者關注。鋰空氣電池研究工作[3-5]大多集中在催化劑、電解質方面,聚焦于電解質物理、化學性質與鋰空氣電池性能;國外學者[6-7]采用XPS、FT-IR、XRD 技術手段研究鋰空氣電池電解質穩定性與溶劑、鋰鹽相容性的關系。從宏觀角度分析有機電解質鋰空氣電池放電反應機理[8-10]研究極少。
本文采用有限元方法,從宏觀角度建立了鋰空氣電池傳質示意圖和放電數學模型并分析放電特性。
1 放電模型建立
1.1 幾何模型
鋰空氣電池正極為多孔碳電極(空氣電極),負極為金屬鋰單質,正極和負極之間有隔膜,隔膜內浸透有機電解質。放電過程中,負極金屬鋰單質被氧化成鋰離子并釋放電子,通過外接電路將電子輸送至正極;正極鋰離子得到電子,與電解質中氧氣發生還原反應,生成過氧化鋰或氧化鋰,過氧化鋰產率高,且容易滯留堆積在正極表面。放電過程,電池電化學反應見式(1)和式(2)。
如圖1 所示,鋰空氣電池外接負載。電池高(H)750 μm,正極厚(Ln)750 μm,隔膜厚(Lm)為50 μm。與正極相比,負極過電勢較小,反應速度較快,所以電化學模型可不考慮負極厚度對放電速率的影響。隔膜和負極之間接觸截面定義為X方向傳質路徑的原點。
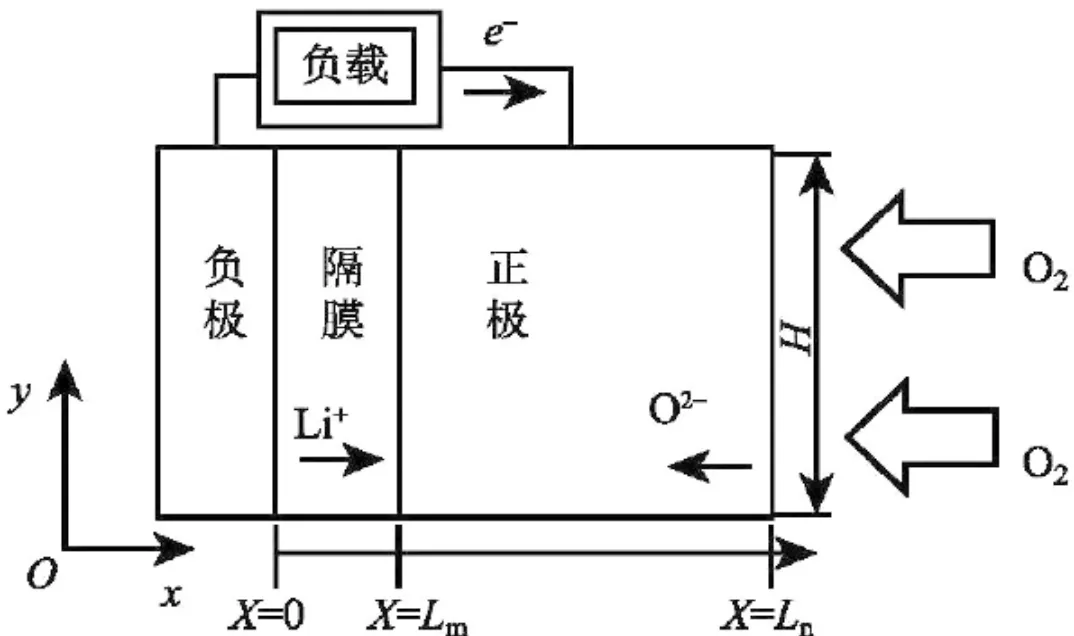
圖1 電池構成及放電時X向傳質示意圖
1.2 數學模型
本研究建立的數學模型(包括正極反應與反應產物沉積過程),假設如下:①固相沉積物為過氧化鋰;②有機電解質連續存在;③負極能提供充足的鋰離子。
在無對流情況下,電池中氧氣質量和鋰離子傳遞的遷移通量方程和擴散方程如下:
遷移通量方程:

擴散方程:
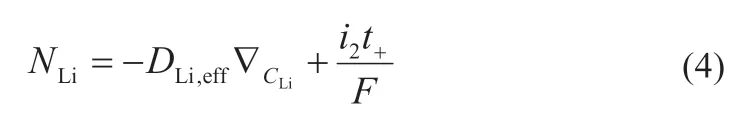
式中:DO2,eff和DLi,eff分別為氧氣和鋰離子的有效擴散系數;i2、F和t+分別為有機電解質電流密度、法拉第常數和鋰離子轉移數;分別表示CO2和CLi在空間各方向上的梯度。
放電過程,正極和負極反應時物質消耗或生成速率為:

從宏觀角度考慮,鋰空氣電池中的液相和固相之間電荷守恒為零,即:

液相中:
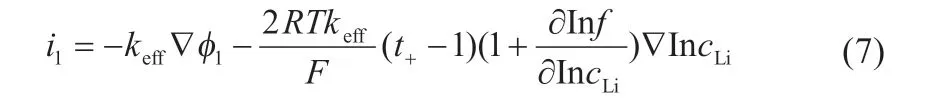
式中:R、T、f分別為氣體常數(8.314 J·mol-1·K-1)、模擬溫度和鋰鹽的活度系數;keff和f1分別為有機電解質有效電導率和電位;?·i1和?·i2分別表示i1和i2在空間各方向上的散度;?φ1和?IncLi粉表示φ1和IncLi在空間各方向上的梯度。
電子在固相中的運動會受到歐姆定律的制約,電位φ2可表示為:

式中:σeff為電子有效電導率;?φ2表示φ2在空間各方向上的梯度。
根據Butler-Volmer方程[2],正極電化學反應表示為:
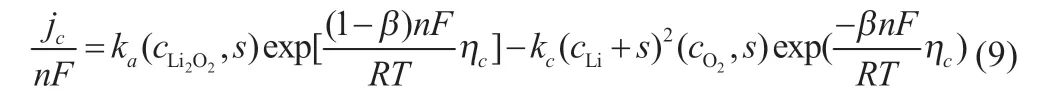
式中:kc、ka為正、負極反應速率常數;β 為反應對稱因子,取值0.5;n為轉移電子數;,s為電極表面生成的過氧化鋰摩爾濃度;jc為有機電解質和電極接觸面局部位置的轉移電流密度。
根據Butler-Volmer方程,負極電化學反應表示為:
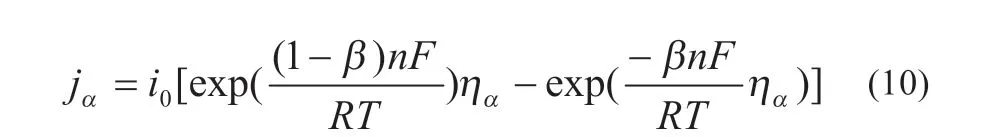
式中:ηα和i0分別為負極活化過電勢和交換電流密度。
正極多孔碳材料的氧溶解反應和電池過氧化物沉淀反應可表示為:
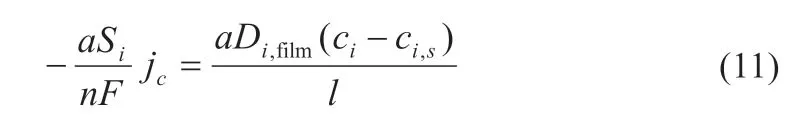
式中:正極電極單位體積內孔的界面面積為a。
由于電池反應過程中正極表面會覆蓋大量的過氧化鋰,因此會改變碳電極微孔容積,變化如下:
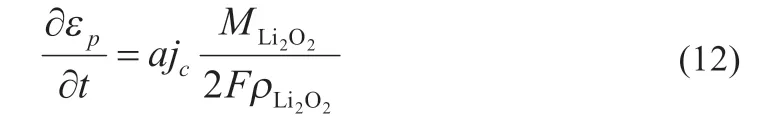
式中:ρ 和M表示過氧化鋰的質量密度和分子量。
固體過氧化鋰體積分數如下:
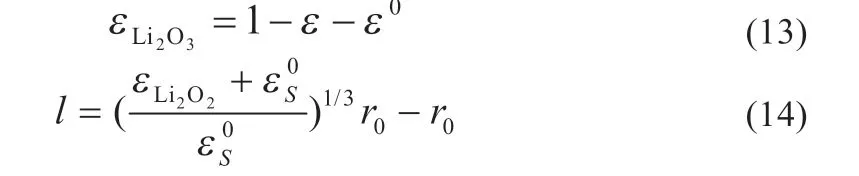
式中:r0和分別為正極中的碳顆粒半徑和初始固相體積分數,初始固相包括粘合劑、催化劑和活性炭物質。反應后正極比表面積變化可表示為:
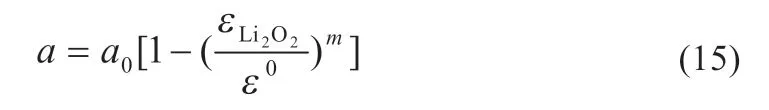
式中:m為沉淀形貌系數,m值越大說明正極沉淀的過氧化鋰越平坦、越均勻,反之沉淀效果越差。
2 數值模擬
2.1 邊界條件及模擬方法
本文研究的鋰空氣電池放電模型為瞬態模型,正極為放電電流密度邊界,負極為0 電勢(接地條件),當邊界電勢降低至1.5 V 時停止模擬。
其他參數設定如下:
過氧化鋰電阻率為50 Ω/m2,氧氣反應平衡電勢為2.98 V,氧氣擴散系數為6.98×10-10m2/s,鋰離子擴散系數為2.09×10-9m2/s。根據前文理論模型,建立鋰空氣電池瞬態、恒溫的二維模型,用COMSOL 有限元軟件分析。利用等差數列將模擬區域劃分成1 524 個網格,并設定電池幾何模型的相對修復容差為1.0×10-4。
2.2 模型驗證
圖2 是同條件下采用本文模型仿真計算和實驗[11]實測的比容量-電壓關系曲線。溫度為300 K,有機電解質濃度為980 mol/m3,電流密度為0.04 mA/cm2。實測值和模擬值吻合良好,最小誤差為1%,最大誤差為4%,平均誤差小于2.2%。
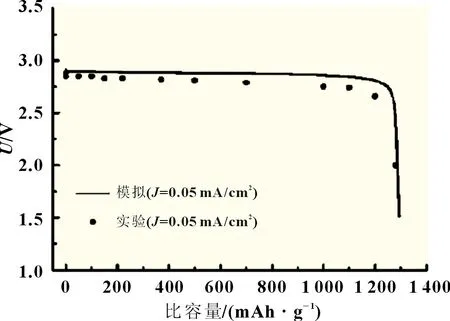
圖2 同條件下模型仿真計算與實測的比容量-電壓曲線
3 結果分析
3.1 過氧化鋰沉淀形貌系數m 對鋰空氣電池放電電壓的影響
圖3 為三個電流密度(0.05、0.25 和0.5 mA/m2)下,過氧化鋰沉淀形貌系數m對鋰空氣電池放電電壓影響關系曲線。由圖看出,當過氧化鋰沉淀形貌系數相同時,電池電壓隨著電流密度的增大而降低。式(15)表明,過氧化鋰沉淀效果較差情況下會減少電極反應比表面積,導致電壓下降;當電流密度相同時,電壓隨著m減小而降低。這是因為m值越小則沉淀過氧化鋰越不均勻,放電反應過程中正極孔隙被迅速堵塞后,反應物質擴散困難,極化增加。
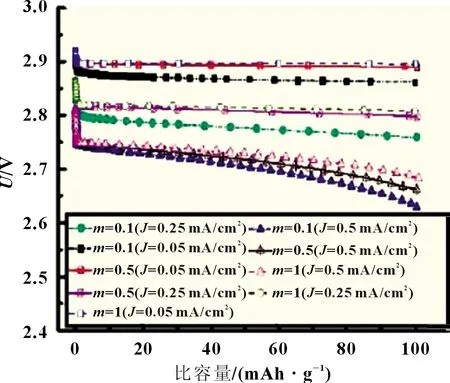
圖3 不同過氧化鋰沉淀形貌系數m對鋰空氣電池放電電壓的影響
電池放電電壓降低的速率隨著過氧化鋰沉淀反應速率增加而加快,故系數m設定時不宜過大也不宜過低,將m設定為0.5。
3.2 鋰空氣電池正極厚度對比容量的影響
放電截止電壓為2.5 V,電流密度為0.05 mA/m2,正極厚度Ln對鋰空氣電池比容量影響見圖4。當比容量較小(≤800 mAh/g)時,電池放電電壓下降較為緩慢。當比容量較大(>800 mAh/g)時,放電電壓迅速下降。反應中正極表面形成大量過氧化鋰,阻斷了氧氣和鋰離子傳質通路,極化迅速增大導致放電電壓迅速降低。
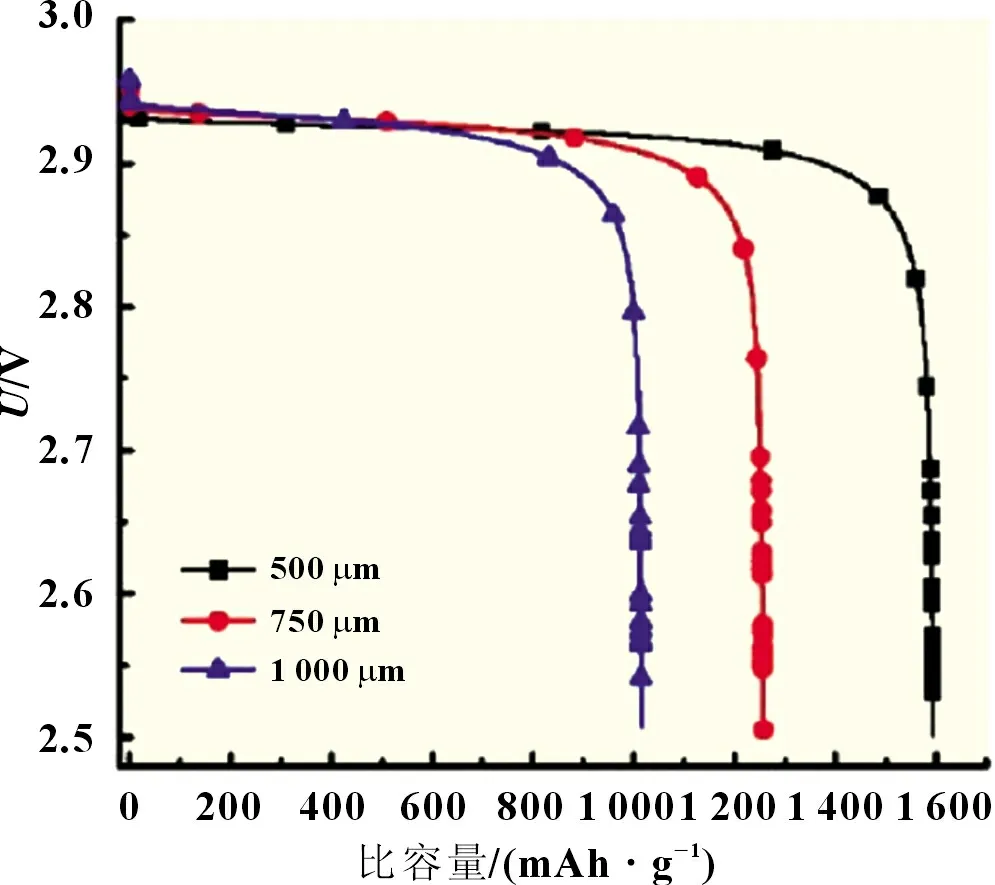
圖4 正極厚度Ln對鋰空氣電池比容量的影響
電池放電電壓為2.5 V 時,比容量隨著正極厚度減小而增加,當Ln為500 μm 時,比容量為1 598 mAh/g。可見正電極越薄,有機電解質中溶解的氧氣擴散速度越快,電極電化學反應速率越大,極化變小,放出的容量較多。較薄正電極機械強度差,容易破裂,很難保證提供適宜的殘余孔率和必須的生成物存儲空間。
3.3 過氧化鋰體積分數
放電過程中,鋰空氣電池多孔碳正極上會生成難以溶解在有機電解液中的過氧化鋰。放電電流密度0.5 mA/cm2、不同放電時間的正電極上過氧化鋰體積分數變化曲線見圖5。由圖看出,無量綱厚度小于0.7 時,過氧化鋰體積分數變化不明顯;隨著無量綱厚度增加,大于0.7 后,過氧化鋰體積分數迅速增大。因為放電電流密度較高時,多孔碳正極上過氧化鋰生成速率加快,過氧化鋰堆積,使體積分數飆升。過氧化鋰導電性差,會增加電極阻抗,還會堵塞電極通道。

圖5 正極電極上過氧化鋰的體積分數變化曲線
放電過程中集流體與正極電極靠近側是過氧化鋰主要堆積的區域,而遠側正極中的過氧化鋰堆積并不明顯,由此看見,正極電極厚度還有下降空間。這也說明,集流體近側的正極多孔介質是鋰空氣電池放電反應的主要區域,多孔介質中鋰離子的傳遞速度要快于氧氣的傳遞速度。
3.4 放電過程中有機電解質電流密度
電池放電電流密度為0.5 mA/cm2,正極、隔膜內有機電解質電流密度變化見圖6。y坐標軸方向上有機電解質分布較為均勻,x坐標軸方向上電解質在0~750 μm 區間較為均勻,在750~800 μm 區間有機電解質的電流密度下降速度較快。因為正極上靠近集流體側部位的放電反應速度較快,生成大量過氧化鋰阻塞了孔隙,降低了氧氣傳輸速度,使得反應變慢。

圖6 正極、隔膜內有機電解質的電流密度變化情況
3.5 放電過程中有機電解質電勢
如圖7 所示,為電池放電電流密度為0.5 mA/cm2情況下,正極、隔膜內有機電解質的電勢變化情況。由此看出,坐標y軸方向上電解質電勢分布較為均勻。坐標軸x方向上的電解質電勢呈逐漸下降趨勢。這是因為,隨著放電反應的進行,沿著電解質擴散方向的反應物質濃度降低,從而電勢會下降。
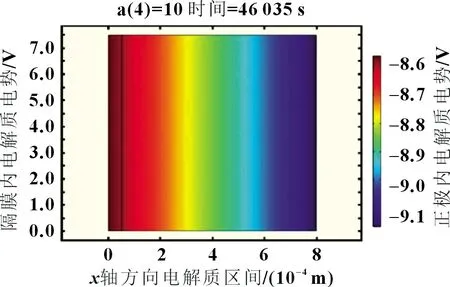
圖7 正極、隔膜內有機電解質的電勢變化情況
4 結論
從宏觀角度采用電化學和傳質學原理,建立了有機電解質鋰空氣電池的放電模型,通過數值模擬分析得出如下結論:
(1)過氧化鋰沉淀形貌系數在放電電流較高的情況下對電池放電特性有一定影響,即電池放電電壓隨著過氧化鋰沉淀形貌系數的降低而降低。
(2)減小鋰空氣電池正極電極厚度會提高電池的放電性能,增加電池放電比容量;但正極厚度過小會降低電極機械強度,同時會降低正極中容納沉積物的溶積,降低電池放出的容量。
(3)鋰空氣電池正極中,相對于氧氣傳遞速度,鋰離子的傳遞速度更快,使得集流體近側成為放電反應的主要聚集區域,該區域放電反應速度加快導致過氧化鋰沉淀物生成較快較多,降低該區域電極孔隙率,導致放電反應速度迅速下降,有機電解質電流密度驟降。

