miR-711在介導結腸癌干細胞生物學行為惡化中的作用
閆軍 周高晉 馬博
結腸癌是消化道常見惡性腫瘤之一,中晚期病人療效不佳,預后差。上皮-間充質轉化(epithelial-mesenchymal transition,EMT)在腫瘤轉移、侵襲及預后中發揮重要的作用,與結腸癌細胞的惡性生物學行為密切相關[1]。腫瘤干細胞(cancer stem cells,CSC)是腫瘤復發、侵襲、轉移及耐藥的根源,已在多種惡性腫瘤中發現CSCs的存在[2]。研究發現,多種miRNAs參與調控結腸癌干細胞的惡性生物學行為[3]。miR-711是最近發現的一種miRNA,在多種惡性腫瘤組織中低表達[4-6]。研究發現,過表達miR-711能抑制SGC-7901胃癌細胞的干性指標SOX2的表達,同時抑制與腫瘤耐藥相關的基質金屬蛋白酶9(MMP-9)的表達[7]。我們從TCGA及Metabolic gEne Rapid Visualizer等數據庫分析顯示,結腸癌組織中miR-711低表達,正常結腸組織中高表達。但是miR-711是否可影響結腸癌干細胞的侵襲、轉移及EMT過程目前尚不清楚。本研究分析miR-711對結腸癌干細胞的侵襲、轉移、增殖及EMT過程的影響。
材料與方法
一、主要試劑、細胞株及儀器
人結腸癌細胞株HT-29、Caco-2、HCT116、LOVO和HCT8(上海生命科學研究所)。miR-711 mimics、miR-NC對照質粒(上海生物工程公司);兔抗人E-cadherin、N-cadherin、Vimentin、β-actin多克隆一抗、鼠抗兔單克隆二抗(Jackson公司,美國);FITC-CD44單克隆抗體、PE-CD133單克隆抗體(Abcam公司,美國);Western Blot試劑盒,RNA提取試劑盒,轉染試劑盒(上海碧云天生物公司);MTT試劑盒(Kapa Biosystems,美國);二甲亞砜(dimethyl sulfoxide,DMSO)、Transwell小室、PCR試劑盒(Sigma公司,美國);酶標儀(上海儀電分析儀器有限公司);ABI 7900PCR擴增儀(上海儀電分析儀器有限公司);FACS流式細胞儀(BD Biosciences,美國)。
二、方法
1.細胞培養:含10% FBS和青、鏈霉素各100 U/L的RPMI1640培養基,常規培養于37 ℃,5% CO2培養箱。待細胞鋪滿培養瓶后,用0.25%胰酶消化,制備單細胞懸液,使用無血清培養基繼續培養,定期更換培養基、傳代。光學顯微鏡下觀察細胞球情況。
2.流式細胞儀分選腫瘤干細胞:選取第3代細胞,0.25%胰酶消化,調整濃度為1×106/L的單細胞懸液,接種于6孔板中,每組設置5個復孔,加入FITC-CD44和PE-CD133單克隆抗體,4 ℃避光孵育30分鐘,流式細胞儀檢測CD44+/CD133+細胞百分比。
3.細胞轉染:使用Lipofeetamine 2000試劑對分選的腫瘤干細胞進行轉染,分為:空載組(轉染miR-NC),miR-711過表達組(轉染miR-711-mimics)及空白組(未轉染腫瘤干細胞)。各組細胞繼續培養,用于后續實驗。
4.各組細胞miR-711 mRNA表達的檢測采用實時熒光定量PCR(Quantitative Real-time PCR)。取對數生長期的細胞,胰酶消化,離心。利用Trizol試劑提取細胞總RNA,測定RNA濃度,將合格的總RNA轉錄成cDNA,然后進行PCR擴增。上海生物公司根據Gene Bank序列合成目標引物序列(表1),根據反應要求配置反應體系,包括SYBR? Premix Ex TaqTM(2×)12.5 μl+上下游引物10 μm各1 μl,加反應水至總體積為25 μl。反應參數設置為92 ℃ 20秒、96 ℃ 2秒、85 ℃ 20秒、80 ℃ 6秒,共40個循環,75 ℃讀取熒光,構建溶解曲線。2-△△Ct法計算目標引物mRNA的相對表達量。

表1 目標引物序列和大小
5.細胞增殖能力檢測采用MTT法。將各組細胞接種于96孔板中,細胞濃度調整為5×103個/孔,培養24小時,分別于培養后12小時、24小時、48小時和72小時,每孔加入20 μl MTT溶液,繼續培養4小時后酶標儀測量OD值。抑制率=(對照組OD-實驗組OD)/對照組OD×100%。
6.Transwell小室實驗檢測細胞遷移、侵襲能力:采用無Matrigel基質膠和有Matrigel基質膠的Transwell小室分別進行細胞遷移和侵襲實驗。遷移實驗:上室每孔加入200 μl無血清細胞懸浮液,密度為6×104個/孔,下室加入600 μl含20%血清培養液,培養48小時,4%多聚甲醛固定10分鐘,0.5 %結晶紫染色10分鐘。洗滌,光學顯微鏡下選取5個視野計算細胞數量。侵襲實驗:使用4 ℃的無血清DMEM1∶6稀釋基質膠,每個transwell小室中加40 μl Matrigel基質膠,37 ℃放置30 min。取出小室吸取多余的液體,其余步驟同遷移實驗。
7.Western Blot檢測E-cadherin、N-cadherin、Vimentin蛋白量表達:去除培養基,PBS洗滌,加入裂解液,冰浴30分鐘,40 ℃ 1 500 r/min離心5分鐘,吸去上層液體,超聲波破核,再次離心,取上層液體10 μl待測。配膠,上樣,電泳,轉膜,切膜,封閉液封閉1小時,逐次兔抗人E-cadherin(1∶150)、N-cadherin(1∶100)、Vimentin(1∶100)、β-actin(1∶100)多克隆一抗、鼠抗兔單克隆二抗(1∶100)。曝光成像,Image Lab Software測定光密度。結果以目標蛋白光密度值/β-actin光密度值表示。
三、統計學方法
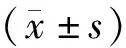
結果
1.流式細胞術檢測人結腸癌細胞株中CD44+/CD133+表達見圖1、2。結腸癌細胞株HT-29、Caco-2、HCT116、LOVO和HCT8細胞表面CD44+/CD133+百分比分別為29.00%,0.410%,24.100%,0.135%,0.970%,細胞株HT-29細胞CD44+/CD133+百分比最高,因此我們選取HT-29細胞株用于隨后的實驗研究。

圖1 流式細胞儀分析結腸癌細胞株HT-29、Caco-2、HCT116、LOVO和HCT8細胞表面CD44+/CD133+百分比

圖2 結腸癌細胞株HT-29、Caco-2、HCT116、LOVO和HCT8細胞表面CD44+/CD133+百分比
2.各組miR-711mRNA表達見圖3。miR-711過表達組細胞miR-711mRNA水平高于空載組、空白組(P<0.05)。

與過表達組比較,aP<0.05
3.miR-711過表達對細胞增殖能力的影響見表2。兩組0小時細胞抑制率比較無差異,過表達組培養12小時、24小時、48小時和72小時的細胞抑制率明顯高于空白組,空載組(P<0.05)。

表2 各組細胞抑制率比較
4.miR-711過表達對細胞侵襲、遷移能力的影響見圖4。miR-711過表達組細胞侵襲能力低于空載組、空白組(t=8.215,9.042,P均<0.001)。miR-711過表達組細胞遷移能力低于空載組、空白組(t=6.483,7.941,P均<0.001)。

與過表達組比較,aP<0.05
5.miR-711過表達對E-cadherin、N-cadherin、Vimentin蛋白表達的影響見圖5。miR-711過表達組E-cadherin蛋白水平(0.45±0.05)高于空載組(0.35±0.03)、空白組(0.33±0.06),N-cadherin、Vimentin蛋白水平[(0.24±0.03)、(0.27±0.03)]低于空載組[(0.40±0.08)、(0.44±0.07)]、空白組[(0.38±0.05)、(0.41±0.10)],差異均有統計學意義(P均<0.05)。
討論
近年來,已從多種惡性腫瘤組織及細胞株中分離出CSCs,并證實了其生物學性能。研究顯示,結腸癌中同樣存在腫瘤干細胞[8-10]。本研究利用流式細胞術從人結腸癌細胞株中分離出高比例的CD44+/CD133+陽性的CSCs,為下一步研究奠定了基礎。
研究顯示,miRNAs與腫瘤干細胞的增殖、侵襲、轉移及多向分化密切相關[11]。miRNAs對結腸癌干細胞的作用亦有文獻報道[12]。miR-711作為一種抑癌基因,與多種腫瘤細胞的惡性行為有關,但其對結腸癌干細胞侵襲、轉移的影響尚不清楚[13-14]。本研究探討了miR-711對結腸癌干細胞侵襲、轉移的影響,結果顯示,過表達miR-711組細胞的侵襲、轉移能力低于其他兩組,提示miR-711可抑制結腸癌干細胞侵襲、轉移能力。miR-711發揮抑制功能可能與其抑制癌細胞攝取葡萄糖,血管生成及調控細胞周期蛋白有關。
EMT是上皮細胞向間質細胞轉化的現象,EMT的活化對CSCs的干性、傳代以及腫瘤細胞干性獲得具有重要的影響。研究發現,無血清培養基培養出具有CSCs特征的結腸癌細胞球的轉移特性與EMT有密切關系[15]。此外也有報道稱EMT與CSCs在干細胞巢中可以出現轉化[16]。上述研究結果提示CSCs和EMT存在相互作用,兩者共同參與腫瘤的轉移、侵襲和治療抵抗過程。腫瘤細胞EMT過程中,細胞形態學發生改變,極性消失,細胞黏附力下降,從而導致細胞侵襲、遷移能力增強。EMT過程中同時表現為一些分子標記物的改變,如上皮表型標志物E-cadherin下調,而間質表型標志物N-cadherin、Vimentin上調。任莉等[17]研究發現,過表達miR-489可抑制結腸癌干細胞EMT過程。本研究結果顯示,過表達miR-711組細胞E-cadherin蛋白表達水平高于空白組及空載組,N-cadherin、Vimentin蛋白表達水平低于空白組及空載組。提示miR-711過表達可抑制結腸癌CSCs的EMT過程。
在腫瘤微環境中,EMT受到大量復雜的信號通路及相關影響因子的調控,如:TGF-β、Wnt、Hedgehog、Notch 信號通路及ZEB1、ZEB2、Twist、Snail、Slug活化因子,這些轉錄因子激活后可活化CSCs中的EMT[18-20]。miRNA主要通過靶向一些細胞因子、細胞周期蛋白調控腫瘤細胞的生物學行為。本研究結果顯示,miR-711誘導了腫瘤細胞的EMT過程,但具體機制有待進一步深入的研究。
綜上所述,miR-711的上調可抑制結腸癌CSCs的侵襲、遷移及EMT過程。本研究只是初步實驗,有待進一步補充實驗明確下游靶向基因,具體機制也尚需探討。

