一站式經皮二尖瓣球囊成形術聯合射頻消融治療風濕性二尖瓣狹窄合并持續性心房顫動的臨床效果
白雪洋,白中樂,劉剛瓊,王 琎,洪 晉,辜和平,李 凌,董建增
1)鄭州大學第一附屬醫院心內科 鄭州 450052 2)首都醫科大學附屬北京安貞醫院心內科 北京 100029
風濕性二尖瓣狹窄是一種可致殘甚至致命的疾病,也是我國最常見的心臟瓣膜疾病之一[1]。臨床上,風濕性二尖瓣狹窄常合并心房顫動(房顫),兩者相互影響,相互加重,導致患者病情迅速進展。目前臨床普遍開展的經皮二尖瓣球囊成形術已成為國內外指南推薦的治療風濕性二尖瓣狹窄的首選手術方法,但此類患者所合并的房顫往往被忽略。而另一方面,隨著臨床證據的積累,射頻消融術治療房顫的安全性和有效性已被充分證實。本研究對中重度二尖瓣狹窄合并房顫患者同期行經皮二尖瓣球囊成形術和射頻消融術,且在同一次手術中完成,觀察其安全性及有效性,報道如下。
1 對象與方法
1.1研究對象選擇2018年1月至2020年4月在鄭州大學第一附屬醫院心內科診斷為風濕性二尖瓣中重度狹窄合并持續性房顫的患者39例。其中20例行單純二尖瓣球囊成形術(A組)。另外19例行一站式經皮二尖瓣球囊成形術聯合房顫射頻消融(B組)。所有患者完善血常規、肝腎功能、血脂、NT-proBNP、甲狀腺功能、心電圖及心臟彩超等檢查,完成6 min步行試驗。患者均行左心房CT重建及經食管超聲判定有無左心房血栓。二尖瓣狹窄由超聲檢查確診,二尖瓣瓣口面積估算采用PHT法。根據二尖瓣瓣口面積進行二尖瓣狹窄分度[2],大于1.5 cm2且小于2.0 cm2為輕度狹窄,1.0~1.5 cm2為中度狹窄,小于1.0 cm2為重度狹窄。房顫依據24 h動態心電圖確診。排除標準:①中度以上二尖瓣反流。②中度以上主動脈瓣關閉不全或主動脈瓣狹窄。③有風濕活動。④二尖瓣存在明顯鈣化。⑤瓣膜下結構明顯異常。⑥左心房內血栓或近期有栓塞史。⑦左房內徑大于55 mm。本研究符合2013 年修訂的《赫爾辛基宣言》對倫理學的要求并經患者知情同意。
1.2治療
1.2.1 經皮二尖瓣球囊成形術 穿刺右側股靜脈,置入8F股靜脈鞘管,交換為8.5F Swartz鞘管,行房間隔穿刺,成功后應用Inoue球囊進行二尖瓣擴張。停止擴張的標準[3]:①交界處完全分離。②瓣口面積指數大于1 cm2/m2。③出現明顯的二尖瓣反流,或反流增加25%。
1.2.2 術中心臟彩超 B組由同一心臟超聲醫師行超聲檢查,經皮二尖瓣球囊成形術后即刻二尖瓣瓣口面積大于1.5 cm2,且無明顯心包積液及中度以上二尖瓣反流者,進一步行房顫射頻消融術。
1.2.3 房顫射頻消融術 采用雙側股靜脈入路,冠狀靜脈竇內置入可調彎10極電極導管,沿此前的8.5FSwartz鞘管送入冷鹽水灌注的壓力消融導管(STSF,美國強生公司),在Carto電解剖標測系統(美國強生公司)指導下,進行心房快速解剖建模,設置呼吸門控,解剖分辨率為18。術中均采用環肺靜脈消融+輔助線消融的消融策略(2C3L)。
1.3術后觀察及隨訪所有患者術后1 d復查超聲心動圖。觀察術后有無延遲心臟積液、血腫等并發癥。所有患者術后服用華法林抗凝,并維持INR 2~3。術后1、3、6個月由固定的專科醫師進行門診隨訪,內容包括復查心臟彩超、NT-proBNP、6 min步行試驗。B組術后口服胺碘酮至少3個月,如無房顫復發(包括房顫、房撲或房性心動過速在內的癥狀性房性快速心律失常發作)可停用。并復查12導聯心電圖和24 h動態心電圖。消融后復發定義為消融后3~12個月出現癥狀性房性快速心律失常發作時間>30 s,或24 h動態心電圖記錄到無癥狀性房性快速心律失常發作時間> 5 min。
1.4統計學處理所有數據采用SPSS 22.0處理。兩組性別和年齡的比較分別采用χ2檢驗和兩獨立樣本t檢驗,術前、術后6個月臨床各指標差值的比較采用t檢驗,檢驗水準α=0.05。
2 結果
2.1B組術后觀察與隨訪情況B組19例患者均成功行經皮二尖瓣球囊成形術,術后即刻超聲顯示瓣口面積均大于1.5 cm2,且無明顯心包積液及中度以上二尖瓣反流。所有患者均即刻成功行房顫射頻消融術,均按照環肺靜脈消融+輔助線消融的消融策略(2C3L),并達到消融標準。術后2例患者出現少量心包積液,給予觀察后自行吸收。隨訪過程中有1例患者于術后1個月復查時再次出現房顫,心臟彩超提示二尖瓣瓣口面積減少至1.0 cm2,并再發心衰,至心外科行二尖瓣置換術。其余18例患者均按要求完成至少6個月隨訪。其中2例于3個月復發房顫,經靜脈泵入胺碘酮針后轉復竇性心律,口服胺碘酮延長至6個月,房顫未再次復發。
2.2兩組術前和術后6個月臨床指標比較完成隨訪的18例B組患者中男4例,女14例,年齡(54.8±8.6)歲;20例A組患者中男4例,女16例,年齡(50.7±9.9)歲,兩組性別、年齡均衡可比。B組完成隨訪的18例患者術后6個月時左房內徑、二尖瓣瓣口面積、NT-proBNP、6 min步行試驗改善均明顯優于A組,見表1。
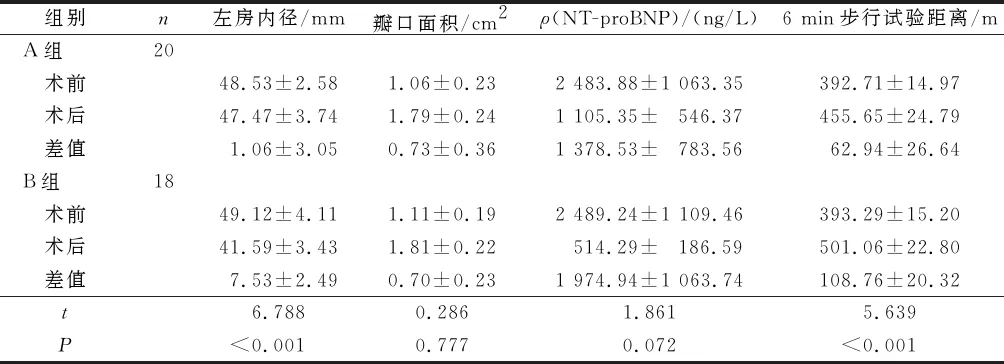
表1 兩組術前和術后6個月臨床指標比較
3 討論
研究[4]顯示2014年我國風濕性心臟病患者達240萬。風濕性心臟病主要影響心臟瓣膜,瓣膜可存在炎癥粘連、鈣質沉著及纖維化,累及心臟各瓣膜的概率不同[5-7]。其中二尖瓣狹窄是最常見的類型,女性患者居多,由于其高致殘率及致死率,嚴重影響患者生活質量。
藥物可暫時緩解風濕性二尖瓣狹窄癥狀,但對解除狹窄瓣膜對血流的阻礙無任何作用。而經皮二尖瓣球囊成形術由于創傷小、安全性高并且遠期及近期效果較好,逐漸成為國內外指南推薦治療風濕性二尖瓣狹窄的首選方法[8-9]。
但是,臨床中發現部分同時合并房顫的風濕性二尖瓣狹窄患者行經皮二尖瓣球囊成形術后并未達到預期效果[10]。風濕性二尖瓣狹窄患者極易合并房顫,而房顫明顯加重患者病情。首先,房顫增加缺血性腦卒中及體循環動脈栓塞的風險,其缺血性腦卒中的風險是非房顫患者的4~5倍,且導致近20%致死率及近60%致殘率。無論是否抗凝治療,亞裔房顫患者均較非亞裔患者更易于發生缺血性腦卒中,同時出血性腦卒中發生風險亦較高[11]。另外,房顫使心力衰竭的發生風險增加3倍且加重心力衰竭癥狀。鑒于近年來導管消融治療在維持竇性心律和改善生活質量等方面優于抗心律失常藥物治療的一致研究結果,導管消融逐漸成為房顫臨床治療的主要方法。而對于二尖瓣狹窄合并房顫的患者,由于擔心復發率較高,多數房顫治療中心往往只采用單純經皮二尖瓣球囊成形術改善二尖瓣瓣口面積,而對于房顫則采用消極的藥物保守治療。這使很多患者失去了轉復竇性心律的機會,同時藥物保守治療的現狀也顯著增加了該病的不良結局。藥物治療中抗凝尤為重要,但結合我國現實情況,患者抗凝藥物服用率及抗凝藥物達標率極低,房顫的存在導致血栓栓塞風險明顯升高,進而致殘率和致死率也居高不下,嚴重影響患者生活質量,明顯加重社會負擔。我院房顫治療中心近年逐漸開展二尖瓣狹窄合并房顫的導管消融治療,取得了積極效果,但導管消融與經皮二尖瓣球囊成形術多分開進行,患者需進行2次手術,進行至少2次房間隔穿刺,手術風險及治療費用均增加。
經皮二尖瓣球囊成形術和房顫導管消融術手術路徑一致,均需穿刺房間隔,若在同一臺手術按順序完成,則明顯提高治療效率。同時心外科相關研究也給予了啟發。有研究[12]發現對于伴有房顫的心臟病患者進行心臟手術聯合房顫射頻消融術將降低遠期的血栓栓塞事件發生率,有利于改善心臟功能,增加遠期的生存率。我院也進行了射頻消融術聯合二尖瓣置換術治療二尖瓣狹窄合并心房顫動的研究[13],并顯示出較好效果。本研究探索了一站式行經皮二尖瓣球囊成形術及房顫射頻消融的手術方式對患者的安全性及有效性,結果顯示所有患者均順利完成了經皮二尖瓣球囊成形術和房顫射頻消融術,既縮短了治療時間也節省了治療費用;隨訪6個月,18例B組患者的左房內徑明顯縮小,NT-proBNP明顯下降,6 min步行距離明顯延長。B組術后6個月相關臨床指標的改善明顯優于A組。
本研究創新點在于同一臺手術序貫完成兩種操作,此種手術方式目前國內外鮮有報道,分析原因:首先,多數醫院經皮二尖瓣球囊成形術者非電生理醫師,如同臺進行兩種操作需要兩個團隊協作;其次,經皮二尖瓣球囊成形術后需要彩超評估手術效果及并發癥,只有手術效果好且無明顯并發癥者可進行房顫射頻消融治療;最后,國外行房顫射頻消融術主要在全麻下進行,而經皮二尖瓣球囊成形術為局麻手術,不同的麻醉方式導致同臺進行困難,而國內房顫射頻消融基本均為局部麻醉。我院心臟中心同時具備經皮二尖瓣球囊成形術團隊、電生理團隊及心臟超聲團隊,且有人員交叉,團隊協作、術中即刻超聲評估經皮二尖瓣球囊成形術后效果及并發癥為此類手術的開展提供了獨特優勢。
但B組中1例患者術后1個月出現瓣口面積恢復并復發房顫,考慮與風濕活動持續及局部炎癥反應相關,提示此類患者術后應積極預防風濕活動,同時密切隨訪,必要時及時外科手術避免延誤病情。另外有2例患者房顫早期復發,但復發率并未明顯高于非瓣膜病房顫患者,且應用藥物后恢復竇性心律,提示導管消融對合并二尖瓣狹窄的房顫患者維持竇性心律同樣有效。
本研究提示一站式經皮二尖瓣球囊成形術聯合射頻消融治療二尖瓣狹窄合并持續性房顫臨床安全、有效,但其中經皮二尖瓣球囊成形術后是否直接行房顫導管消融應有嚴格限制,只有二尖瓣瓣口面積擴張滿意且無明顯并發癥者才能明顯獲益,因此術中彩超必不可少。另外,此類患者的遠期效果還需更長時間隨訪及更多中心大樣本研究來證實。

