新形勢下中國豬場的非洲豬瘟防控
陳維 譚濤

摘? 要:自2018年我國首次確診非洲豬瘟疫情以來,各規模化豬場紛紛進行了非洲豬瘟防控的探索,根據非洲豬瘟病毒通過接觸傳播且傳播速度慢的流行特點,有關豬場發明了精準清除策略,推廣后得到了業內人員的廣泛認可。然而隨著非洲豬瘟病毒弱毒株和基因缺失株(又稱為“疫苗株”)的出現,這一方法已經不如之前那樣有效。本文通過對非洲豬瘟病毒的病原學、流行病學、實驗室診斷以及精準清除策略的回顧,分析了當前豬場存在非洲豬瘟病毒強毒株、弱毒株和基因缺失株并存和干擾等現狀,總結了非洲豬瘟診斷與防控策略。根據目前的情況,生物安全依然是預防非洲豬瘟最根本的方法,精準清除需要更加嚴格的采樣和檢測,對感染非洲豬瘟病毒弱毒株和疫苗株的豬群進行更專業的精準清除,同時需要加強對各種應激因素的控制,提高豬的抵抗力,減少非洲豬瘟病毒弱毒株潛伏感染豬的排毒量。希望本文能為我國防控和根除非洲豬瘟提供有益的參考。
關鍵詞:非洲豬瘟;弱毒株;基因缺失株;精準清除;應激;綜合防控
中圖分類號:S851.33 文獻標志碼:A 文章編號:1001-0769(2021)02-0106-10
1? 非洲豬瘟病毒介紹
1.1病毒和基因組
非洲豬瘟(African Swine Fever,ASF)是由非洲豬瘟病毒(African Swine Fever Virus,ASFV)感染豬后引起的一種急性、熱性、高度傳染性和高致死性烈性傳染病[1],迄今為止尚無有效疫苗和藥物可以預防與控制。目前已知的ASFV有8個血清群[2]和24種基因型[3],我國主要流行的是基因Ⅱ型[4]。ASFV的基因組大小約170 kb~190 kb,能夠編碼200多種蛋白質,其中包括50多種結構蛋白。電鏡下ASFV粒子呈正二十面體,直徑約為200 nm,主要由囊膜、衣殼、內膜、內核心殼和基因組五部分組成[5]。
1.2 感染機理
ASFV主要通過直接接觸途徑侵入豬的呼吸道或消化道,病毒侵入豬體后在鼻咽部或扁桃體等部位進行增殖,隨后大量增殖的病毒隨著血液和淋巴感染全身組織和器官,引起組織器官出血、血栓、漿液性滲出,甚至急性壞死。有研究表明,單核-巨噬細胞表面的CD163分子與ASFV的感染相關[6],ASFV感染機體主要通過內吞作用實現,ASFV進入豬的機體后立即侵染機體的單核-巨噬細胞,在胞飲泡或內吞體內完成內體成熟過程,隨之啟動病毒的增殖。病毒粒子脫去病毒囊膜后,暴露的病毒內膜與體內膜融合,釋放出病毒基因組,基因組在細胞質中完成復制、轉錄和翻譯等一系列過程,最后,基因組和蛋白質組裝完成后通過動力蛋白的運輸作用,將組裝完整的病毒粒子釋放到細胞外[7],進行下一次感染。
1.3 理化特性
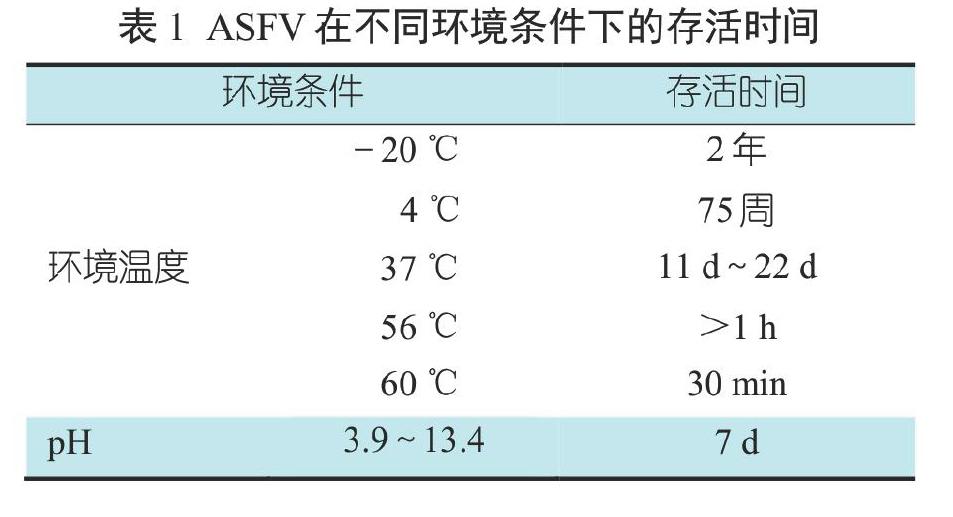
ASFV是囊膜病毒,不耐熱、不耐強酸和強堿,可耐受的pH范圍為3.9~11.5。在不同環境中,ASFV存活時間不同(表1)。ASFV在低溫下穩定,對高溫敏感,56 ℃ 70 min或60 ℃ 20 min可滅活。該病毒在血清中較穩定,在含25%血清溫度為37 ℃的溶液中半衰期為24 h,在血清中耐酸堿性也增強,如在pH 13.4下仍可存活;在血液中,ASFV在低溫條件下可存活6年,在室溫下可存活數周。ASFV在豬的糞便和尿液中存活時間較短,在空氣中的存活時間為25 d~30 d(表2),在豬肉制品中可長時間存活(表4),在豬的冷凍組織器官中可存活 6~12個月[8](表3)。
ASFV對常規消毒劑敏感,常見的消毒劑如果正確使用,均能有效殺滅該病毒(表5)。
2? 非洲豬瘟的流行情況
2.1 非洲豬瘟的流行歷史
ASF疫情最早在1921年被肯尼亞報道,隨后長時間在撒哈拉以南地區的豬群中流行;該病于1957年首次傳入葡萄牙等歐洲國家,隨后在法國、荷蘭、比利時、意大利等國家的豬群中蔓延;1971年相繼感染古巴、多米尼加、海地和巴西等南美洲國家的豬群。隨著國際貿易越來越頻繁,ASFV在2007年傳入格魯吉亞、亞美尼亞和阿塞拜疆,在2009年遠距離傳播到俄羅斯,2012年傳入烏克蘭,2013年傳入白俄羅斯,2014年傳入立陶宛、波蘭、拉脫維亞、愛沙尼亞等歐盟國家,2016年傳入摩爾多瓦,2017年傳入捷克、羅馬尼亞。2018年8月,我國首次報道了ASF疫情[9]。2019年,老撾、越南、柬埔寨、朝鮮、蒙古國、緬甸、韓國、菲律賓、印度尼西亞等很多國家的豬群先后暴發了ASF疫情。截至2019年底,世界動物衛生組織公告了全球有25個國家和地區的豬暴發了ASF疫情[10],給這些地區的養豬業造成了巨大損失。
2.2 非洲豬瘟在我國流行情況
目前,在我國流行的ASFV屬于ASFV基因Ⅱ型,與俄羅斯克拉斯諾達爾的ASFV 2012毒株和伊爾庫茲克的ASFV 2017毒株同源性為100%[10-11]。 ASFV傳入我國后迅速在豬群中傳播,在之后一年多的時間內席卷全國,疫情的快速流行導致我國的存欄母豬數大幅度降低,養豬業遭受了巨大的損失。
據權威媒體和業內人員統計,2020年底至2021年初,ASF疫情再次暴發,導致我國東北、華北等地區集團化和規模化豬場的豬群損失達20%~30%;在華東地區,山東省的膠東半島和魯南地區豬群受損高達50%,江蘇省多個地區的養豬企業母豬減少60%~70%,其中不乏集團化豬場的育肥場受重創而清場;河南省和湖北省受損較大,母豬損失約30%~50%,而且普遍反映精準清除措施防控效果不理想。除了ASFV的強毒株以外,弱毒株的感染和發病也造成了重大的影響。
2.3 傳染源和傳播途徑
豬是ASFV的天然宿主,家豬和野豬均易感,軟蜱是ASFV的貯存宿主。感染豬和感染豬的肉制品均為傳染源,人員、車輛、物資被感染豬污染后,在短時間內也會成為傳染源。ASFV以直接接觸為主要傳播途徑,也可以通過氣溶膠發生短距離的傳播[12]。根據我國養豬業和飼養環境的特殊性,ASFV在我國的傳播方式主要有五種:一是活豬的跨區域調運,二是散養戶的泔水喂豬,三是人員、車輛和物資帶毒后的交叉傳播,四是引種或外購仔豬的傳播,五是飼養密集的地區或熱帶地區,蚊蠅、老鼠或飛鳥等攜帶非洲豬瘟病毒后的機械傳播[13]。
3? 非洲豬瘟的診斷
3.1 臨床診斷
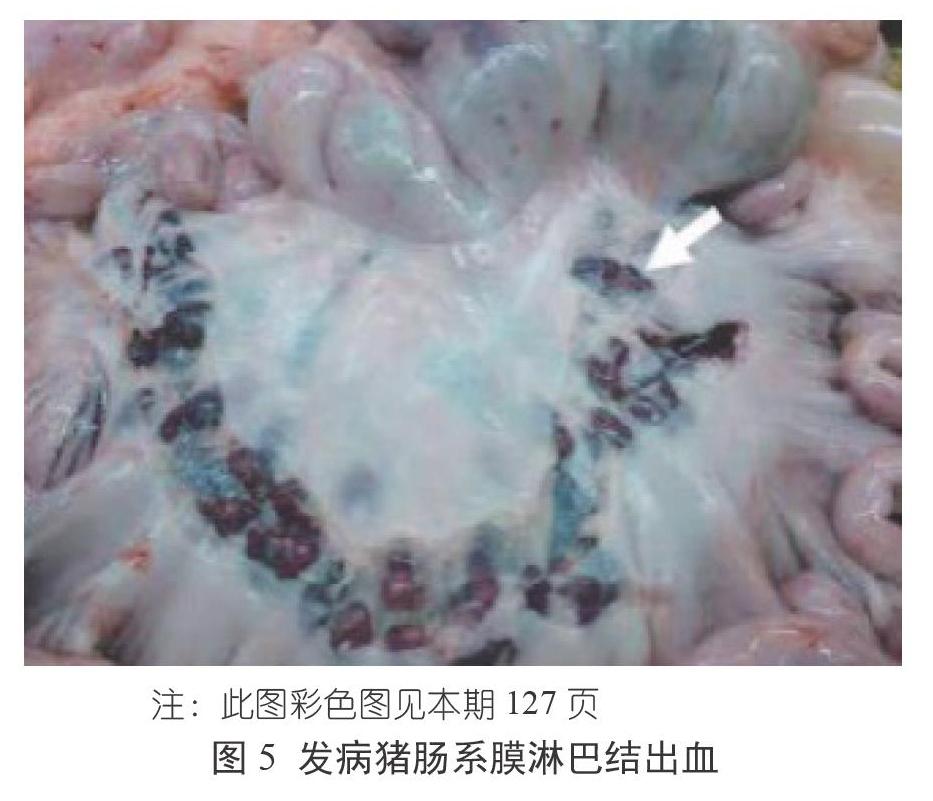
ASF的臨床表現可分為最急性型、急性型、亞急性型、慢性型和亞臨床型五種。2021年以前,我國流行的ASF主要表現為最急性型和急性型,臨床表現為:豬突然死亡,病豬出現高熱、扎堆、厭食和呼吸急促,耳、四肢和腹部皮膚發紺等癥狀,死亡率達100%(圖1~圖3)。? ? ? ? ?臨床解剖可見腸系膜淋巴結出血、十二指腸出血、脾臟高度腫大、肺炎、腎臟嚴重出血等癥狀(圖4~圖7)。2021年以來,我國多個集團化豬場相繼出現感染豬發病率高但死亡率低、多數豬場精準清除失敗等現象。我國軍事科學院獸醫研究所分離到一株ASFV的自然變異弱毒株,該毒株感染豬后引發的臨床癥狀不典型、致死率低,因此在臨床上容易與其他疾病混淆,這會大大增加臨床診斷和精準清除的難度。目前來看,ASFV弱毒株感染后豬會出現皮膚潰爛、關節炎和嚴重的呼吸道感染等問題。
3.2 實驗室診斷
隨著在我國豬群中流行的ASFV出現自然弱毒株和疫苗毒株,抗原檢測和血清學檢測同時進行,這對我國當前精準清除ASFV非常重要。目前,國際上常用的ASFV實驗室檢測方法主要有病原學檢測和血清學檢測,病原學檢測方法包括病毒分離紅細胞吸附(Virus Isolation-Hemadsorption,VI-HAD)、酶免疫組化(Immuno-Enzyme Histonchemistry,IEH)、聚合酶鏈式反應(PCR)、直接免疫熒光 (Direct Immunofluorescence,DIF)、熒光定量PCR(qPCR)等,其中qPCR技術是目前實驗室應用最廣泛的檢測技術。血清學檢測方法主要包括ELISA(間接和阻斷ELISA)、免疫印跡試驗(IB)和膠體金試紙條等。
VI-HAD、DIF等方法適用于ASFV急性病例的快速診斷[15];qPCR技術敏感性和特異性高,可一次性快速檢測多種樣品,操作簡單,檢測量大,是目前實驗室檢測采用的主要方法;環介導等溫擴增法(Loop isothermal AMPlification,LAMP)可在等溫(60 ℃~65 ℃)條件下高效、特異、快速擴增目的基因,適用于ASFV的現場診斷。
2019年,中國動物疫病預防控制中心多次篩選并推薦了目前市場上銷售的28種熒光定量PCR試劑盒和6種等溫擴增類試劑盒,為廣大豬場實驗室進行ASFV的快速診斷提供了可靠的方法和試劑盒[16-17]。
ASFV弱毒株出現后,實驗室檢測手段也必須隨之改進。首先,弱毒株的排毒是間歇性的,因此要增加采樣的頻率。感染ASFV弱毒株的豬在應激后容易出現臨床癥狀,因此可以在豬場普免常規疫苗后觀察,對出現采食量下降、臥地不起和精神沉郁等異樣的豬重點排查,可以采用同時收集口鼻拭子、血液和肛拭子的方法,有條件的豬場可以考慮扁桃體刮片采樣。最近,有專家提出了腹股溝淋巴結穿刺采樣的方法,能更準確地檢出帶毒豬。
對于ASFV弱毒株還有一個好辦法進行排查,即檢測抗體。由于ASFV弱毒株的間歇性排毒,抗原檢測法很可能檢測不到帶毒豬,但是我們可以通過采血進行ELISA方法檢測ASFV抗體。目前的難點是如何找到良好的抗體檢測試劑盒。采用抗原加抗體同時檢測將是篩查ASFV弱毒株最好的方法。
4? 非洲豬瘟的精準清除
4.1 非洲豬瘟精準清除的理論基礎
ASFV的精準清除技術俗稱“拔牙”,是中國養豬業和獸醫界對ASF等重大動物疫病防控在理論與實踐上的創新,實質上這是特定豬場內ASFV的凈化手段,該方法是通過及時清除陽性豬、防止病毒擴散從而達到凈化ASF和保住豬群的目的。
ASFV的感染靜默期比潛伏期長1 d~3 d,被感染的豬剛開始表現臨床癥狀還未向外界排毒,因此我們可以利用這一空當及時清除被感染的豬,防止病毒擴散。ASFV的潛伏期通常為5 d~19 d,該病毒有兩個檢測窗口期,分別是感染第3天左右(鼻、口腔中可檢測出病毒)和感染第5天左右(在血液中可檢測到病毒),這兩個窗口期決定了ASFV檢測是處于鉆石期、黃金期還是黃銅期、爛鐵期(表6)。
隨著2021年ASFV自然弱毒株的出現以及疫苗毒株的干擾,對原有的精準清除和實驗室診斷提出了更高的要求。2021年3月,針對目前豬場流行的ASFV弱毒株(低致病性毒株)的情況,華南農業大學張桂紅教授提出如下清除建議:
第一,若豬場確診為ASFV低致病性毒株(弱毒株或疫苗毒株),立即按棟或區域采集40頭豬的血液樣本評估本場的感染率;
第二,進行抗原和抗體的檢測,若陽性率小于10%,按照原有的精準清除方案進行“拔牙”;
第三,進行抗原和抗體的檢測,若陽性率大于20%,按照生產線或整棟清空,分區洗消烘,同時加大陽性豬群的淘汰力度,盡早實現全場凈化。
4.2 精準清除的關鍵步驟
4.2.1 及時發現
及時發現異常豬對精準清除策略的實施至關重要,特別是被ASFV低致病性毒株感染后,豬表現出的亞臨床感染不容易被覺察。一般情況下,被ASFV感染后,母豬和育肥豬先發病,常見癥狀有采食量下降、不食、發燒、精神沉郁、嘔吐、喜臥、不明原因突然死亡、母豬流產等,因此,飼養人員或巡場人員發現異常問題要及時上報。
4.2.2 生產靜默
生產靜默的目的是禁止飼養人員和豬流動,防止ASFV在場內二次傳播,最大限度地減少病毒在場內的擴散。除了喂料等必要工作外,在生產靜默期停止其他所有工作。
4.2.3 采樣檢測與陽性豬的淘汰
樣品采集可以采集唾液拭子、鼻腔拭子、肛門拭子和尾尖血拭子等。血液中的病毒含量最高,唾液拭子的病毒含量低于血液的,但病毒在唾液中的出現時間早于在血液中的,而且排毒量高于肛門的排毒量。因此,唾液拭子是之前最常見、最高效的方法。值得注意的是,早期感染病例唾液中的病毒含量較低,而且病毒容易受到蛋白酶水解,因此,唾液拭子樣品要加入樣品保護劑。目前ASFV強毒株、弱毒株、疫苗毒株的出現大大增加了ASFV精準檢測的難度,因此很多實驗室不建議單純采集某個部位的樣本,以免造成漏檢。為了保證檢測結果的準確性,很多實驗室建議采用三種拭子(肛門拭子、尾尖血拭子、鼻腔拭子)組合的方式進行采樣,以便最大限度地提高檢測的準確性,避免出現假陰性的問題。
ASFV病原檢測以實時熒光定量PCR檢測為主。一般以棟舍為單位,陽性率超過5%且分布較為分散時,則對該棟豬舍的豬全群撲殺。對于陽性率較低的豬舍,根據檢測結果對陽性豬和其前、后、左和右的豬以及育肥豬欄整欄剔除,同時每隔2 d開展全群及環境普檢,連續監測3~4周,如果連續3~4周都是陰性,說明本次精準清除已經成功;如果結果依然是ASFV陽性,說明該豬場的精準清除失敗,可能需要全場清群進行復養。
5? 非洲豬瘟的綜合防控措施
5.1 生物安全措施與設施改進
5.1.1 設施改造
嚴格的豬場生物安全措施是防控ASF最根本的手段。大部分老式豬場需要改造外部和內部的生物安全設施。豬場外圍重要的改進點有:建場外洗消烘中心、人員和物資場外隔離消毒點、實心外墻、出豬通道、出豬臺和料塔等;豬場內重要的改進點有:實心墻豬欄、場內路面硬化以及凈道和污道分離、場內趕豬連廊、種豬獨立料槽等關鍵點(圖8~圖13);同時補充必要的設備和物資如暖風烘干機、噴火槍、死豬運輸手推車和不同顏色的工作服等。
5.1.2 生物安全風險點控制
生物安全風險點控制要把好入場關和出場關,對進入豬場的人員、物資、飼料、種豬等進行嚴格隔離消毒,檢測合格后方可進入;出售的豬、淘汰豬和病死豬出場也至關重要,避免場內和場外交叉污染,出豬通道要嚴格消毒。
人員、物資、飼料等入場,外部人員或豬場員工進場需提前24 h向豬場相關負責人提出申請,隔離檢測合格后方可進場,人員在進場前3 d不得去其他豬場、屠宰場、無害化處理場及動物產品交易場所等生物安全高風險場所。豬場供給品、飼料、引種入場等要進行嚴格消毒與隔離,檢測合格后才能進場。
賣豬時豬需要經專用出豬通道和出豬臺出場,出場后嚴格消毒豬經過的區域。裝死豬車和運豬糞車專場專用,運輸和交接過程中禁止與外部車輛接觸,交接地點離豬場越遠越好(至少大于1 km);車輛每次使用完后,必須及時清洗、消毒及干燥,車輛經過的道路也要進行消毒處理。
加強員工食堂的管理也很重要。豬場應該在生產區外面設置廚房等生活區,廚房工作人員不能進場。食材管理要注意將豬肉和雞肉混放在冷柜里,蔬菜消毒后才可食用。
除此之外,豬場還需要殺滅蚊蠅、滅鼠和防鳥類;豬場內應該禁止飼養狗、貓等小動物。
5.2 后備豬的引進
后備種豬引進后隔離和馴化是重點,科學合理的引進后備豬,豬場應該到有資質的種豬場引種,引種前應先評估該種豬場豬群的健康狀況。
引種前要進行隔離舍的清洗、消毒、干燥及空欄等準備工作,事先做好藥物、器械、飼料、用具等物資的消毒及儲備,隔離舍應有專人負責后備豬的飼養管理工作。
在隔離期間要密切觀察引進豬的健康狀況,適當添加藥物進行支原體肺炎、回腸炎等細菌性疾病的防控。隔離結束后對引進的后備豬進行健康評估,重點進行豬口蹄疫、豬瘟、非洲豬瘟、豬繁殖與呼吸綜合征、豬流行性腹瀉及豬傳染性胃腸炎等疾病的抗原檢測,同時還要進行豬偽狂犬gE抗體、口蹄疫O型/口蹄疫A型抗體和豬瘟抗體等檢測。
5.3 控制豬群應激因素,降低非洲豬瘟弱毒株的危害
5.3.1 應激的危害
應激是萬病之源,在現代養豬生產過程中,應激始終伴隨著豬的整個生長過程(圖14)。豬群受到應激后,會出現抵抗力下降、生產性能下降等問題,更容易被病原感染,原本的潛伏感染容易加重,從而表現出臨床癥狀。有研究表明,豬群受到外源刺激后,交感神經興奮引起腎上腺髓質釋放兒茶酚胺,分解代謝加強(脂肪氧化、糖元分解),同時皮質醇大量釋放,肝糖元的異生作用加強,蛋白質分解加速,具體表現為體溫升高、呼吸加快,免疫功能受抑制,生長和繁殖機能減慢;最后腎上腺皮質功能衰竭,體脂蛋白質分解,導致體重下降[18]。在ASFV弱毒株和疫苗毒株感染豬群后,豬群帶毒時間長并長期處于隱性帶毒狀態,這些豬極其脆弱,稍微受到應激就出現發病狀態,甚至急性死亡,業內俗稱為“玻璃豬”。減少豬群應激可以增強豬的抵抗力,減少甚至杜絕“玻璃豬”的情況。
5.3.2 應激的控制措施
豬出現應激后,首先要消除或減少應激源,改善飼養環境(如溫度、密度、濕度和通風),同時要加強營養,補充復合維生素(如強力拜固舒)、功能性氨基酸和電解質等營養物質[18]。
(1)補充復合維生素:豬發生應激時,皮質醇大量產生,肝糖原不足,脂肪和蛋白質的糖異生途徑加強,熱休克蛋白合成增多。在熱應激后的多種代謝途徑中,維生素均以輔酶和催化劑的形式參與其中,因此在應激環境中,為豬群添加復合維生素是必要的(如強力拜固舒)。有研究表明,食用比膳食推薦量(Recommended Dietary Allowance,RDA)多的維生素C有助于維持腎上腺功能,防止皮質醇水平過高;維生素B1可以保護腎上腺功能免于衰竭;維生素B12可以改變皮質醇分泌的高峰,使生物節律更加規律[18]。
(2)補充能量和電解質:熱應激導致豬出現呼吸性堿中毒、體液代謝紊亂、離子丟失,因此補充能量和電解質尤為重要;在母豬分娩時,給母豬補充能量和電解質(如科特壯)可提高母豬的產仔速度和產仔存活率。
(3)添加功能性氨基酸:有研究表明,在豬的腸外營養液中添加亮氨酸、異亮氨酸、纈氨酸等高濃度支鏈氨基酸,可減少骨骼肌的分解,極大改善全身蛋白質平衡。豬在遇到應激時會出現蛋白質的分解與丟失,而營養支持可以增加其治愈率。
(4)保證腸道健康:豬腸內營養的重要作用是保持小腸黏膜的完整性和屏障功能,維持黏膜抗體IgA的含量,同時抑制各種前炎癥介質的釋放,從而調節分解代謝,因此腸道健康對于動物機體來說至關重要[19]。
5.4 控制免疫抑制性疾病,減少ASFV弱毒株的危害
5.4.1 免疫抑制產生的原因
豬場常見的免疫抑制性疾病主要有非洲豬瘟(ASF)、豬繁殖與呼吸綜合征、豬圓環病毒病等疾病。正常情況下,豬的免疫器官(如骨髓、胸腺、淋巴結、脾臟等)在淋巴細胞、單核巨噬細胞等免疫細胞的參與下,共同完成對抗原(病原、疫苗)的識別和應答,這時機體會產生相應的抗體和細胞因子,進而對抗原進行殺滅和清除。當ASFV、PRRS病毒、豬圓環病毒2型等病原感染豬后,主要在豬的免疫細胞中復制,病原的大量復制會干擾免疫細胞的功能和抗原的遞呈,抑制或阻斷抗體的生成,從而導致暫時性或永久性的免疫抑制,機體抗病力下降,甚至喪失。
5.4.2 免疫抑制性疾病對豬群的危害
發生豬繁殖與呼吸綜合征、豬圓環病毒病等免疫抑制性疾病后,機體的免疫功能會減弱,容易出現混合感染情況,而且多病原的混合感染會加重病情,嚴重者失去治療價值。免疫抑制性疾病可導致繁殖母豬抗病力明顯下降,出現發情和生產障礙、配種率低、流產、返情、產死胎、產弱胎及產健仔少等現象,母源抗體保護力減弱會導致仔豬發病率升高等[22]。豬感染免疫抑制性疾病后會增加ASF防控的難度,也會使處于ASFV潛伏感染狀態的豬更易出現臨床癥狀,加大ASFV的排毒量,并延長排毒時間,增加精準清除的難度。
免疫抑制性疾病會干擾疫苗免疫和抗生素治療的效果,增加豬場疫苗和藥物的成本。在養豬生產中,當存在免疫抑制性疾病時,如果不能及時找出免疫抑制性疾病的根源,盲目加大疫苗免疫劑量,會加重豬免疫器官的損傷,導致免疫耐受或免疫麻痹。當豬群豬繁殖與呼吸綜合征病毒潛伏感染時,抗生素治療效果會很差,盲目加大藥物劑量,不僅治療效果不理想,還會導致豬群出現藥物中毒,造成肝和腎的功能下降,生長速度減慢,給豬場帶來更大的經濟損失。
5.4.3 免疫抑制性疾病的防控
(1)科學的飼養管理:保證飼養密度合理、飼養環境良好和營養均衡。在母豬和斷奶仔豬轉群時,在飼料中添加復合多維(如強力拜固舒),可提高豬群的健康度,減少應激。
(2)科學合理用藥:在飼料中添加高品質的替米考星和磺胺氯達嗪等藥物,控制豬繁殖與呼吸綜合征引起的繼發性細菌性感染,減輕豬繁殖與呼吸綜合征引起的免疫抑制[20-21];選擇優質的豬圓環病毒2型疫苗進行免疫。
(3)定期對豬群進行監測:定期監測ASF、豬繁殖與呼吸綜合征、豬圓環病毒病等免疫抑制性疾病的病原學和血清學,及時清除有問題的豬,有計劃、有目的地提高種豬群的健康度,最終達到提高生產成績的目標。
6? 小結
ASF最根本的防控措施是不讓病毒進入豬場,生物安全措施依然是預防ASF最根本的方法,大多數傳統豬場需要進行硬件設備的改造,對人員進行專業的培訓,執行嚴格的生物安全流程和專業的檢測。ASFV主要通過接觸傳播,傳播速度較慢,因此一旦豬場發現個別豬感染,可以通過精準清除的方法及時消滅感染豬,使豬場保持陰性。隨著ASFV弱毒株和疫苗毒株的出現,經典的“拔牙”方法面臨巨大挑戰,但是通過更加專業和精確的檢測以及更嚴格的生物安全措施,該病依然可以得到控制。對于感染ASFV弱毒株和疫苗毒株的豬場,在進行精準清除時需要控制其他疾病的感染,尤其是豬繁殖與呼吸綜合征和豬圓環病毒病這類免疫抑制性疾病及繼發感染,同時,豬場需要做好抗應激的工作,增強豬本身的抵抗力,減少排毒,提高“拔牙”的成功率。這些措施和方法是針對我國當前ASF形勢下暫時的應急措施,從長遠來看,未來中國ASF控制還是需要走徹底凈化的道路。
參考文獻:(22篇,略)

