基于網絡藥理學的麥冬治療糖尿病成分和機制及其配伍后作用通路改變研究△
席嘯虎
山西省中醫藥研究院,山西 太原 030012
糖尿病在中醫屬于消渴范疇,以陰液虧損為本、燥熱偏勝為標[1]。麥冬養陰潤燥、清熱生津,能療消渴陰虛之本[2]。文獻報道,麥冬發揮降血糖作用的成分多為麥冬多糖[3]。麥冬中還含有70余種甾體皂苷、30余種高異黃酮類化合物[4],其是否有潛在降血糖活性尚未明確。
中藥中復雜的化學成分通過多靶點、多途徑發揮作用,通過配伍和組方與其他藥味相互作用,共同發揮藥效[5-6]。網絡藥理學整體性、系統性和注重藥物間相互作用的特點與中醫藥學的基本特點相吻合,有利于揭示中藥復雜的作用機制[7]。
中醫治療糖尿病主要以清熱潤燥、養陰生津為主。由于本病常發生血脈瘀滯及陰損及陽的病變,且易并發癰疽、眼疾、勞嗽等證,故還應針對具體病情,及時合理地選用活血化瘀、清熱解毒、健脾益氣、滋補腎陰、溫補腎陽等治法。麥冬養陰潤燥、清熱生津,療消渴陰虛之本,黃芪補氣升陽、布津攝液;北沙參多入上焦,清肺熱、養肺陰,麥冬善入中焦,清胃熱、益胃陰,兩藥相須為用;丹參活血化瘀,黃連清熱瀉火,配伍麥冬增強清熱之力,使火去而津液自復,補虛而瀉實;麥冬-山藥-五味子3藥合用,可增強補腎養陰、潤肺作用。本研究依據中醫補氣、滋陰、清熱、活血、酸甘化陰等治療糖尿病基本的組方配伍方式[8],研究麥冬單味藥及配伍后治療糖尿病的潛在活性成分及作用機制,為進一步結合麥冬配伍后成分變化規律、血清藥物化學[9]、代謝組學[10]、體外及體內降血糖活性追蹤等方法探究其具體成分群提供參考。
1 材料與方法
1.1 麥冬及其配伍后化學成分與靶點的獲取
釆用TCMID(http://www.megabionet.org/tcmid/)、Batman-TCM(http://bionet.ncpsb.org/batman-tcm/)數據庫,結合文獻挖掘的方法,收集麥冬單味藥及其配伍的化學成分[11]。
根據BATMAN-TCM數據庫默認的閾值(prediction score cutoff>20),篩選可信度高的蛋白作為候選靶點,其中麥冬為重點研究對象,閾值選擇prediction score cutoff>15。使用UniProt數據庫(http://www.uniprot.org/)中UniProtKB功能,限定蛋白物種為人,校正蛋白名稱。
1.2 糖尿病作用靶點的獲取
在CTD(http://ctdbase.org/)、TTD (http://bidd.nus.edu.sg/group/cjttd/)、DrugBank (https://www.Drugbank.ca/)數據庫輸入diabetes、diabetes mellitus等關鍵詞,獲得糖尿病相關靶點[11]。
1.3 藥味-成分-靶點網絡的構建
將篩選得到的成分和靶點數據導入Cytoscape 3.7.2軟件(http://www.cytoscape.org/),構建藥味-成分-靶點網絡[11]。
1.4 蛋白質-蛋白質相互作用(PPI)網絡構建及分析
使用STRING 10.0(http://string-db.oig/)工具構建麥冬及其配伍后靶點PPI網絡,并進行拓撲分析和模塊分析。拓撲分析采用Cytoscape 3.7.2軟件進行Network Analyzer分析。以網絡節點中的拓撲結構特征值度(degree)和中介中心度(betweenness centrality,BC)為指標篩選關鍵靶點。模塊分析采用Cytoscape 3.7.2軟件ClusterViz插件中的MCODE算法,設置score>2,即至少包含3條邊[12]。
1.5 通路分析
通過DAVID 6.8(https://david.ncifcrf.gov/)數據庫對上述預測得到的關鍵靶點信息進行基因本體(GO)富集分析和京都基因與基因組百科全書(KEGG)通路注釋分析,并運用GraphPad Prism 5繪圖[12]。
2 結果
2.1 麥冬及其配伍后成分和靶點篩選
共篩選得到麥冬化學成分22個、靶點236個,黃芪化學成分和靶點分別為35、415個,麥冬與黃芪配伍共有靶點為96個;黃連化學成分和靶點分別為23、132個,麥冬與黃連配伍共有靶點為24個;山藥化學成分和靶點分別為20、478個,五味子化學成分和靶點分別為112、930個,麥冬與山藥、五味子配伍共有靶點為146個;丹參化學成分和靶點分別為75、769個,麥冬與丹參配伍共有靶點為82個;北沙參化學成分和靶點分別為17、181個,麥冬與北沙參配伍共有靶點為172個。
2.2 糖尿病靶點篩選
基于多個數據庫共檢索到糖尿病相關靶點181個,其中麥冬涉及靶點20個,占糖尿病靶點數的11.05%;麥冬與黃芪共有相關靶點13個,黃芪涉及靶點27個,分別占糖尿病靶點數的7.18%、14.91%;麥冬與黃連共有相關靶點9個,黃連涉及靶點13個,分別占糖尿病靶點數的4.97%、7.18%;麥冬與山藥共有相關靶點14個,山藥涉及靶點32個,分別占糖尿病靶點數的7.73%、17.68%;麥冬與五味子共有相關靶點13個,五味子涉及靶點41個,分別占糖尿病靶點數的7.18%、22.65%;麥冬與丹參共有相關靶點9個,丹參涉及靶點41個,分別占糖尿病靶點數的4.97%、22.65%;麥冬與北沙參共有相關靶點11個,北沙參涉及靶點13個,分別占糖尿病靶點數的6.08%、7.18%;麥冬與各藥味配伍后,涉及靶點58個,占糖尿病靶點數的32.04%。藥味-成分-靶點網絡見圖1。

圖1 麥冬及其配伍治療糖尿病的藥味-成分-靶點網絡
2.3 PPI網絡分析
使用STRING工具構建PPI網絡,見圖2。其中麥冬單味藥治療糖尿病靶點的PPI網絡包括20個節點和24條邊;麥冬與黃芪配伍治療糖尿病靶點的PPI網絡包括33個節點和74條邊;麥冬與黃連配伍治療糖尿病靶點的PPI網絡包括24個節點和36條邊;麥冬與丹參配伍治療糖尿病靶點的PPI網絡包括51個節點和259條邊;麥冬與北沙參配伍治療糖尿病靶點的PPI網絡包括22個節點和33條邊;麥冬與山藥、五味子配伍治療糖尿病靶點的PPI網絡包括48個節點和244條邊;麥冬與所有藥味共同配伍后,共包括58個節點和330條邊。
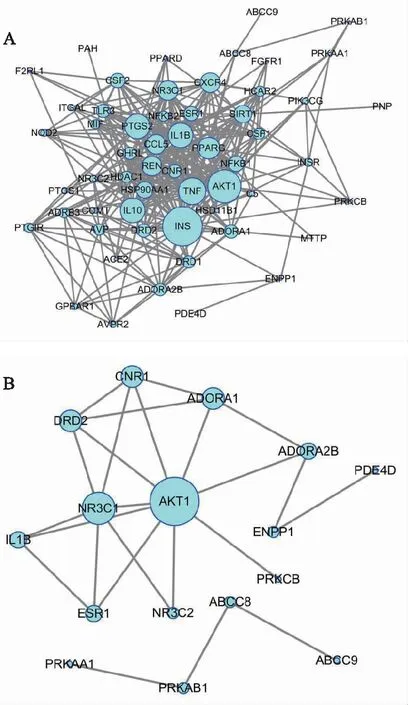
注:A.麥冬與其他藥味配伍;B.麥冬單味藥;FBP1、MTTP、PPARD、PNP等無蛋白間相互作用。圖2 麥冬及其配伍治療糖尿病活性靶點PPI網絡
麥冬配伍后治療糖尿病靶點網絡的拓撲屬性分析結果見表1。通過對連接度排序靠前的靶點及麥冬單味藥靶點進行模塊分析,發現蛋白激酶B1(Akt1)、大麻素受體1(CNR1)、多巴胺受體D2(DRD2)等為主要相關靶點,預測麥冬及其配伍通過影響中樞系統進而調節血糖。模塊分析結果顯示,score>2的靶點根據打分排序聚成3類,不同模塊對應參數見表2,靶點間相互關系見圖3,模塊對應的生物過程(BP)、分子功能(MF)、細胞組成(CC)及KEGG通路富集分析見表3。
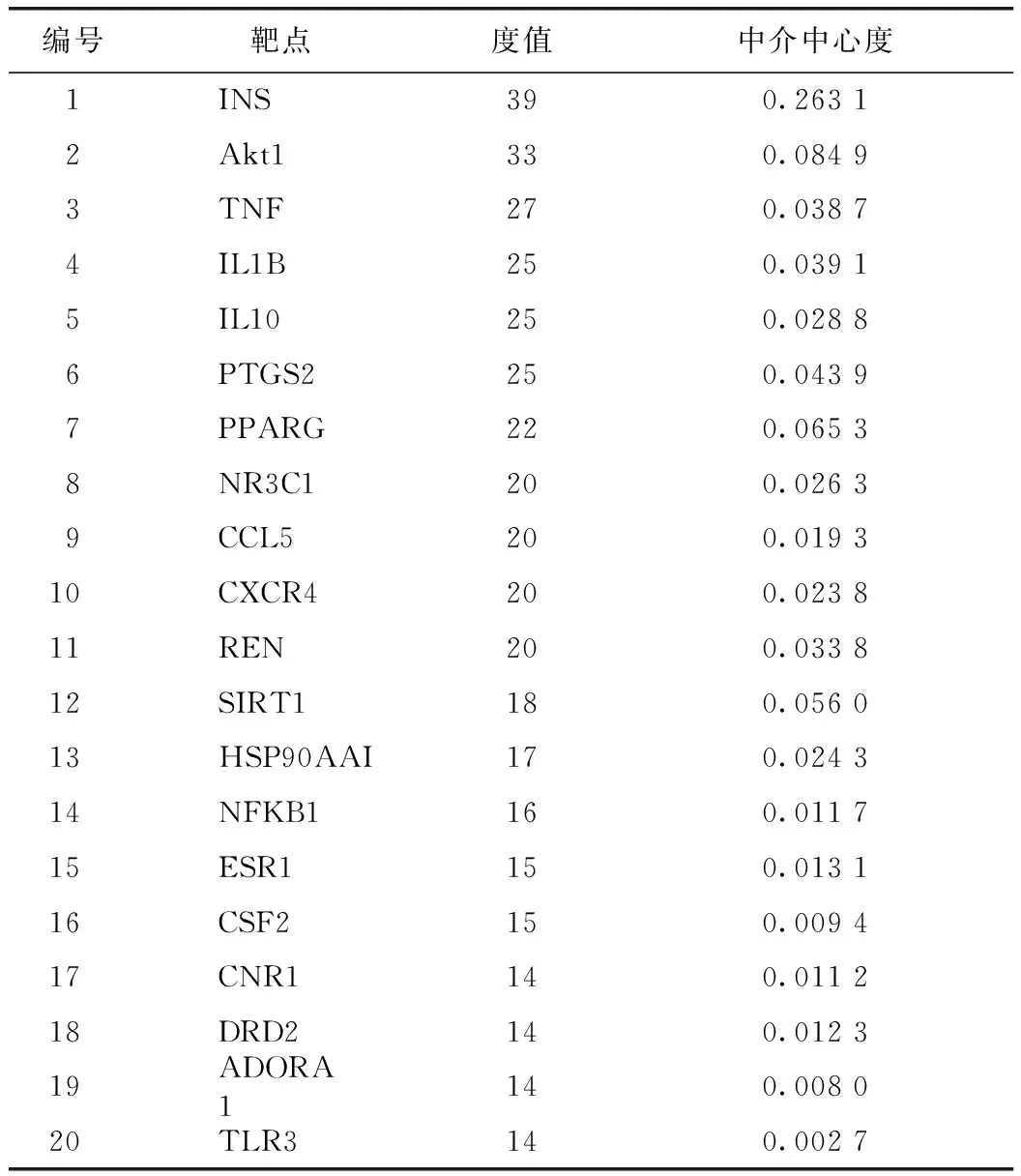
表1 麥冬配伍后治療糖尿病靶點的拓撲屬性分析(前20位)

表2 麥冬配伍后治療糖尿病靶點模塊參數
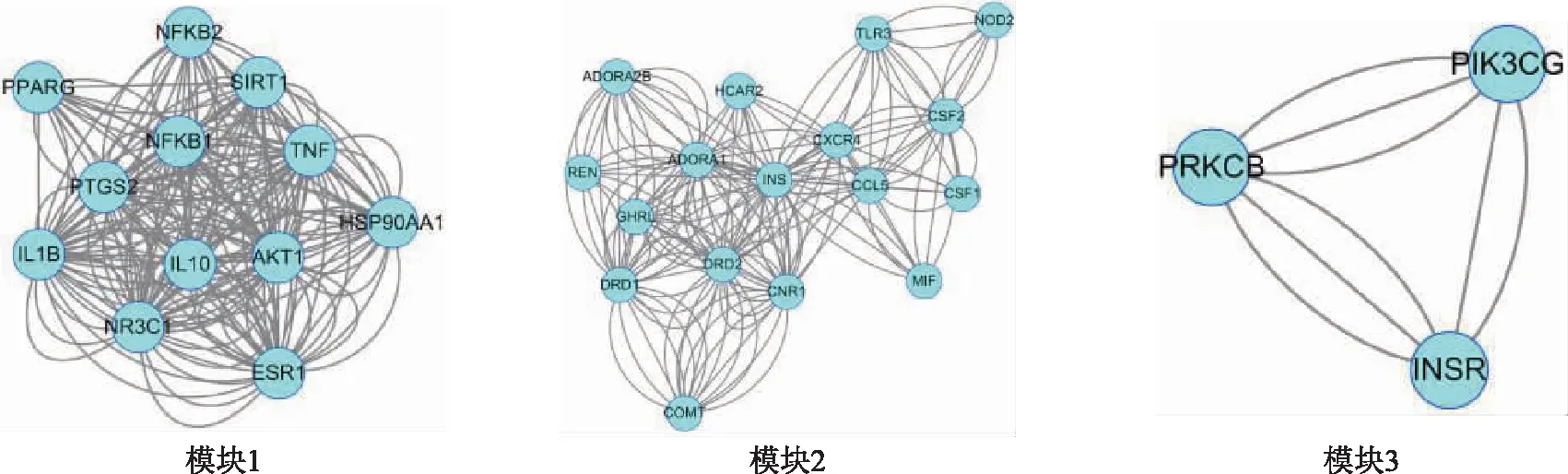
圖3 麥冬配伍后治療糖尿病靶點模塊關聯分析

表3 麥冬配伍后治療糖尿病靶點富集分析
2.4 通路分析
2.4.1GO富集分析 將麥冬及其配伍治療糖尿病交集網絡中的靶點通過DAVID數據庫進行GO富集分析,從BP、MF、CC 3個不同角度對基因功能進行注釋[P<0.05,錯誤發現率(FDR)<0.05]。GO富集分析結果顯示,麥冬單味藥靶標基因主要富集在58個BP、19個CC和6個MF。麥冬配伍后靶標基因富集在206個BP、31個CC和18個MF。其中按照顯著性由高到低進行排序,排名前14位的結果見圖4~5。
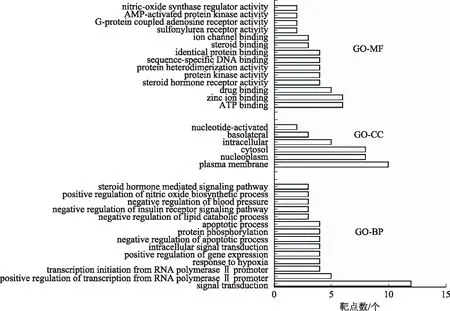
圖4 麥冬治療糖尿病GO富集分析
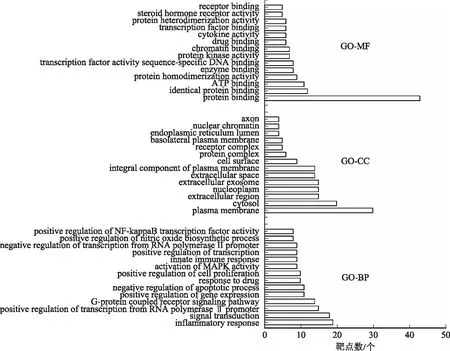
圖5 麥冬配伍后GO富集分析
2.4.2KEGG分析 將麥冬及其配伍治療糖尿病交集網絡中的靶點通過DAVID數據庫進行KEGG富集分析,結果顯示,麥冬單味藥具有顯著意義的通路有14條,配伍后增加至63條(P<0.05,FDR<0.05)。排名前14位的結果見圖6~7。
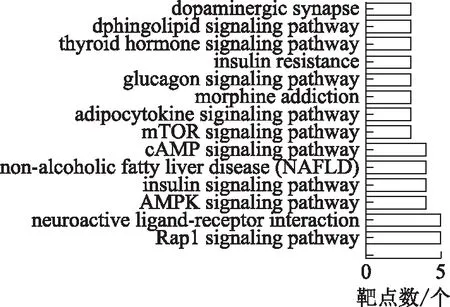
圖6 麥冬治療糖尿病KEGG通路分析

圖7 麥冬配伍后KEGG通路分析
3 討論
本研究結果表明,麥冬單味藥中麥冬皂苷、麥冬黃烷酮、甲基麥冬黃烷酮等成分可以直接作用于相關靶點起到糖尿病治療作用。麥冬配伍后,治療糖尿病的相關靶點增加,成分之間相互作用也增加。其中,涉及到的活性成分包括黃芪中的黃芪甲苷類、黃芪素等,五味子中的五味子醇甲、木脂素類、烯類等,黃連中的生物堿類,山藥中的尿囊素、山藥素,丹參中的丹參酮類、丹參酚醌類及北沙參中的槲皮素、谷甾醇等。說明麥冬可能通過與其他藥味或其中成分的相互作用及靶點蛋白之間相互作用增強治療糖尿病的活性并擴大功能通路。基于網絡藥理學數據分析,麥冬甲基高異黃酮A和麥冬甲基高異黃酮B表現出直接或間接的治療糖尿病活性,可作為重點研究對象。
依據PPI分析、模塊分析、通路分析及BATMAN-TCM數據庫蛋白可信度值 (prediction score)等結果顯示,麥冬單味藥涉及的關鍵靶點為Akt1、CNR1、DRD2等,KEGG通路主要涉及Ras相關蛋白1(Rap1)、環磷腺苷(cAMP)、腺苷酸活化蛋白激酶(AMPK)等,生物學過程主要包括三磷酸腺苷結合(ATP binding)、質膜(plasma membrane)、信號轉導(signal transduction)等。麥冬通過配伍新增關鍵靶點為INS、腫瘤壞死因子(TNF)、白細胞介素-10(IL-10)等,新增通路為磷脂酰肌醇3-激酶/蛋白激酶(PI3K/Akt)、癌癥(cancer)、TNF等,新增生物學過程為蛋白結合(protein binding)、炎癥反應(inflammatory response)等。下丘腦-垂體-腎上腺(hypothalamo-pituitary-adrenal,HPA)軸作為機體能量代謝的調節中樞,在2型糖尿病發生過程中起重要作用。下丘腦內分布有大量CNR1,大麻素系統可廣泛調節中樞神經系統神經元的功能。CNR1可通過調節HPA軸改善2型糖尿病指標[13]。PI3K/Akt是胰島素信號傳導的經典途徑,DRD2可通過影響下游細胞內信號轉導通路關鍵基因PI3K、Akt在外周細胞中的表達水平改善糖代謝[14],但配伍成分及具體機制不明確,是麥冬相關研究的關鍵突破點。Rap1是一種控制細胞粘附、細胞-細胞連接形成和細胞極性等多種過程的小三磷酸鳥苷環水解酶(GTPase),可調控下游PI3K、Akt因子,改善血糖水平。cAMP是環核苷酸系統的一種,腺苷酸環化酶-環磷腺苷-蛋白激酶A(AC-cAMP-PKA)途徑在糖尿病大鼠周圍神經中表達水平下降,活性成分通過調控AC-cAMP-PKA途徑防治糖尿病神經病變[15]。AMPK對糖代謝的調節主要是增加葡萄糖攝取,增加糖酵解并抑制糖異生,AMPK是一種絲氨酸/蘇氨酸蛋白激酶,激活后能夠改善胰島素敏感性及葡萄糖穩態,對糖代謝的調節主要是增加葡萄糖攝取,增加糖酵解并抑制糖異生[16]。
本研究通過網絡藥理學方法初步確定麥冬單味藥及其配伍后改善糖尿病的物質基礎及作用機制。研究結果表明,麥冬治療糖尿病的物質基礎與其配伍、組方密不可分,通過有效配伍后作用通路顯著增加。該結果提示,麥冬中的部分化學成分可以通過直接作用治療糖尿病,另一些成分可以通過配伍促進其他成分顯效或被其他成分輔助顯效,其中涉及的所有成分,均可認定為麥冬治療糖尿病物質基礎組群。這種配伍后活性和機制的改變與化學成分含量改變有關,同時與成分作用的蛋白靶點之間的相互作用有關。本課題組后續擬進一步基于網絡藥理學數據、配伍后成分變化情況、活性成分追蹤結果、血清藥物化學分析等,通過多層次信息挖掘與融合,總結麥冬治療糖尿病相關活性組分群。通過在活性組分群中主要成分有序、有效捕獲(增加)/扣除(減少)后體外、體內活性對比研究,明確麥冬相關配伍成分及其作用貢獻度。

