酵母培養物對珍珠龍膽石斑魚生長性能、腸道形態、免疫功能和抗病力的影響
劉泓宇,李立賢,AYIKU Stephen,唐 澤,范 煒,譚北平,董曉慧,遲淑艷,楊奇慧,章 雙,周文豪
(1.廣東海洋大學水產動物營養與飼料實驗室,廣東 湛江 524088;2.農業部華南水產與畜禽飼料重點實驗室,廣東 湛江 524088;3.廣東省水產動物精準營養與高效飼料工程技術研究中心,廣東 湛江 524088;4.北京英惠爾生物科技有限公司,北京 100081)
珍珠龍膽石斑魚是鞍帶石斑魚 (Epinephelus lanceolatus,) 與棕點石斑魚 (Epinephelus fuscoguttatus,♀) 的雜交種[1]。由于其飼料系數低,生長速度快,適口性好,市場價值高,許多亞洲國家均有養殖[2]。我國南方各省市石斑魚養殖已形成一定規模[3],然而集約化養殖的石斑魚易暴發傳染病,給石斑魚養殖業造成重大的經濟損失[4-6]。
酵母水解物在水產飼料中多以酵母粉(酵母細胞失活后形成的蛋白類物質)形式的單細胞蛋白,未進行細胞壁裂解和酶解等深加工處理,未能充分釋放酵母細胞的內含物質,導致其功能性物質的不能發揮到最大功效。酵母培養物是酵母菌在特定工藝條件下經特定培養基厭氧發酵的微生態制品[7],含酵母細胞及其代謝產物,以及變性培養基。酵母細胞壁的β-葡聚糖和甘露寡糖(MOS)成分有促進免疫的作用,其中β-葡聚糖成分可激活巨噬細胞,使巨噬細胞釋放白細胞介素和細胞因子等免疫球蛋白,以幫助水生動物抵御各種病原體[8]。酵母產物在魚類養殖業中潛在應用優勢日益增大,利用酵母產物改善魚類的生長和免疫反應已成為近年來的研究熱點。何遠法等[9-10]發現,酵母培養物可顯著提高凡納濱對蝦(Litopenaeus vannamei)的生長性能和非特異性免疫力,并改善凡納濱對蝦腸道菌群多樣性。酵母培養物中的甘露寡糖可提高豹星斑(Mycteroperca rosacea)生長性能、免疫力和抗病性[11]。雷宇杰等[12]研究發現,飼料中添加酵母培養物可顯著提高斑點叉尾鮰(Ictalurus punetaus)生長性能及飼料養分表觀消化率。草魚(Ctenopharyngodon idella)飼料中添加質量分數12%的酵母培養物可調節其腸道微生物區系,顯著提高氨基酸、脂肪代謝及消化能力[13]。
目前,酵母蛋白飼料研究中一般采用高蛋白含量固體發酵培養法,通過在發酵底物中添加非蛋白氮的方式來提高飼料蛋白質的含量。已有酵母培養物對珍珠龍膽石斑魚的生長、血清生化指標、抗氧化能力影響等研究[14-16],本研究在此基礎上評估飼料中不同發酵底物 [含非蛋白氮(L)和不含非蛋白氮(N)] 酵母培養物對珍珠龍膽石斑魚生長性能、免疫應答和腸道形態及抗哈維氏弧菌感染能力的影響,為珍珠龍膽石斑魚健康養殖研究及環保節能飼料開發提供科學依據。
1 材料和方法
1.1 實驗材料
兩種不同發酵底物的酵母培養物(L,發酵底物含非蛋白氮,蛋白質量分數55%;N,發酵底物不含非蛋白氮,蛋白質量分數50%,其他成分氨基酸、酸溶蛋白、甘露聚糖、核苷酸、活性肽基本一致)由北京英惠爾生物技術有限公司提供。實驗飼料中礦物質預混料購自廣東湛江粵佳飼料有限公司,其他原料購自廣東湛江市海寶飼料廠。所有原料粉碎后過孔徑250 μm 的篩,按照配方準確稱取,混合均勻,放入V 型立式混合機中混合,緩慢加入所配飼料質量25%~30%的水,混勻。用F-26 型雙螺桿擠條機 (華南理工大學) 加工成粒徑為2.5 mm的顆粒飼料,室溫下風干至水分質量分數約10%,用封口袋分裝,于-20 ℃冰箱儲存備用。
實驗用珍珠龍膽石斑魚為湛江某養殖孵化場遺傳背景相同、無病原體的魚苗。實驗前在室內用玻璃鋼養殖桶暫養2 周,期間投喂商業飼料(蛋白質量分數50%,脂肪質量分數11%左右)。攻毒用哈維弧菌(Vibrio harveyi)分離自廣東省海洋大學水產動物病原生物學與流行病學省級重點實驗室的患病珍珠龍膽石斑魚,在-80 ℃下凍存于含體積分數25%胰蛋白酶的大豆蛋白胨中。
1.2 實驗設計
配制5 種蛋白質質量分數為50%、脂肪質量分數為11%的等氮等脂飼料,對照組(C0)含質量分數34%的魚粉,試驗組L1 和L2 分別添加質量分數2%、4%的酵母培養物L,N1 和N2 組分別添加質量分數2%、4%的酵母培養物N,分別記為C0(0%)、L1(2%)、L2(4%)、N1(2%)和N2(4%)。實驗飼料成分及營養水平見表1。
實驗魚停飼12 h 后,取體質量為(17.56±0.02)g 的幼魚450 尾,隨機放入15 個0.5 m3玻璃鋼養殖桶,每桶30 尾。每天9:00、17:00 按體質量5%~ 8%飽食投喂。每天早上投喂前,各桶更換60%的海水。觀察飼料攝入量、石斑魚死亡率和水質參數。養殖水溫(28.0±2.0)℃,pH 8.1±0.1,鹽度28~ 31,自然光周期,溶解氧6~ 8 mg·L-1。
1.3 樣本采集
養殖實驗結束后,停飼24 h。記錄每個養殖桶中魚的數量和體質量。每個養殖桶隨機取魚11 尾,2 尾凍存在-20 ℃用于體成分分析;6 尾樣本尾靜脈中抽取血樣,在4 ℃靜置12 h 后,以3 500 r/min 離心10 min,上清液于-80 ℃下保存,用于酶活性測定;3 尾樣本于無菌條件下剖取中腸 (0.8~ 1.2 cm),用體積分數10%甲醛溶液固定,用于組織學分析。
1.4 生長指標分析
實驗8 周后,分別統計各實驗組和對照組的投喂飼料總量。計算存活率、增重率 (WGR)、特定生長率 (SGR) 和飼料系數 (FCR):

mf,平均終末體質量 (g);mi,初始體質量(g);t,飼養時間 (d);mt,實驗期間投入飼料量 (g)。
1.5 飼料和全魚的化學成分分析
使用AOAC (Association of Official Analytical Chemists,2005)[17]標準方法檢測配方飼料成分和魚體成分。在105 ℃的烘箱干燥樣品至質量恒定。采用凱氏定氮儀(FOSS KT8400)測定蛋白含量。在550 ℃的馬弗爐中灼燒2 g 樣品4 h,測定灰分含量。使用脂肪測定儀(ANKOM XT15)測定粗脂肪含量。
1.6 血清免疫分析
使用南京建成公司的試劑盒用全波長酶標儀(ThermoFisher Multiskan GO)測定血清葡萄糖(SOD)、丙二醛 (MDA)、酸性磷酸酶 (ACP)、天冬氨酸轉氨酶 (AST)、丙氨酸轉氨酶 (ALT)、堿性磷酸酶 (AKP)、溶菌酶 (LZM) 和免疫球蛋白(Glu)、總蛋白(TP)、甘油三酯 (TG)、膽固醇(CHO)、過氧化氫酶 (CAT)、超氧化物歧化酶(IgM)。測定過程中嚴格遵循試劑盒的操作方法。
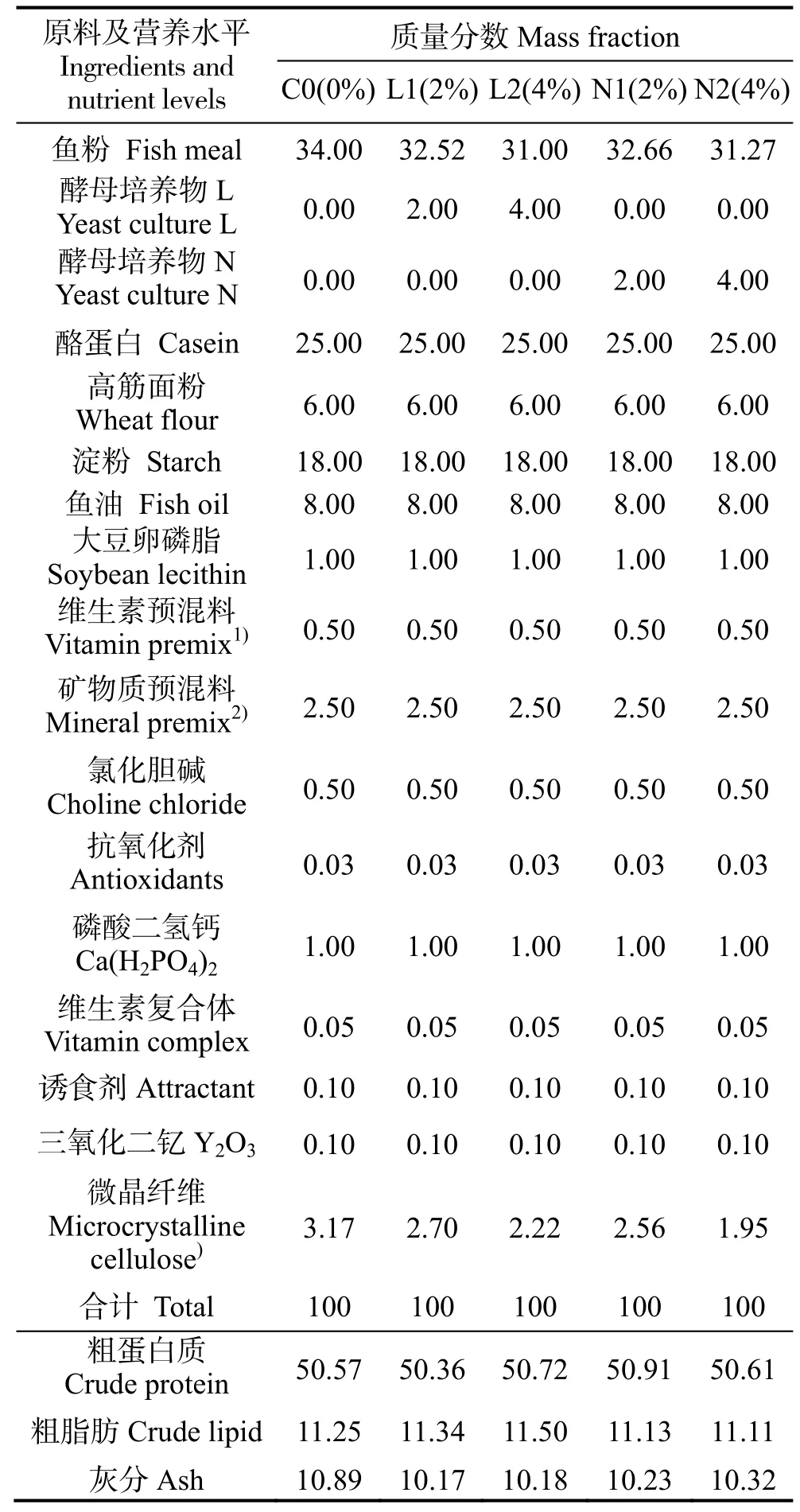
表1 實驗飼料組成及營養水平(干基)Table 1 Formulation and proximate composition of experimental diets (dry matter) %
1.7 腸道組織學分析
取腸道組織,切片,厚度為5 μm,蘇木精-伊紅染色,在顯微鏡 (Olympus,model BX51,Serial number:9K18395,Tokyo,Japan) 下觀察和拍照,使用Image-Pro Plus 6.3 (Media Cybernetics,Inc.,Rockville,USA) 軟件,測定放大100 倍時腸絨毛高度 (VH)、絨毛寬度 (VW) 和肌肉厚度 (MT)。每個切片取12 個測量值平均值。確定添加酵母培養物的飼料對魚類腸道形態的影響。
1.8 攻毒實驗
將凍存的哈維氏弧菌置于裝有LuriaBertani(LB) 培養液的250 mL 平底燒瓶內,在培養箱中以37 ℃、180 r/min 條件振蕩培養20 h。以4 ℃、8 000 r/min 離心10 min,棄去上清液,用無菌磷酸鹽緩沖溶液 (PBS) 沖洗2 次。根據預實驗,3 d半致死濃度為3.58 × 105cfu/mL,因而用PBS 連續稀釋至3.58 × 105cfu/mL。經過56 d 的飼養實驗,從每組中隨機取魚12 尾進行攻毒實驗,每尾魚注射200 μL 細菌懸浮液。另外從每組中取12 尾,分別注射同劑量的生理鹽水作為空白對照組(NC)。各組攻毒期間仍投喂相應的實驗飼料。注射12 h后隨機取魚2 尾,采集血液樣本。樣品以4 ℃、3 500 r/min 的條件離心10 min。上清液于-80 ℃條件下保存,用于酸性磷酸酶 (ACP)、堿性磷酸酶(AKP)、溶菌酶(LZM)和免疫球蛋白M(IgM)的活性測定。記錄攻毒168 h 后各組的存活率。
1.9 數據統計
實驗結果以“平均值±標準誤”(mean±SEM)表示,采用SPSS 21.0 軟件進行單因素方差分析和Turkey 檢驗,存活率數據則先進行反正弦平方根轉換再進行統計分析,以P<0.05 表示差異顯著。
2 結果
2.1 生長、飼料利用率和存活率
表2 表明,與對照組相比,實驗組的生長性能有增加趨勢或顯著增加,其中N1 和N2 組的終末體質量(FW)、增重率和特定生長率最高(P< 0.05)。實驗組飼料系數有降低趨勢或顯著降低,N1 和N2組飼料系數顯著降低(P< 0.05)。存活率分析結果顯示,L2、N1、N2 組存活率顯著提高(P< 0.05)。
表2 添加酵母培養物對珍珠龍膽石斑魚生長性能的影響Table 2 Effects of dietary yeast culture supplementation on the growth of Epinephelus fuscoguttatus♀×E.lanceolatu
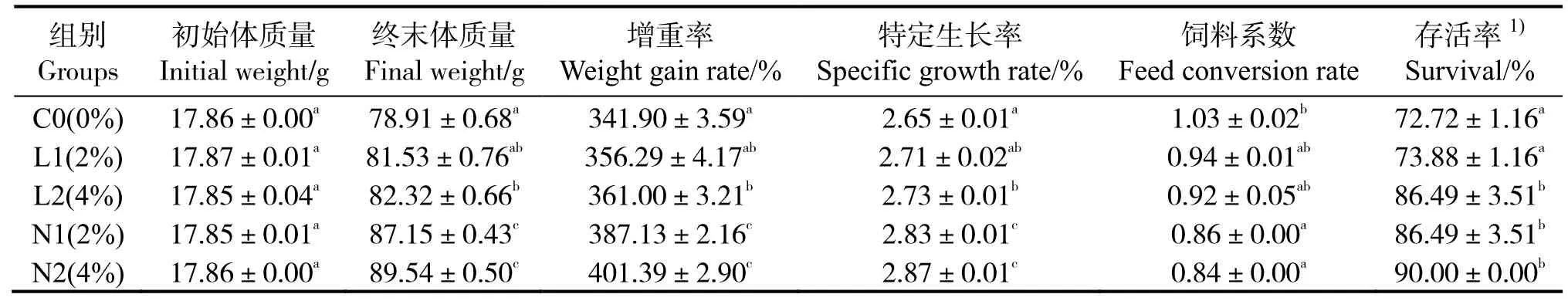
表2 添加酵母培養物對珍珠龍膽石斑魚生長性能的影響Table 2 Effects of dietary yeast culture supplementation on the growth of Epinephelus fuscoguttatus♀×E.lanceolatu
注:同列數據肩標凡含一個相同字母表示組間無顯著差異(P>0.05);1) 反正弦平方根轉換值。Note:The data in same column with a same letter mean no significant difference between them at level of 0.05;1) arcsine of square root of percentage.
2.2 全魚體常規成分
表3 可見,與對照組相比,飼喂酵母培養物飼料后,L1、L2 組粗蛋白顯著升高,N1、N2 組的干物質、粗蛋白、灰分含量(干基)均有顯著提高(P< 0.05)。N2 實驗組干物質、粗蛋白、灰分含量顯著提高,而N1 組粗脂肪含量顯著增加(P< 0.05)。
表3 酵母培養物對珍珠龍膽石斑魚全魚常規成分的影響Table 3 Effects of dietary yeast culture supplementation on whole body composition of Epinephelus fuscoguttatus♀ ×E.lanceolatu
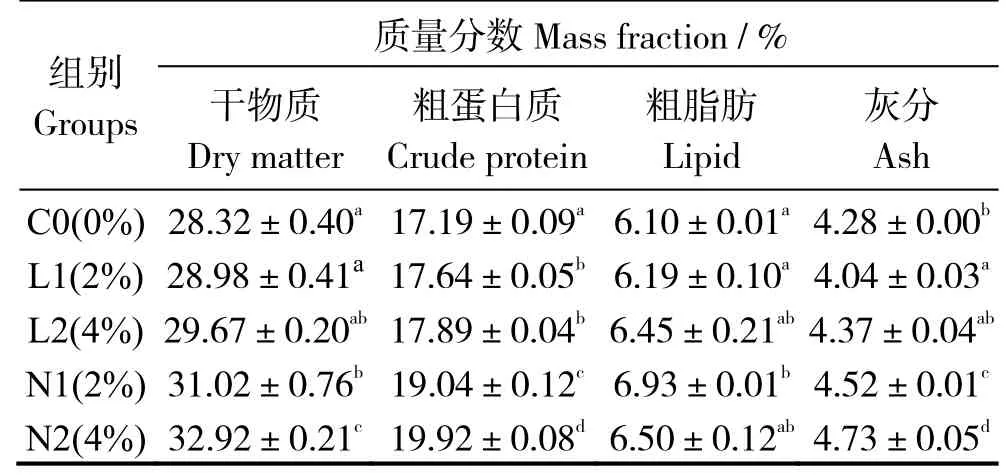
表3 酵母培養物對珍珠龍膽石斑魚全魚常規成分的影響Table 3 Effects of dietary yeast culture supplementation on whole body composition of Epinephelus fuscoguttatus♀ ×E.lanceolatu
注:同列數據肩標凡含一個相同字母表示組間無顯著差異(P>0.05)。Note:The data in same column with a same letter mean no significant difference between groups at level of 0.05.
2.3 腸道消化酶
表4 可見,與對照組C0 相比,各實驗組胰蛋白酶、脂肪酶和淀粉酶均顯著升高(P< 0.05),L2組胰蛋白酶、脂肪酶、淀粉酶平均值最高,顯著高于C0、N2 組(P< 0.05)。
表4 酵母培養物對珍珠龍膽石斑魚腸道消化酶活性的影響Table 4 Effects of dietary yeast culture supplementation on the gastrointestinal digestive enzyme activities of Epinephelus fuscoguttatus♀×E.lanceolatuU/mg
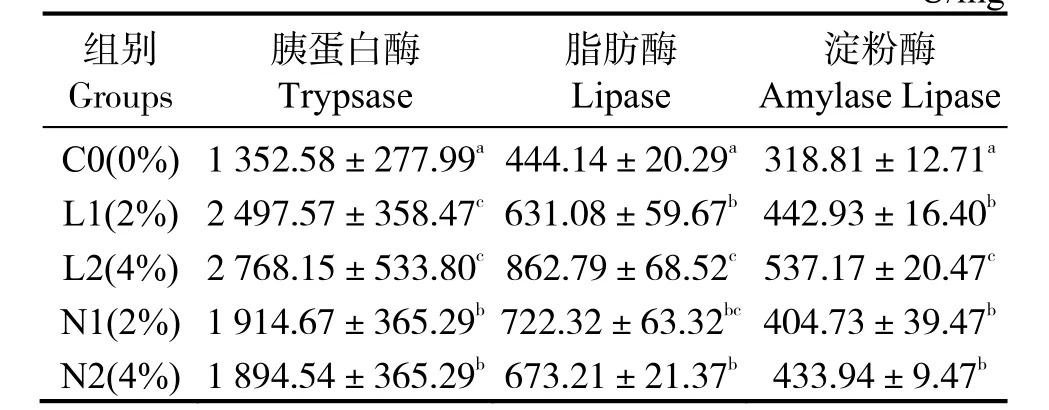
表4 酵母培養物對珍珠龍膽石斑魚腸道消化酶活性的影響Table 4 Effects of dietary yeast culture supplementation on the gastrointestinal digestive enzyme activities of Epinephelus fuscoguttatus♀×E.lanceolatuU/mg
注:同列數據肩標凡含一個相同字母表示組間無顯著差異(P>0.05)。Note:The data in same column with a same letter mean no significant difference between groups at level of 0.05.
2.4 血清生化指標
表5 可見,在飼料中添加酵母培養物可顯著增加血清的總蛋白(TP)水平(P< 0.05)。N2 組TP含量最高(P< 0.05)。與對照組相比,各實驗組血清葡萄糖含量呈下降趨勢,N2 組平均值最低,與對照組有顯著差異(P< 0.05)。與對照組相比,除N1組甘油三酯(TG)顯著升高外,各組間TG 及膽固醇差異無統計學意義(P> 0.05)。各組間CHO 差異無統計學意義(P> 0.05)。N2 組的丙氨酸轉氨酶和天冬氨酸轉氨酶活性顯著低于對照組(P< 0.05)。
表5 添加酵母培養物對珍珠龍膽石斑魚血清生化指標的影響Table 5 Effects of dietary yeast culture supplementation on hematological indices of Epinephelus fuscoguttatus♀×E.lanceolatu
表5 添加酵母培養物對珍珠龍膽石斑魚血清生化指標的影響Table 5 Effects of dietary yeast culture supplementation on hematological indices of Epinephelus fuscoguttatus♀×E.lanceolatu
注:數據肩標凡含一個相同字母表示組間無顯著差異(P>0.05)。Note:The data in same column with a same letter mean no significant difference between groups at level of 0.05.
2.5 血清抗氧化指標
圖1 可見,攻毒12 h 后,N2 組血清SOD 活性顯著高于對照組(P< 0.05),但與L1、L2 和N1 組差異不顯著(P>0.05)。N1 和N2 組CAT 含量(圖1_B)在攻毒12 h 后顯著高于其余三組(P< 0.05)。在攻毒前和攻毒12 h 后,酵母培養物處理組MDA 活性(圖1_C)顯著低于對照組 (P< 0.05)。攻毒12 h 后,N2組MDA 活性最低,顯著低于其余各組(P<0.05)。
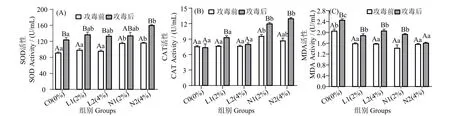
圖1 珍珠龍膽石斑魚攻毒前和攻毒12 h 后血清SOD,CAT 和MDA 含量變化Fig.1 Effects of dietary yeast culture supplementation on serum SOD,CAT and MDA response in Epinephelus fuscoguttatus♀×E.lanceolatu pre-challenge and 12 h after challenge
2.6 血清免疫指標
圖2 可見,攻毒后12 h,N2 組血清酸性磷酸酶(ACP)含量顯著高于攻毒前(圖2_A),且顯著高于同期對照組(P< 0.05)。攻毒后12 h,L1、L2、N1 和N2 組血清堿性磷酸酶(AKP)活性無顯著差異(P>0.05),但較攻毒前顯著提高(P<0.05)(圖2_B)。各組血清溶菌酶(LZM)活性在攻毒前顯著低于攻毒后(圖2_C)(P< 0.05),L2和N1 組LZM 活性在攻毒后顯著高于同期對照組(P< 0.05)。攻毒12 h 后,N1 和N2 組免疫球蛋白(IgM)活性顯著升高(圖2_D),且顯著高于同期對照組(P< 0.05)。
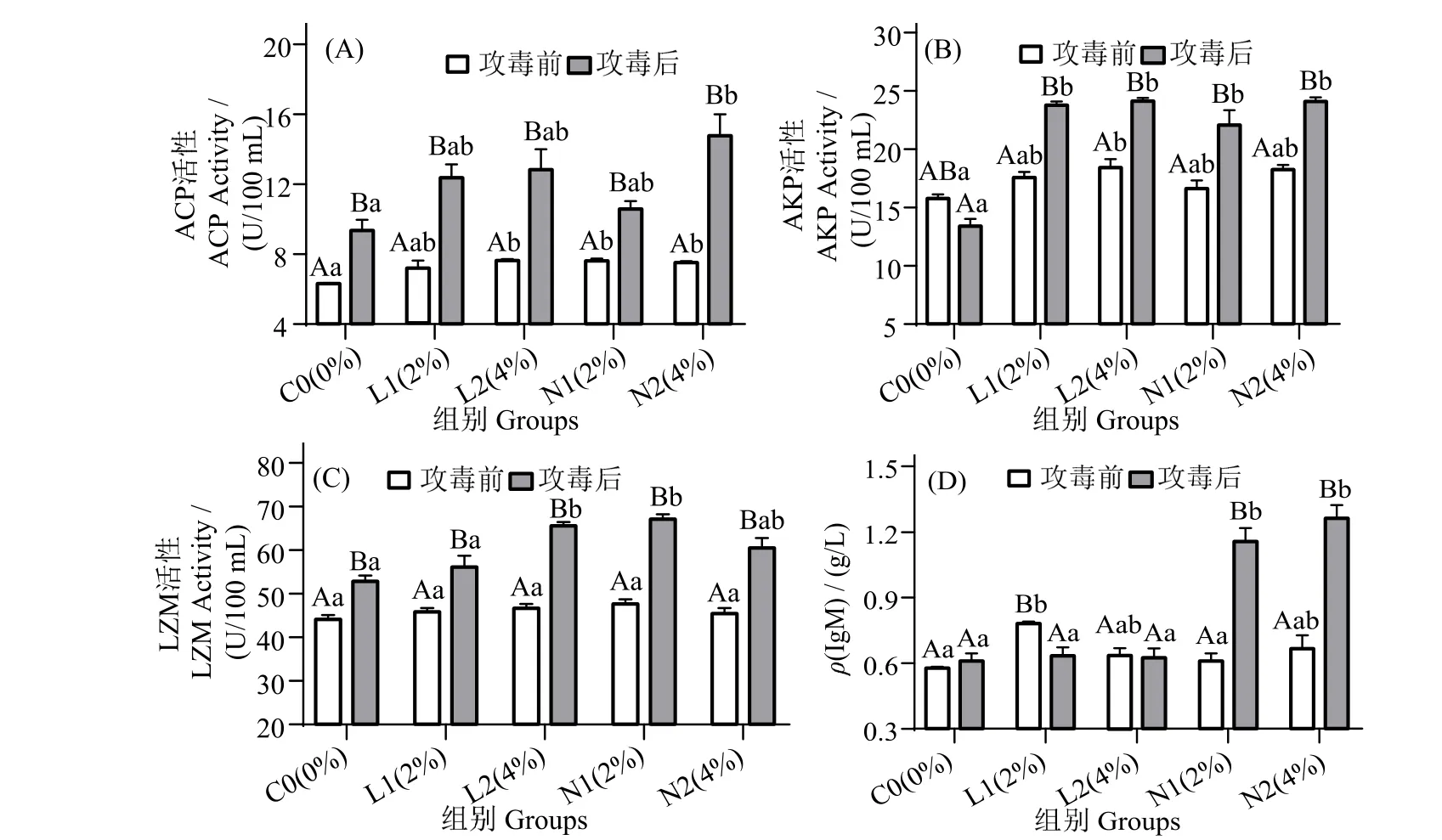
圖2 珍珠龍膽石斑魚攻毒前和攻毒12 h 后血清ACP,AKP,LZM 和IgM 活性變化Fig.2 Effects of dietary yeast culture supplementation on serum ACP,AKP,LZM and IgM response in Epinephelus fuscoguttatus♀×E.lanceolatu pre-challenge and 12 h after challenge
2.7 腸道形態結構
圖3 和表6 可見,除L1 組外,添加酵母培養物后,其余各組絨毛高度 (VH) 和絨毛寬度 (VW)均顯著增加(P< 0.05),而N1 和N2 組間無顯著性差異(P> 0.05)。實驗組中肌肉厚度 (MT) 有所增加,與對照組相比,僅N1 組顯著增加P< 0.05)。
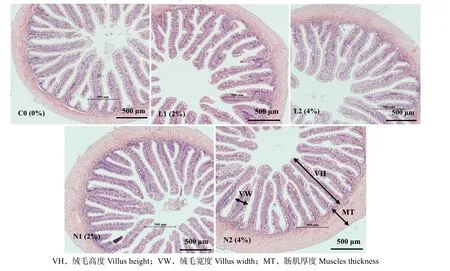
圖3 添加酵母培養物魚粉對珍珠龍膽石斑魚腸絨毛高度、絨毛長度和腸肌厚度的影響Fig.3 Effects of supplementation of fishmeal with yeast culture on villus height,villus width and intestinal muscle thickness of Epinephelus fuscoguttatus♀×E.lanceolatu
表6 酵母培養物對珍珠龍膽石斑魚腸道形態的影響Table 6 Effects of supplementation of fishmeal with yeast culture on intestinal morphology of Epinephelus fuscoguttatus♀×E.lanceolatu μm
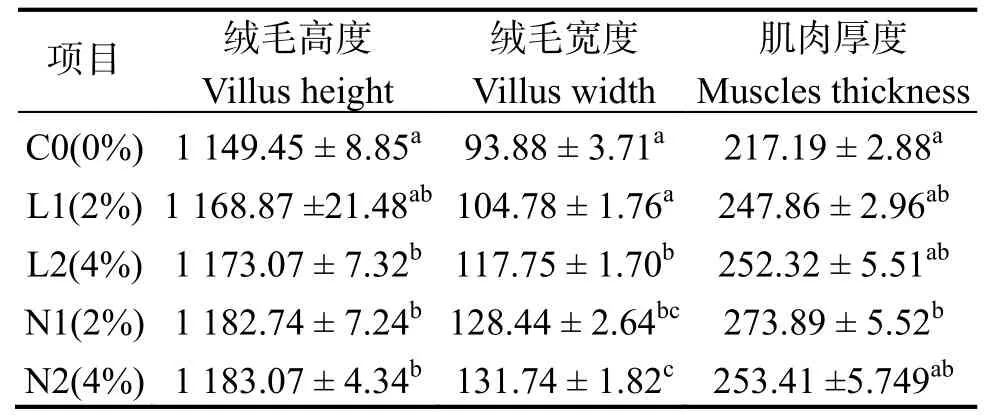
表6 酵母培養物對珍珠龍膽石斑魚腸道形態的影響Table 6 Effects of supplementation of fishmeal with yeast culture on intestinal morphology of Epinephelus fuscoguttatus♀×E.lanceolatu μm
注:同列數據肩標凡含一個相同字母表示組間無顯著差異(P>0.05)。Note:The data in same column with a same letter mean no significant difference between groups at level of 0.05.
2.8 哈維氏弧菌攻毒實驗
圖4 可見,攻毒168 h 后,注射生理鹽水組(NC)珍珠龍膽石斑魚無死亡記錄,酵母培養物處理組累積存活率與對照組相比差異顯著(P< 0.05)。N2實驗組存活率最高 (80%),對照組C0 存活率最低(20%)。
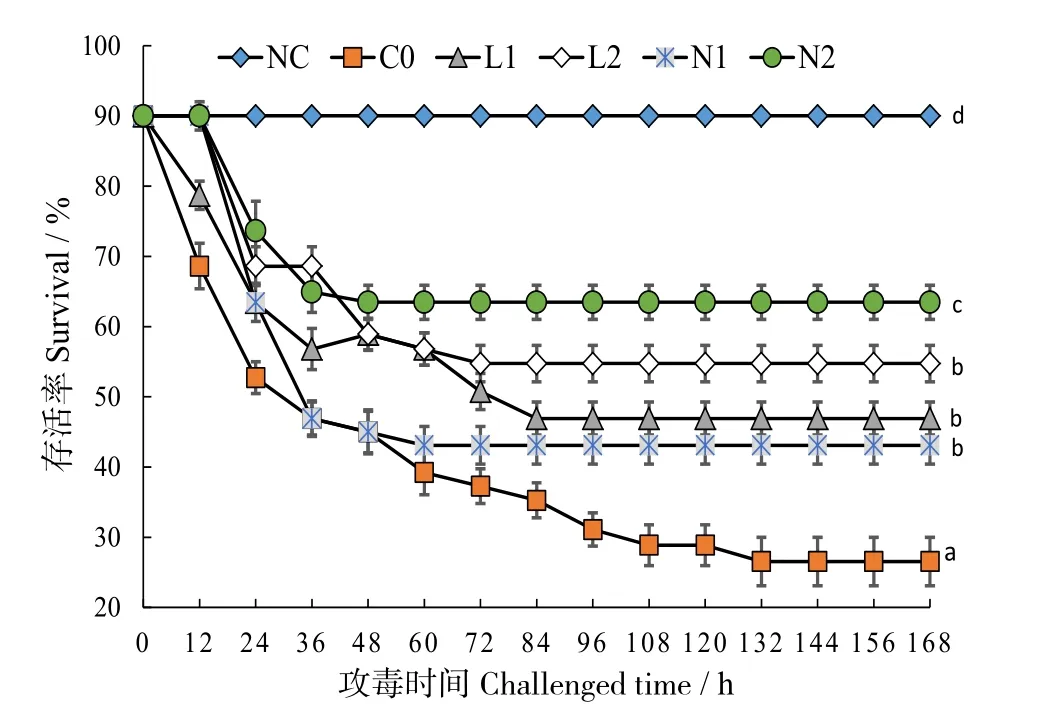
圖4 珍珠龍膽石斑魚攻毒168 h 后累積存活率Fig.4 Survival rate of 168 h in Epinephelus fuscoguttatus♀ × E.lanceolatu after challenged by Vibrio harveyi
3 討論
3.1 酵母培養物對珍珠龍膽石斑魚生長性能的影響
本研究表明,珍珠龍膽石斑魚飼料中添加酵母培養物可顯著提高珍珠龍膽石斑魚生長性能和飼料利用率。N1、N2 組顯著提高體質量、增重率、特定生長率,降低飼料系數,說明發酵底物不含非蛋白氮的酵母培養物對珍珠龍膽石斑魚的生長性能和飼料利用率有較好的提升作用。這種良性影響可能與N1、N2 組酵母培養物的生物活性化合物(包括蛋白質、氨基酸、脂肪酸、維生素和多糖)有關,以及飼料酵母培養物對腸道消化酶的影響有關。同時,實驗組消化酶活性顯著提高,表明腸道增強了對飼料的消化吸收能力,推測N1、N2 組激發了較高的消化酶活性,從而提高飼料利用率。劉明等[18]指出,飼料中添加酵母培養物可顯著提高凡納濱對蝦(Litopenaeus vannamei)腸道消化酶活性,并降低飼料系數;李高峰[19]也報道了酵母培養物可顯著降低團頭魴(Megalobrama amblycephala)飼料系數,與本研究結果一致。添加酵母培養物的飼料對珍珠龍膽石斑魚魚體蛋白質、脂質和灰分含量有顯著的積極影響,亦表明酵母培養物可增強水生動物生長和生理機能。以增重率為判據,添加酵母培養物可通過促進體內腸道消化酶分泌,提高珍珠龍膽石斑魚生長性能,雖在發酵底物添加非蛋白氮可提高酵母培養物粗蛋白質量分數(55%),但與未添加非蛋白氮組(粗蛋白質量分數50%)相比生長性能無顯著差異。
3.2 酵母培養物對珍珠龍膽石斑魚血清生化、抗氧化的影響
血清生化指標與水生動物的生理、營養和疾病有密切聯系,可準確反映水生動物健康情況[20]。葡萄糖為魚類抗應激代謝參數的指標,本研究中,N2組珍珠龍膽石斑魚血清葡萄糖在飼喂酵母培養物后顯著降低,可能由酵母培養物中含免疫刺激劑β-葡聚糖所致[21]。酵母培養物主要成分除酵母菌體蛋白外,還含有大量β-葡聚糖、甘露寡糖[22]。在動物體內,β-葡聚糖可通過激活PI3K/AKT 途徑降低血糖。TG 和CHO 是魚類血脂的關鍵成分,二者含量高低可反映魚體脂類代謝狀況,高含量會對魚類肝胰臟產生損傷[23]。本研究中,用酵母培養物飼喂珍珠龍膽石斑魚時,除N1 組TG 顯著升高外,其余各組無顯著差異,且各組間CHO 無顯著差異。N1 組TG 的升高可能與酵母培養物添加量有關,具體機制需進一步驗證。總體而言,飼料中添加酵母培養物不會對珍珠龍膽石斑魚造成不良影響。課題組前期研究發現,飼料添加酵母培養物對凡納濱對蝦(Litopenaeus vannamei)血清中TG 和CHO 含量無顯著影響[24],與珍珠龍膽石斑魚研究結果一致。
養殖動物代謝活動常產生多種活性氧 (ROS),可能導致氧化應激。SOD 可將超氧陰離子轉化為過氧化氫和氧氣,從而構成抗氧化酶防御第一道防線,已用作確定魚類氧化應激狀況分子標志物[25]。CAT 為一種抗氧化酶,在水生動物免疫反應中可催化過氧化氫分子轉化為水和氧[26]。MDA 是脂質過氧化的主要產物,反映了脂質氧化的程度[21]。本研究中,N2 組血清SOD、CAT 含量攻毒后顯著高于對照組。與用酵母培養物飼喂凡納濱對蝦[9,27]、黃顙魚(Pelteobagrus fulvidraco)[28]和斑點叉尾鮰(Ictalurus punetaus)[29]的結果一致。N2 組MDA 含量攻毒后最低且顯著低于其余各組,與凡納濱對蝦飼料中添加酵母培養物的結果一致[24]。酵母培養物可增強抗氧化能力可能與酵母細胞富含維生素有關(B 族復合維生素可降低單核細胞中由H2O2引起的氧化應激[30])。本研究中,N 組抗氧化水平高于L 組,這可能與兩種酵母培養物的發酵方式有關,L 組發酵底物含非蛋白氮,而N 組發酵底物不含非蛋白氮。具體作用機制需進一步研究。AST 和ALT是存在于肝細胞細胞質中的可溶性酶,其活性增強反映了肝損傷[31]。通過血清ALT 和AST 水平可知,酵母培養物對珍珠龍膽石斑魚并無不良影響,與草魚的相關研究結果一致[32]。推測酵母培養物在保護肝臟組織的同時,可增強魚類的抗氧化免疫系統。
LZM、AKP、ACP、TP、IgM 等先天免疫指標常用于魚類的非特異性免疫監測。TP 是先天免疫系統的重要組成部分,保護魚類免受潛在入侵生物的侵害[33-35]。本研究中,N2 組顯著提高血清TP。在凡納濱對蝦[36]中亦有類似結果。ACP 和AKP 是魚類體內重要的溶酶體酶,可水解和消化入侵的病原體,在免疫應激反應中發揮重要作用,是免疫系統巨噬細胞活化的特征標記物[36]。魚體ACP 和AKP 活性升高表明免疫力相對增強。在珍珠龍膽石斑魚的飼料中添加甘露寡糖可刺激魚類的AKP 活性[37]。LZM是一種天然免疫酶,可溶解和消化感染性細菌。IgM是魚血清的主要免疫球蛋白,可作為反映魚免疫狀態的標志物[38]。大量研究表明,酵母培養物對天然免疫反應有積極影響。在烏蘇里鲇(Pseudobagrus ussuriensis)中,添加質量分數10%的飼料酵母培養物可提高血漿中ACP、AKP 和血清中LZM 含量,表明先天免疫反應得以改善[39]。飼料中添加兩種組合的酵母培養物可改善虹鱒(Oncorhynchus mykiss)先天免疫反應[40]。雷宇杰等[29]研究表明,飼料添加酵母培養物可提高斑點叉尾鮰血清LZM 的含量。李高峰[19]研究證實,團頭魴(Megalobrama amblycephala)飼料中酵母培養物的添加可提高其非特異性免疫反應。飼料中添加酵母培養物可增強異育銀鯽(Carassius auratus gibelioCAS Ⅲ)[41]和凡納濱對蝦[18]的非特異性免疫反應。本研究發現,攻毒后N2 組血清ACP、AKP 含量顯著高于對照組,而LZM 含量高于對照組但無顯著差異。此外,N2 組IgM 攻毒后含量最高且顯著對照組,再次表明飼料中添加質量分數4%酵母培養物可增強珍珠龍膽石斑魚的非特異性免疫應答。酵母培養物可提高魚類免疫力可能與其含有的甘露寡糖以及β-葡聚糖有關。有研究表明,甘露寡糖和β-葡聚糖可激活機體免疫系統[42],β-葡聚糖可與水產動物機體內巨噬細胞結合,進而激活巨噬細胞活性,激發機體免疫反應,從而清除機體內病原微生物[43]。甘露寡糖有一定的免疫刺激作用,可與Toll 樣受體4(TLR-4)結合,提高機體免疫應答反應[44]。本研究表明,N 組石斑魚先天免疫反應的改善高于L 組,N 組中以N2 組酵母培養物效果最佳。這是否與酵母培養物發酵底物中非蛋白氮的添加有關,有待進一步研究。
3.3 酵母培養物對珍珠龍膽石斑魚腸道形態和抗病力的影響
腸道形態和結構對吸收營養物質和維持正常功能至關重要[45-47]。絨毛在吸收營養物質和提高生長性能方面有重要作用[48],腸壁功能取決于絨毛長度。建鯉(Cyprinus carpiovar.Jian)幼魚飼料中添加酵母水解物可增加腸道絨毛高度,提高生長性能[49]。此外,酵母培養物中的甘露寡糖增加凡納濱對蝦的腸道絨毛長度[50],說明飼料甘露寡糖可有效調控腸道絨毛結構。本研究中,飼料添加酵母培養物對珍珠龍膽石斑魚的絨毛高度和寬度有顯著促進作用,從而進一步提高石斑魚的生長性能,可能與酵母培養物中含甘露寡糖有關。
養殖動物傳染病暴發是水產養殖業發展的瓶頸問題。弧菌是石斑魚傳染病的病原體之一,常導致集約化高密度養殖的石斑魚大量死亡,給養殖戶造成嚴重經濟損失[51-55]。本研究中,飼以添加酵母培養物飼料,珍珠龍膽石斑魚對哈維氏弧菌有顯著的抵抗作用,尤其是N2 組。與飼以含有質量分數1%酵母培養物對蝦的研究結果一致[56]。對哈維氏弧菌的抵抗力增強,表明酵母培養物可刺激和延長珍珠龍膽石斑魚對病原性感染的免疫應答。
4 結論
本研究表明,在珍珠龍膽石斑魚飼料中添加酵母培養物可顯著提高其生長性能、血清免疫力和抗菌能力。還對腸道形態和結構有積極影響。在本實驗條件下,以增重率、免疫指標和累積存活率為判據,飼料中添加4%的酵母培養物 (發酵底物不含非蛋白氮) 對珍珠龍膽石斑魚生長性能、免疫和抗病能力有最顯著促進作用,發酵底物添加非蛋白氮可提高酵母培養物粗蛋白含量,但與未添加非蛋白氮組相比對生長性能并無顯著促進作用。

