對新修訂《藥品生產監督管理辦法》中藥品生產許可延續條款的評析和建議
梁云 邵蓉
中圖分類號 R951 文獻標志碼 A 文章編號 1001-0408(2021)09-1032-06
DOI 10.6039/j.issn.1001-0408.2021.09.02
摘 要 目的:為有關部門進一步明確藥品生產許可延續的定義和適用規則、加強藥品生產監督管理提供參考。方法:通過對比研究、文獻研究、實證研究與新規章的解讀,從藥品生產許可延續的定義出發,結合實際案例和基層實踐,對《藥品生產監督管理辦法》中藥品生產許可延續的定義、存在問題、修訂要點等方面進行全面評析,并提出相應適用建議。結果與結論:在定義方面,藥品生產許可延續是指藥品生產企業如果還需要在其藥品生產許可證有效期屆滿后繼續從事藥品生產有關活動的,應當在有效期屆滿前六個月,向省級藥品監督管理部門申請延續其藥品生產許可證有效期的行為。在主要問題方面,主要存在行政機關是否可以受理相對人逾期提交的申請不明確、行政機關換發藥品生產許可證的審查標準不合理、“視為同意換證”模式許可規則的后續程序不規范等問題。新修訂《藥品生產監督管理辦法》規定,藥品生產許可證的換發不再需要按照藥品生產企業開辦的程序和要求進行審查,而是根據風險管理原則進行審查。這些修訂內容體現了強化風險管理、形成風險閉環的原則,明確了藥品生產許可延續的審查標準,優化了審批條件和要求,提高了行政許可的效率。在適用情形方面,建議明確藥品生產許可延續受理與決定的時限和有效性,賦予行政機關對逾期延續申請受理的自由裁量權。
關鍵詞 藥品管理法;藥品生產監督管理辦法;行政許可法;修訂;藥品生產許可延續
Comment and Suggestion on the Renewal Clause of the Drug Production License in the Newly Revised Measures for Supervision and Administration of Pharmaceutical Production
LIANG Yun,SHAO Rong(National Drug Policy and Medical Industry Economy Research Center, China Pharmaceutical University, Nanjing 211198, China)
ABSTRACT? ?OBJECTIVE: To provide reference for the relevant departments to further clarify the definition and applicable rules of drug production license renewal, and strengthen the supervision and administration of drug production. METHODS: Through comparative study, literature study, empirical study and the interpretation of new regulations, from the definition of drug production license renewal, combined with actual cases and grass-roots practice, drug production license renewal in the Measures for Supervision and Administration of Pharmaceutical Production were comprehensively evaluated and analyzed in terms of the definition, existing problems and revision points. The relevent application suggestion was put forward. RESULTS & CONCLUSIONS: In terms of definition, the renewal of the drug production license refers to the behavior of a drug manufacturer that needs to continue to engage in drug production activities after the expiration of the validity period, and should apply to the original issuing authority to extend the validity period of the drug production administrative license at 6 months before the expiration of the validity period. In terms of the main problems, there are some problems, such as whether the administrative organ can accept the application submitted after the deadline is not clear; the examination standard of the administrative organ to renew the drug production license is unreasonable; the follow-up procedure of the license rule of the “deemed to agree to renew the license” mode is not standardized. The renewal of the drug production license in the newly revised Measures for the Supervision and Administration of Pharmaceutical Production no longer needs to be reviewed in accordance with the procedures and requirements of the drug manufacturer, but in accordance with the principles of risk management, which reflecting the principle of strengthening risk management and forming risk closed-loop, defining the review standard of drug production license renewal, optimizing the conditions and requirements of approval, and improving the effectiveness of administrative license. In terms of application, it is suggested to clarify the time limit and validity of the acceptance and decision of drug production license renewal, and grant administrative agencies with the discretion to accept the application for overdue renewal.
KEYWORDS? ?Pharmaceutical Administration Law;Measures for Supervision and Administration of Pharmaceutical Production;Administrative License Law;Revise; Drug production license renewal
為貫徹落實2019年新修訂《藥品管理法》[1],加強藥品生產監督管理,國家藥品監督管理局對原《藥品生產監督管理辦法》[2]進行了全面修訂,并于2020年7月1日起施行。此次修訂的《藥品生產監督管理辦法》[3],目的在于全面貫徹和落實新修訂《藥品管理法》對藥品生產監督管理的最新要求,解決當前我國藥品生產監管所面臨的突出問題,進一步強化藥品全生命周期管理,守住藥品質量安全底線,從而保障人民用藥安全[4]。此次《藥品生產監督管理辦法》的修訂在總體思路和具體條款上均有重大調整。其中,對延續藥品生產許可證條款,即《藥品生產監督管理辦法》第十九條也進行了修訂,體現了風險管理的原則。筆者將從藥品生產許可延續的定義出發,結合實際案例,對藥品生產許可延續的定義、存在問題和修訂要點等方面進行全面評析,并提出相應適應建議,以期為有關部門進一步明確藥品生產許可延續的定義和適用規則、加強藥品生產監督管理提供參考。
1 藥品生產許可延續的定義
《行政許可法》第五十條第一款規定,“被許可人需要延續依法取得的行政許可的有效期的,應當在該行政許可有效期屆滿三十日前向作出行政許可決定的行政機關提出申請。但是,法律、法規、規章另有規定的,依照其規定”[5]。由此可知,所謂許可延續一般是指被許可人如果還需要在其行政許可有效期屆滿后繼續從事有關活動的,應當在有效期屆滿前,向行政機關申請延伸行政許可有效期的行為[6]。
換發藥品生產許可證屬于行政許可事項,受《行政許可法》的調整。《藥品生產監督管理辦法》作為部門規章,對如何延續藥品生產許可證進行了具體規定。原《藥品生產監督管理辦法》第十九條規定,藥品生產許可證有效期屆滿,需要繼續生產藥品的,藥品生產企業應當在有效期屆滿前六個月,向原發證機關申請換發藥品生產許可證。原發證機關結合企業遵守法律法規、《藥品生產質量管理規范》和質量體系運行情況,按照本辦法關于藥品生產企業開辦的程序和要求進行審查,在藥品生產許可證有效期屆滿前作出是否準予其換證的決定。符合規定準予換證的,收回原證,換發新證;不符合規定的,作出不予換證的書面決定,并說明理由,同時告知申請人享有依法申請行政復議或者提起行政訴訟的權利;逾期未作出決定的,視為同意換證,并予補辦相應手續[2]。
綜上,筆者認為所謂藥品生產許可延續就是指藥品生產企業如果還需要在其藥品生產許可證有效期屆滿后繼續從事藥品生產有關活動的,應當在有效期屆滿前六個月,向省級藥品監督管理部門申請延續其藥品生產許可證有效期的行為。
2 原藥品生產許可延續條款存在的主要問題
原《藥品生產監督管理辦法》第十九條規定了藥品生產許可延續的相關規則,包括一般規則以及“視為同意換證”的默示許可的特殊規則。看似簡單的藥品生產許可延續規則,在具體適用中卻引發了較多的爭議,筆者選取了一些實踐執法中發生的典型案例進行評析。
2.1 典型案例
案例1:某省藥品監督管理局(以下簡稱“藥監局”)為A藥品生產企業換發藥品生產許可證,批準生產時間為2015年9月1日至2020年8月31日。2020年8月7日,A藥品生產企業向該省藥監局提交延續藥品生產許可證申請。2020年9月1日,該省藥監局作出決定,同意A藥品生產企業的藥品生產許可證延續申請,并重新發證。甲作為利害關系人,認為A藥品生產企業未在法定期限內對藥品生產許可證延續提出申請,其藥品生產權已經終止,該省藥監局超期作出重新發證的決定違法,請求法院撤銷該省藥監局對A藥品生產企業作出的許可延續決定。
案例2:B藥品生產企業的藥品生產許可證有效期為2011年9月1日至2015年8月31日。在有效期屆滿前六個月,B藥品生產企業向某省藥監局提出許可延續申請。該省藥監局在受理后根據原《藥品生產監督管理辦法》的規定,以B藥品生產企業沒有配備必要的儀器設備為由作出不予行政許可決定。B藥品生產企業不服,認為申請延續藥品生產許可權行政許可不應適用開辦標準的規定,其在藥品生產許可有效期內,并沒有受到行政機關的行政處罰,應適用原《藥品生產監督管理辦法》第十九條關于延續的規定,行政機關應當予以重新發證,遂向法院提起行政訴訟。
案例3:2017年11月,夏某通過藥品投訴舉報電話12331,稱C藥品生產企業的藥品生產許可證已過期。該省藥監局告知夏某,C藥品生產企業已經在法定期限內向該省藥監局提交了許可延續申請,因其申報材料尚需補充完善,該省藥監局對其延續申請采取默示許可,其藥品生產許可予以延續,但尚未重新發證。夏某不服,向法院提起行政訴訟。
2.2 主要問題分析
上述典型案例反映了藥品生產許可延續條款在基層執法實踐中主要存在以下問題。
2.2.1 行政機關是否可以受理相對人逾期提交的申請不明確 雖然原《藥品生產監督管理辦法》第十九條第一款規定,“藥品生產企業藥品生產許可證有效期屆滿,需要繼續生產藥品的,應當在有效期屆滿前六個月提出延續許可申請”[2]。但是,該款并沒有明確規定,如果相對人逾期提交藥品生產許可延續申請,省級藥品監督管理部門是否能以相對人逾期提交為由不予受理?同時,該款也沒有明確申請人逾期提交藥品生產許可延續的后果。例如在上述案例1中,A藥品生產企業按照原《藥品生產監督管理辦法》第十九條第一款規定,應當在有效期屆滿前六個月,即2020年2月29日前提出延續許可申請,但A藥品生產企業直到2020年8月7日才提起延續申請,屬于逾期申請,但在此案例中,該省藥監局還是受理了A藥品生產企業的換證申請,這種做法是否違法?而且,該省藥監局還作出了重新發證的行政許可決定,該重新發放藥品生產許可證的行政許可決定是否有效且合法?上述問題在實際執法中,均存在不同意見,造成基層監管人員的執法困惑。
2.2.2 行政機關換發藥品生產許可證的審查標準不合理 《行政許可法》第五十條沒有明確規定行政許可延續的審查標準,這為下位法留下了立法空間。原《藥品監督管理辦法》第十九條明確規定,行政機關應當按照本辦法關于藥品生產企業開辦的程序和要求進行審查。在上述案例2中,B藥品生產企業認為換發藥品生產許可證時,行政機關用新開辦的標準對其進行審查的做法不合理,故訴至法院。那么,在換發藥品生產許可證時,行政機關是否有必要一定要按照開辦時的要求去審查換證企業?這么做既增加了申請人的負擔,又增加了行政許可的成本。如果不按照新開辦的標準去審查,那么行政機關應當按照什么標準去審查換證企業,以保證換發藥品生產許可證后的企業也符合藥品生產條件和要求?審查標準設置的不合理既導致行政機關無法可依,可隨意審查,又導致行政許可相對人的困惑,增加了許可成本。
2.2.3 “視為同意換證”默示許可特殊規則的后續程序不規范 原《藥品生產監督管理辦法》第十九條第二款中“逾期未作出決定的,視為同意重新發證,并予補辦相應手續”的規定,源自《行政許可法》第五十條第二款中“視為準予延續”這一行政許可延續的特殊規則,目的在于督促行政機關及時高效地審查許可延續申請[7]。但該項規則在實際執行中仍遇到很多問題,例如在上述案例3中,某省藥監局受理了C藥品生產企業的換證申請,但逾期未作出行政許可決定,是否可以直接適用該規則認定C藥品生產企業直接獲得新的藥品生產許可證?如果認為C藥品生產企業已經獲得了新的藥品生產許可證又將引發新的問題,即該藥品生產許可證是否有效期也是5年?如果該省藥監局對C藥品生產企業后來又作出了不予換證的決定,而該企業在這段時間生產了藥品,該藥品如何定性?是屬于合法生產的藥品還是無證生產的藥品?行政機關是否可以對其進行處罰?上述種種問題就是推定默示延續許可缺乏后續程序規范,導致存在超期推定延續效力隱形狀態和許可延續效力外化的矛盾[7]。此外,該條款中所提及的“逾期”中的“期”是指藥品生產許可證有效期屆滿的日期還是指行政機關換發藥品生產許可證的期限日期?這在實踐中會有不同的解讀,從而造成執法困惑。
3 新修訂《藥品生產監督管理辦法》中藥品生產許可延續條款的修訂要點
新修訂《藥品生產監督管理辦法》第十九條規定,“藥品生產許可證有效期屆滿,需要繼續生產藥品的,應當在有效期屆滿前六個月,向原發證機關申請重新發放藥品生產許可證。原發證機關結合企業遵守藥品管理法律法規、藥品生產質量管理規范和質量體系運行情況,根據風險管理原則進行審查,在藥品生產許可證有效期屆滿前作出是否準予其重新發證的決定。符合規定準予重新發證的,收回原證,重新發證;不符合規定的,作出不予重新發證的書面決定,并說明理由,同時告知申請人享有依法申請行政復議或者提起行政訴訟的權利;逾期未作出決定的,視為同意重新發證,并予補辦相應手續”[3]。與原辦法相比,新修訂《藥品生產監督管理辦法》第十九條在簡化行政許可材料和程序、提高延續許可效率上有一定的進步,修訂的要點主要有以下幾個方面。
3.1 明確規定換發藥品生產許可的申請期限
新修訂《藥品生產監督管理辦法》規定重新換發藥品生產許可證的時限是在“有效期屆滿前六個月”,這與《行政許可法》規定的“有效期屆滿三十日前”雖有沖突,但《行政許可法》同時也規定了但書條款,即“但是,法律、法規、規章另有規定的,依照其規定” 。因此,新修訂《藥品生產監督管理辦法》作為部門規章,是可以突破《行政許可法》第五十條第一款的規定,就藥品生產許可證延續的特殊情況設置特別時限[8]。
3.2 合理設置行政機關換發藥品生產許可證的審查標準
新修訂《藥品生產監督管理辦法》規定原發證機關(即各省藥品監督管理部門)重新換發藥品生產許可證的審查依據基于以下3點:①企業遵守藥品管理法律法規的情況,即換證企業是否有違法違規情況;②藥品生產質量管理規范和質量體系運行情況,即換證企業是否有違反《藥品生產質量管理規范》(GMP)的情況;③根據風險管理原則進行審查,即按照風險等級對換證企業進行分類管理。對比原辦法第十九條的規定,新修訂辦法第十九條最大的變化就在于此。原《藥品生產監督管理辦法》第十九條要求發證機關的審查依據是“原發證機關結合企業遵守法律法規、《藥品生產質量管理規范》和質量體系運行情況,按照本辦法關于藥品生產企業開辦的程序和要求進行審查”[2]。也就是說,在新修訂《藥品生產監督管理辦法》規定下藥品生產許可證的延續不再需要按照藥品生產企業開辦的程序和要求進行審查,而是根據風險管理原則進行審查。此項規定體現了新修訂《藥品生產監督管理辦法》強化風險管理、形成風險閉環的原則,明確了藥品生產許可延續的審查標準,優化了審批條件和要求,提高了行政許可的效率。
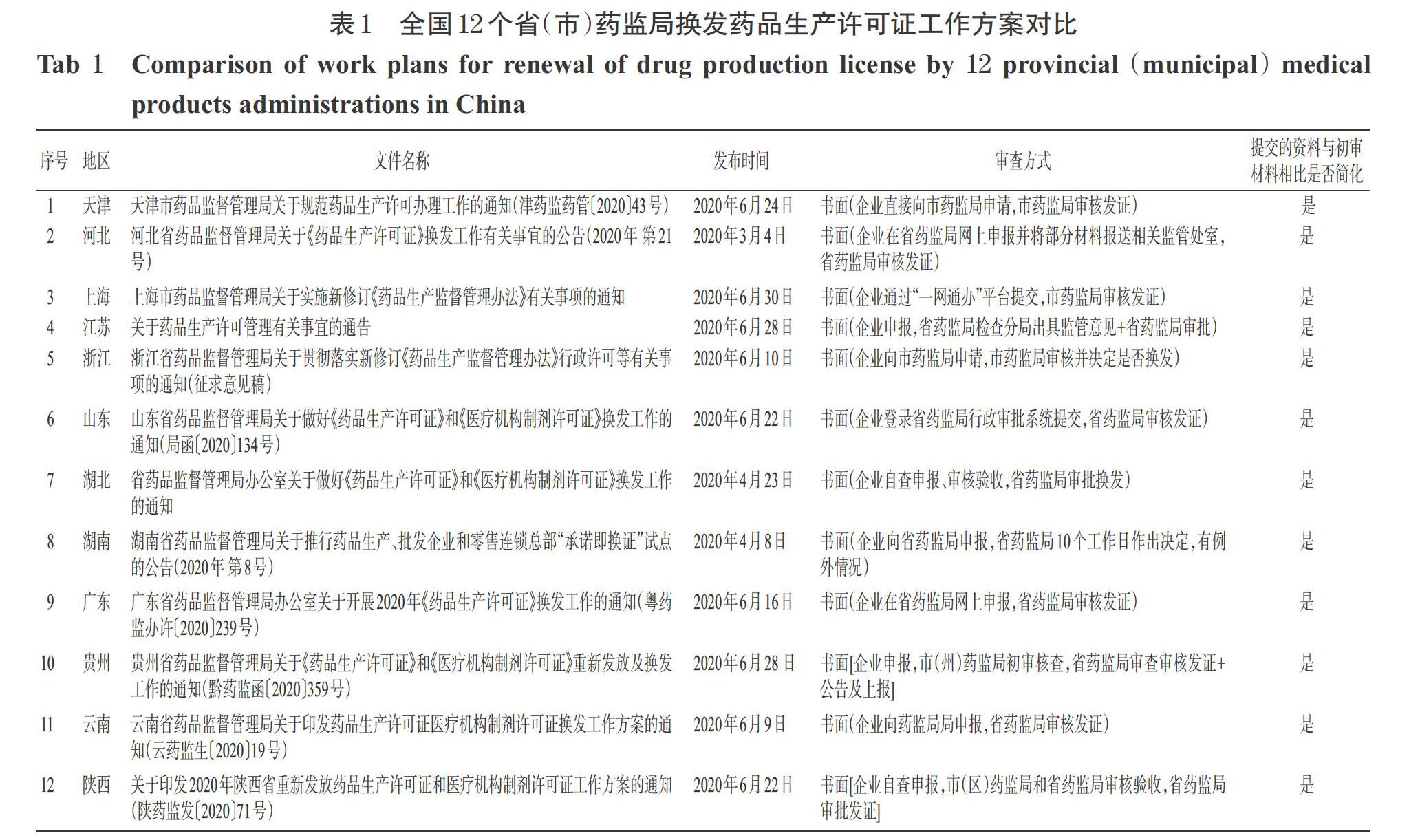
在實際執行中,筆者通過查詢全國各省藥監局官方網站發現,截至2020年7月13日,共有12個省(市)藥監局已經下發了換發藥品生產許可證的工作方案通知。筆者對各省(市)藥監局通知中的審查方式和提交的資料進行了統計,結果見表1。
從表1可以看出,已發布通知的12個省(市)藥監局要求換證企業提交的資料與初審材料相比均有簡化,但審查方式有3種模式:第一種模式是“企業向省藥監局申報、省藥監局發證”模式。根據新修訂《藥品生產監督管理辦法》第五條第二款規定,“省、自治區、直轄市藥品監督管理部門負責本行政區域內的藥品生產監督管理,承擔藥品生產環節的許可、檢查和處罰等工作”[3]。隨著各省新一輪機構改革的落地,不再單獨設立市縣級藥品監督管理部門,藥品生產監督管理工作統一由省一級藥監局承擔,故此種換證模式在實踐中多為各省(市)藥監局采用,其中天津、河北、上海、江蘇、云南、山東、湖北、湖南、廣東等地均采用此種模式。第二種模式是“企業向市藥監局申報,由市藥監局發證”模式,浙江省藥監局即采用此種模式。第三種模式是“企業向省藥監局申報,先由市藥監局和省藥監局初審、再由省藥監局發證”模式,貴州和陜西省藥監局均采用此種模式。
此外,在新修訂《藥品生產監督管理辦法》第十九條中,還明確了發證機關必須在藥品生產許可證有效期屆滿前作出是否準予其重新發證的決定。
3.3 明確規定換發藥品生產許可證的3種后果
新修訂《藥品生產監督管理辦法》第十九條中還規定了換發藥品生產許可證的3種后果:一是準予換發,即符合規定準予重新發證的,收回原證,重新發證;同時,在《國家藥監局關于實施新修訂<藥品生產監督管理辦法>有關事項的公告》第二點中規定,重新發證的有效期自發證之日起計算[9]。二是不予換發,即不符合規定的,作出不予重新發證的書面決定,并說明理由,同時告知申請人享有依法申請行政復議或者提起行政訴訟的權利。三是視為同意換證,即逾期未作出決定的,視為同意重新發證,并予補辦相應手續。
4 新修訂《藥品生產監督管理辦法》中藥品生產許可延續條款的本質和適用建議
雖然新修訂《藥品生產監督管理辦法》第十九條在簡化行政許可材料和程序、減輕被許可人負擔、提高行政許可效率上有一定進步,但仍有一些問題并沒有得到很好的解決,即便這些問題是上位法《行政許可法》所帶來的,但是因為許可法有授權性條款的規定,筆者認為,作為部門規章的《藥品生產監督管理辦法》是可以在藥品生產許可延續條款上作一些探索。
4.1 條款本質
對藥品生產許可延續條款進行優化,首先要清楚,究竟藥品生產許可延續是一個新的許可還是許可的簡單延續?有學者從英文“Renewal”意為“重新建立法律關系或者以新的合同代替舊的合同”這一角度出發,認為延續的實質是重新作出許可決定[10-11]。也有學者通過對比美國的許可證更新制度(License renewal)認為,有數量控制的許可的延續為新的行政許可,而沒有數量控制的一般許可延續為原有行政許可有效期的延長[12]。
在實踐中,對藥品生產許可延續的本質認識,有兩種觀點:一種觀點認為,既然藥品生產許可證是重新換發,規章規定了時限和要求,符合《行政許可法》的規定,就是一項新的行政許可;另一種觀點認為,換發藥品生產許可證只是對藥品生產企業生產藥品能力的延續性認可,換發后的藥品生產許可證編號與原證一樣,保持不變,因此不是一項新的行政許可,可以簡化流程、縮短時限,甚至只需要告知性備案即可。這些觀點固然有其合理性,但是對藥品生產許可延續本質的探索還需要追溯到藥品生產許可制度設計的初衷,即有效控制藥品安全風險、合理配置藥品生產資源。藥品生產許可最基本的原則和要求就是有效控制藥品安全風險:企業新申辦藥品生產許可必須符合藥品生產企業的開辦條件,而行政機關根據企業提交的材料和現場審核,判斷企業是否能夠達到有效控制藥品安全風險的要求,從而決定是否發放藥品生產許可證。當藥品生產許可證有效期屆滿后,行政機關還需要根據當時的法律法規要求,對企業重新進行評估,再次作出行政許可。因此,從有效控制藥品安全風險的角度看,藥品生產許可延續的本質是一個新的行政許可行為。但與新申辦藥品生產許可相比,藥品生產許可延續是一項“新”的行政許可。“新”主要體現在時限、申請材料和程序上可以簡化:首先,新申辦藥品生產許可證沒有時間限制,而延續藥品生產許可證需要在有效期屆滿前六個月提出;其次,新申辦藥品生產許可證的審查時限是受理之日起三十日內作出決定、十日內頒發藥品生產許可證[8],而延續藥品生產許可證只需要在原許可有效期屆滿之前作出許可決定即可;再次,不論是在新修訂《藥品生產監督管理辦法》第十九條還是在實踐中,相較于新申辦藥品生產許可證,延續的申請材料都較為簡單(如河北省藥監局在公告中要求企業到期換發許可證的申報資料僅有行政審批事項申請承諾書、法定代表人授權委托書、行政許可申請書、藥品生產許可證申請表和自查報告等5項內容[13]);最后,延續藥品生產許可證的流程也比新申辦藥品生產許可證的流程簡化很多(如在表1中,大多數省藥監局都是采取了“企業向省藥監局申報、省藥監局發證”模式),大大縮短了審批時限。還有個別省藥監局,如湖南省藥監局對藥品生產、批發企業和零售連鎖總部采取“承諾即換證”的方式,所謂“承諾即換證”,是指許可證書有效期即將屆滿的藥品生產、批發企業和零售連鎖總部,依法向省藥監局提交換證申請和相關資料并作出持續符合許可條件的書面承諾后,省藥監局按照法定條件和標準,依法依規進行審查,符合條件的即換發許可證書的工作方式[14]。這是湖南省藥監局按照環節最少、資料最簡、時限最短的目標,探索改革審批管理方式,提高行政審批服務效能,全面加強事中、事后綜合監管,全面落實企業主體責任的一大舉措。
4.2 適用建議
以申請人遞交延續藥品生產許可證申請的時間段來劃分,在不同的階段,藥品生產許可延續申請人的權利和許可延續處理效果存在較大區別。
4.2.1 在藥品生產許可證有效期屆滿前六個月階段申請的適用建議 如果申請人在藥品生產許可證有效期屆滿前六個月提交換證申請的,有關部門應當按照新修訂《藥品生產監督管理辦法》第十九條的規定受理申請,如不予受理,應當說明理由。受理后的處理可能有兩種情形:一是有關部門在原證有效期屆滿前作出決定的——如符合規定,重新發證,收回原證;如不符合規定,不予發證,并說明理由,告知申請人享有依法申請行政復議或者提起行政訴訟的權利。二是有關部門在原證有效期屆滿后作出決定的。這種情形申請人可以適用“視為同意換證”的默示許可的特殊規則,申請人可以繼續從事藥品生產行為,直到有關部門作出決定,此間生產藥品的行為不按無證生產藥品行為處理。如果此后有關部門重新發證,則申請人的生產行為可以延續;如果有關部門不予發證,則申請人應當立即停止生產行為。
4.2.2 在藥品生產許可證有效期屆滿前六個月內至藥品生產許可證有效期屆滿之日之間申請的適用建議 如果申請人在藥品生產許可證有效期屆滿前六個月內至藥品生產許可證有效期屆滿之日之間提交換證申請的,這種情形實際上不符合新修訂《藥品生產監督管理辦法》第十九條的規定,屬于逾期提交換證申請,有關部門可以受理,也可以不予受理,有自由裁量的權力。但在實踐中,有關部門一般會予以受理。受理后的處理可能有兩種情形:一是有關部門在原證有效期屆滿前作出決定的——如符合規定,重新發證,收回原證;如不符合規定,不予發證,并說明理由,告知申請人享有依法申請行政復議或者提起行政訴訟的權利。二是有關部門在原證有效期屆滿后作出決定的。這種情形申請人則不適用“視為同意換證”的默示許可的特殊規則,因為申請人逾期申請,導致其原證在有效期屆滿時失去效力,因此申請人在有關部門作出是否換證決定的期間,不再享有原藥品生產許可的權利,如在此期間有生產藥品的行為,則按無證生產藥品行為處理。如果此后有關部門重新發證,則申請人可以從換證之日起恢復生產行為;如果有關部門不予發證,則申請人不再獲得藥品生產許可,且有關部門應當及時注銷原藥品生產許可證。
4.2.3 在藥品生產許可證有效期屆滿之后申請的適用建議 如果申請人在藥品生產許可證有效期屆滿之后遞交換證申請的,有關部門應當一律不予受理。此時原被許可人的藥品生產許可已經失去效力,許可連貫性已經喪失,不應再適用許可延續條款。行政機關應當注銷原藥品生產許可證。原被許可人如果想繼續從事藥品生產的,只能依照新申辦情形,重新向有關部門申請藥品生產許可。
5 結語
《藥品管理法實施條例》第八條規定,藥品生產許可證的有效期為五年[15]。2020年是全國藥品生產企業集中換證的“大年”,又涉及到新舊《藥品管理法》的銜接,如何厘清藥品生產許可延續條款,明確藥品生產許可延續受理與決定的時限和有效性,賦予行政機關對逾期換證申請受理的自由裁量權,對做好藥品生產許可證換發工作具有重要的意義。新修訂《藥品生產監督管理辦法》第十九條立法本意主要是為行政機關留出重新審查換證申請的充分時間,但行政機關完全有能力通過自由裁量權來判斷能否受理,如果一概不予受理,可能會中斷前后相繼兩個行政許可的連續性,也增加了行政成本[7]。另外,為更好保障申請人的合法權益,筆者建議在實踐中,行政機關首先可以在藥品生產許可有效期屆滿前六個月,通過短信告知或者采取其他信息手段,對藥品生產許可證即將到期的申請人進行催告,督促其盡快提交換證申請;其次,如果行政機關受理了申請人提交的逾期換證申請,應當用合適方式告知申請人,在藥品生產許可有效期屆滿之后至行政機關作出延續與否的決定期間不得從事原藥品生產行為,否則視為無藥品生產許可證生產藥品的違法行為而承擔相應法律責任,以避免引起行政糾紛。
參考文獻
[ 1 ] 全國人民代表大會.中華人民共和國藥品管理法[S]. 2019- 08-26.
[ 2 ] 國家食品藥品監督管理總局.藥品生產監督管理辦法[S]. 2017-11-17.
[ 3 ] 國家市場監督管理總局.藥品生產監督管理辦法[S]. 2020- 01-22.
[ 4 ] 國家市場監督管理總局. 國家市場監督管理總局關于《藥品生產監督管理辦法(征求意見稿)》《藥品經營監督管理辦法(征求意見稿)》公開征求意見的公告[EB/OL].(2019-12-10)[2020-07-27]. http://www.samr.gov.cn/hd/zjdc/201912/t20191210_309140.html.
[ 5 ] 全國人民代表大會. 中華人民共和國行政許可法[S]. 2019- 04-23.
[ 6 ] 全國人民代表大會常務委員會.中華人民共和國行政許可法釋義[EB/OL]. (2004-10-26)[2020-07-27]. http://www.npc.gov.cn/npc/c2188/200410/9b1a966d2bf24687ad- 2a951cecc95fd7.shtml.
[ 7 ] 呂寧.行政許可延續規則適用的困境與優化:兼評《行政許可法》第50條[J].法律適用,2019(18):89-98.
[ 8 ] 徐曉明.行政許可超期推定延續法律效力問題研究[J].浙江學刊,2015(3):147-155.
[ 9 ] 國家藥品監督管理局. 國家藥監局關于實施新修訂《藥品生產監督管理辦法》有關事項的公告 [EB/OL].(2020- 03-30)[2020-07-27].http://www.gov.cn/zhengce/zheng- ceku/2020-04/01/content_5497935.htm.
[10] 薛波.元照英美法詞典[M].北京:北京大學出版社,2013:1179.
[11] 倪洪濤.論行政特許延續的阻卻[J].行政法學研究,2018(1):37-46.
[12] 肖澤晟.論許可證有效期的延續:基于《行政許可法》第五十條的解釋[J].浙江學刊,2016(3):146-154.
[13] 河北省藥品監督管理局. 河北省藥品監督管理局關于《藥品生產許可證》換發工作有關事宜的公告 [EB/OL].(2020-03-04)[2020-11-09].http://yjj.hebei.gov.cn/CL0132/ 76187.html.
[14] 湖南省藥品監督管理局. 湖南省藥品監督管理局關于推行藥品生產、批發企業和零售連鎖總部“承諾即換證”試點的公告[EB/OL].(2020-04-09)[2020-11-09].http://mpa.hunan.gov.cn/mpa/xxgk/tzgg/wjtz/202004/t20200409_11875098.html.
[15]國務院.藥品管理法實施條例[S]. 2019-03-02.
(收稿日期:2020-12-07 修回日期:2021-02-22)
(編輯:劉明偉)

